术前血液中性粒细胞与淋巴细胞比值在结肠癌患者中的表达及临床意义
吴宇辰 王胜 周云 梁忠
[摘要]目的 探討术前血液中性粒细胞与淋巴细胞比值(NLR)在结肠癌患者中的表达及临床意义。方法 选取2019年1~8月浙江省肿瘤医院收治的230例结肠癌患者作为结肠癌组,选取同期161例健康人群作为健康对照组。比较两组的血液NLR,同时收集结肠癌患者术后常规病理,比较不同病理特征的血液NLR。结果 结肠癌组的血液NLR高于健康对照组,差异有统计学意义(P<0.01)。M1期结肠癌患者的血液NLR高于M0期,差异有统计学意义(P<0.05)。肿瘤最大直径≥5 cm的结肠癌患者血液NLR高于最大直径<5 cm的患者,差异有统计学意义(P<0.01)。不同发生位置、分化类型、形态特征结肠癌患者的血液NLR比较,差异无统计学意义(P>0.05)。结论 术前检测结肠癌患者的血液NLR可反映患者与肿瘤相关的炎症状态,并提示肿瘤远处转移情况和肿瘤大小,对结肠癌的治疗和预后分析具有临床意义。
[关键词]结肠癌;中性粒细胞与淋巴细胞比值;病理特征;远处转移;肿瘤大小
[中图分类号] R735.3 [文献标识码] A [文章编号] 1674-4721(2020)8(a)-0016-04
Expression and clinical significance of blood neutrophil-to-lymphocyte ratio in colorectal cancer patients before surgery
WU Yu-chen WANG Sheng ZHOU Yun LIANG Zhong▲
Department of Clinical Laboratory, Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Zhejiang Province, Hangzhou 310022, China
[Abstract] Objective To analyze the expression and clinical significance of blood neutrophil-to-lymphocyte ratio (NLR) in colorectal cancer patients before surgery. Methods A total of 230 patients with colorectal cancer admitted to Zhejiang Cancer Hospital from January to August 2019 were selected as the colorectal cancer group, and 161 healthy subjects during the same period were selected as the healthy control group. The blood NLR in each group was compared. At the same time, routine pathology of colorectal cancer patients was collected and the blood NLR of different pathological features was compared. Results The blood NLR of the colorectal cancer group was higher than that of the healthy control group, and the difference was statistically significant (P<0.01). The blood NLR of patients with colorectal cancer of stage M1 was higher than that of stage M0, and the difference was statistically significant (P<0.05). The blood NLR of colorectal cancer patients with the maximum tumor diameter ≥5 cm was higher than that of patients with the maximum tumor diameter <5 cm, and the difference was statistically significant (P<0.01). There was no statistically significant difference in blood NLR of colorectal cancer patients with different occurrence locations, differentiation types, and morphological characteristics (P>0.05). Conclusion Preoperative detection of blood NLR in patients with colorectal cancer is not only a surrogate marker for tumor related inflammatory status, it also provides information regarding tumor size and presence of distant metastasis, which has clinical implications on treatment planning and disease prognosis.
[Key words] Colorectal cancer; Neutrophil-to-lymphocyte ratio; Pathological characteristics; Distant metastasis; Tumor size
结肠癌是全球高发的恶性肿瘤之一,其死亡率已上升至恶性肿瘤第三位[1]。随着社会的发展和人们生活方式的改变,结肠癌发病率呈逐年上升趋势。恶性肿瘤的发生发展与炎症微环境密不可分,炎症状态是恶性肿瘤进展与转移的关键[2]。据报道[3],持续的局部炎症反应导致结肠腺瘤进展为结肠癌的过程约10年。同时,由肿瘤引起的慢性炎症,会导致相应炎症因子和炎症细胞维持在较高水平[4-5]。当前,根治性手术仍是结肠癌的唯一治疗手段,术后病理特征对评估肿瘤患者治疗方案和预后具有重要价值。多项研究表明[6-8],恶性肿瘤患者血液中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)可评估肿瘤术后多种相关病理特征。本研究对230例已确诊结肠癌患者术前NLR和161例健康人群血液NLR进行回顾性分析,同时收集结肠癌患者术后常规病理结果,探讨血液NLR在结肠癌患者中的表达及临床意义,现报道如下。
1资料与方法
1.1一般资料
选取2019年1~8月浙江省肿瘤医院收治的230例结肠癌患者作为结肠癌组,选取同期161例健康人群作为健康对照组。结肠癌组中,男133例,女97例;年龄28~87岁,平均(60.75±11.80)岁。健康对照组中,男108例,女53例;年龄27~78岁,平均(59.42±11.60)岁。两组的一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:①所有结肠癌患者均为首诊住院患者;②所有结肠癌患者经手术治疗并经病理学检查确诊,病理类型均为结肠腺癌[9]。排除标准:①合并其他器官组织恶性肿瘤(结肠癌转移者除外);②合并高血压、糖尿病等血液及内分泌疾病;③合并自身免疫性疾病;④合并急性或慢性感染性疾病;⑤采血前已治疗或行有创检查;⑥临床资料不全者。本研究中所有资料收集已通过医院医学伦理委员会审核批准并征得患者及其家属知情同意。
1.2方法
收集结肠癌组患者术前1周内和健康对照组的外周血血常规资料,并计算NLR。中性粒细胞计数、淋巴细胞计数采用核酸荧光法由迈瑞全自动血细胞分析流水线CAL8000检测,检测试剂由迈瑞南京生物技术有限公司提供(批号:2019072506)。收集结肠癌患者术后常规病理报告结果,包括肿瘤位置、肿瘤体积、生长方式、分化程度、淋巴结活检阳性数目。所有结肠癌患者参照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM分期标准[10]进行严格分期,T指肿瘤原发灶的侵袭情况,N指区域淋巴结受累情况,M指远处转移情况。
1.3观察指标
比较结肠癌组和健康对照组血液NLR,比较结肠癌患者不同TNM分期、肿瘤大小、病理特征之间的血液NLR。病理特征包括肿瘤位置、肿瘤形态、分化类型,结肠癌按发生位置分为回盲部、升结肠、横结肠、降结肠和乙状结肠;按不同形态分为浸润型、溃疡型、隆起型、盘状型;按不同分化类型分为低、中、高分化及黏液腺癌。
1.4统计学方法
采用SPSS 22.0统计学软件进行数据分析,符合正态分布的计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,多组样本比较采用One-Way ANOVA检验,不符合正态分布者转换为正态分布后行统计学分析;计数资料采用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1结肠癌组与健康对照组血液NLR的比较
结肠癌组患者术前血液NLR为(3.25±2.16),健康对照组人群血液NLR为(2.11±1.01)。结肠癌组术前血液NLR高于健康对照组,差异有统计学意义(t=6.965,P<0.01)。
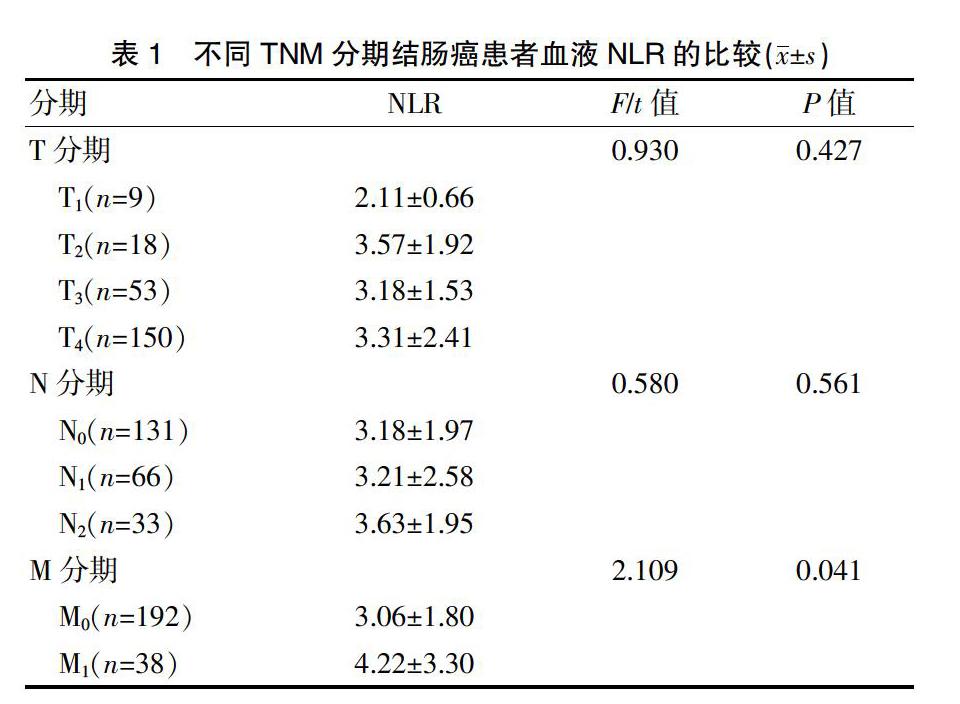
2.2不同TNM分期结肠癌患者血液NLR的比较
结肠癌T1~T4各分期的血液NLR比较,差异无统计学意义(P>0.05);N0~N2各分期的血液NLR比较,差异无统计学意义(P>0.05);M1分期的血液NLR高于M0分期,差异有统计学意义(P<0.05)(表1)。
2.3不同肿瘤大小术前血液NLR的比较
结肠肿瘤按其最大直径是否≥5 cm分为两类:最大直径≥5 cm的结肠肿瘤116例,血液NLR为(3.74±2.52);最大直径<5 cm的结肠肿瘤114例,血液NLR为(2.77±1.57)。瘤体最大直径≥5 cm的结肠癌患者术前血液NLR高于<5 cm的患者,差异有统计学意义(t=3.507,P<0.01)。
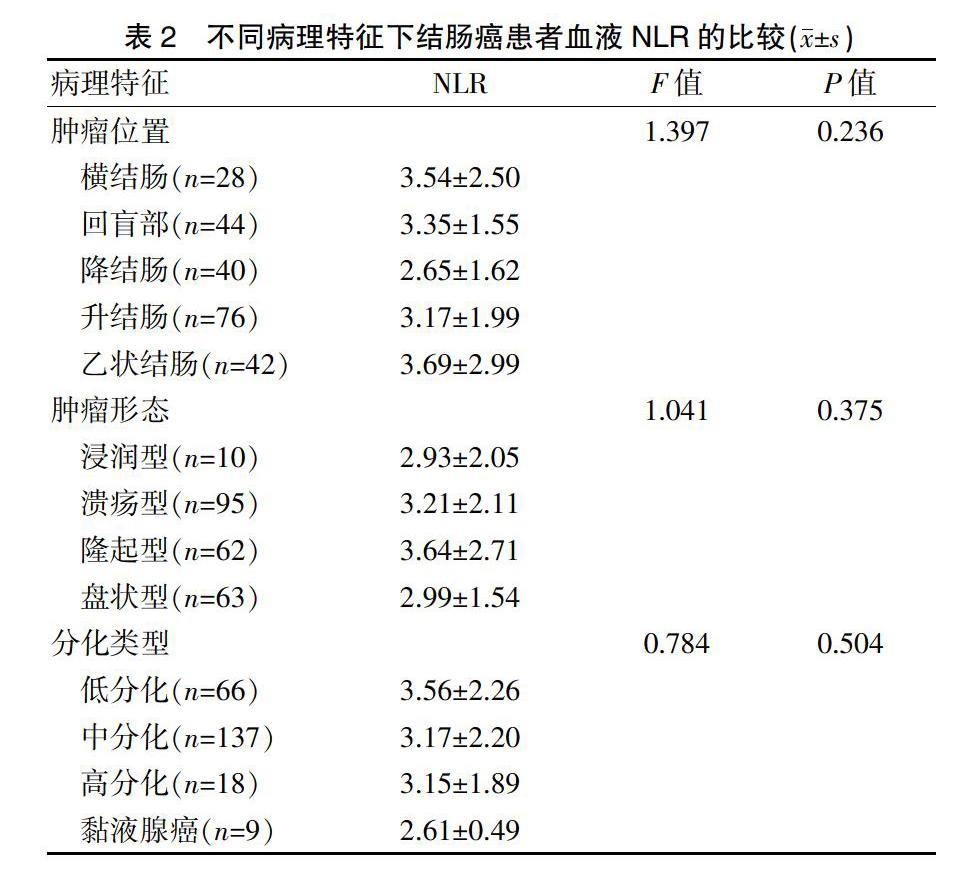
2.4不同病理特征下结肠癌患者血液NLR的比较
不同发生位置结肠癌患者的血液NLR比较,差异无统计学意义(P>0.05);不同形态特征结肠癌患者的血液NLR比较,差异无统计学意义(P>0.05);不同分化类型结肠癌患者的血液NLR比较,差异无统计学意义(P>0.05)(表2)。
3讨论
临床数据表明[11],炎症是一种有效的免疫和修复反应,是恶性肿瘤生长转移必不可少的因素。结肠癌与炎症环境同样密切相关,炎症因子与肿瘤细胞的相互作用促进了癌细胞的增殖与存活,最终产生肿瘤恶性增殖、侵袭和转移等生物学行为[12]。有研究表明[13-14],长期使用非甾体抗炎药(NSAID)可降低结直肠腺瘤和结直肠癌的发病风险,进一步证明了炎症状态对结肠癌的促进作用。中性粒细胞是人体最常见的炎性细胞,来源于骨髓造血干細胞,在骨髓内分化发育后进入血液和组织[15]。中性粒细胞具有很强的趋化作用和吞噬功能。肿瘤细胞可释放肿瘤坏死因子-α(TNF-α)和白介素1(IL-1)等炎症因子,从而激活和招募中性粒细胞[16]。浸润于肿瘤组织并参与肿瘤炎症环境组成的中性粒细胞多为肿瘤相关中性粒细胞(tumor-associated neutrophils,TANs),TANs中的N2型通过以下多个方面促进肿瘤细胞的侵袭和转移[17]:促进肿瘤细胞进入血管并维持其活性;促进肿瘤细胞的定植、生存和生长;促进肿瘤的血管和淋巴管的生成;对肿瘤细胞产生免疫抑制。相关文献报道[18-19],机体抗肿瘤免疫反应具有淋巴细胞依赖性。肿瘤抗原特异性细胞毒性T淋巴细胞(CTL)可以通过释放穿孔素和颗粒酶而直接杀伤靶细胞,在抗肿瘤免疫中起到中心作用。故淋巴细胞水平降低,更有利于癌细胞的逃逸和转移。因此,恶性肿瘤患者血液NLR可反映肿瘤进展所引起的全身炎症状态。
本研究通過比较结肠癌患者与健康对照人群的NLR,结果显示,结肠癌组术前血液NLR高于健康对照组(P<0.01),提示结肠癌患者存在与肿瘤相关的炎症状态。本研究还比较了不同TNM分期的结肠癌患者术前血液NLR,结果显示,不同T、N分期的血液NLR比较,差异无统计学意义(P>0.05);M1分期的血液NLR高于M0分期,差异有统计学意义(P<0.05)。提示术前检测血液NLR对评估结肠癌远处转移或无法切除的腹腔转移有一定价值。肿瘤的转移主要包括直接蔓延、淋巴道转移和血道转移。T分期主要反映肿瘤的直接侵袭情况,N分期反映肿瘤的区域淋巴结转移情况,M分期反映肿瘤远处转移情况。其中,M分期是结肠癌患者是否可行根治性手术的重要指征,也是结肠癌患者预后的决定性因素。
以肿瘤最大直径5 cm为界限进行分组比较术前血液NLR,结果显示,肿瘤最大直径≥5 cm的患者NLR高于<5 cm者(P<0.01),提示瘤体较大的结肠癌所引起的全身炎症反应更为明显,血液NLR对评估肿瘤大小具有参考价值。瘤体大小常反映恶性肿瘤负荷情况,肿瘤负荷越大的个体所引起的全身炎症状态更显著[20-21]。相关文献报道[22-24],肿瘤大小是结肠癌独立的预后因素之一,结肠肿瘤最大直径>5 cm的患者5年生存率明显低于<5 cm的患者。不同发生位置、形态特征、分化类型结肠癌患者的血液NLR比较,差异无统计学意义(P>0.05),提示肿瘤所在部位、形态、分化类型与血液NLR无明显关系。
综上所述,术前检测观察结肠癌患者的NLR可以反映患者所处的炎症状态,并评估结肠癌的M分期和肿瘤大小,对判断结肠癌远处转移情况和肿瘤负荷具有一定价值。NLR的检测方便快速、价廉易行,值得在医疗机构开展并应用。
[参考文献]
[1]Bray F,Ferlay J,Soerjomataram I,et al.Global Cancer Statistics 2018:GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J].CA Cancer J Clin,2018,68(6):394-424.
[2]Pesic M,Greten F R.Inflammation and cancer:tissue regeneration gone awry[J].Curr Opin Cell Biol,2016,43:55-61.
[3]Simon K.Colorectal cancer development and advances in screening[J].Clin Interv Aging,2016,11:967-976.
[4]Wilhelmsen M,Christensen IJ,Rasmussen L,et al.Detection of colorectal neoplasia:Combination of eight blood-based,cancer-associated protein biomarkers[J].Int J Cancer,2017, 140(6):1436-1446.
[5]Wu F,Hou XQ,Sun RR,et al.The predictive value of joint detection of serum amyloid protein A,PCT,and Hs-CRP in the diagnosis and efficacy of neonatal septicemia[J].Eur Rev Med Pharmacol Sci,2019,23(13):5904-5911.
[6]Miyamoto R,Inagawa S,Sano N,et al.The neutrophil-to-lymphocyte ratio (NLR) predicts short-term and long-term outcomes in gastric cancer patients[J].Eur J Surg Oncol,2018,44(5):607-612.
[7]Pan XB,Huang ST,Zhu XD.Neutrophil-to-lymphocyte ratio predicts the prognosis of stage II nasopharyngeal carcinoma[J].Cancer Manag Res,2019,11:8269-8275.
[8]Lochowski M,Lochowska B,Zawadzka I,et al.Prognostic value of neutrophil-to-lymphocyte,platelet-to-lymphocyte and lymphocyte-to-monocyte ratio ratios in patients operated on due to non-small cell lung cancer[J].J Thorac Dis,2019, 11(8):3377-3384.
[9]Townsend MH,Felsted AM,Piccolo SR,et al.Metastatic colon adenocarcinoma has a significantly elevated expression of IL-10 compared with primary colon adenocarcinoma tumors[J].Cancer Biol Ther,2018,19(10):913-920.
[10]Amin MB,Greene FL,Edge S,et al.AJCC cancer staging manual[M].8th ed.New York:Springer,2017:268-269.
[11]Qian BZ.Inflammation fires up cancer metastasis[J].Semin Cancer Biol,2017,47:170-176.
[12]魏智民,孙玉发,李刚,等.癌症相关性炎症与肿瘤微环境相关研究进展[J].中国肿瘤临床,2018,45(21):1117-1121.
[13]Ghanghas P,Jain S,Rana C,et al.Chemopreventive action of non-steroidal anti-inflammatory drugs on the inflammatory pathways in colon cancer[J].Biomed Pharmacother,2016,78:239-247.
[14]Shaw E,Warkentin MT,McGregor SE,et al.Intake of dietary fibre and lifetime non-steroidal anti-inflammatory drug (NSAID) use and the incidence of colorectal polyps in a population screened for colorectal cancer[J].J Epidemiol Community Health,2017,71(10):961-969.
[15]Kim J,Bae JS.Tumor-Associated Macrophages and Neutrophils in Tumor Microenvironment[J].Mediators Inflamm,2016,2016:6 058 147.
[16]SenGupta S,Subramanian BC,Parent CA.Getting TANned:How the tumor microenvironment drives neutrophil recruitment[J].J Leukoc Biol,2019,105(3):449-462.
[17]李佳庆,王清莹,程忠.瘤相关性中性粒细胞促肿瘤转移机制的研究进展[J].中国肿瘤临床,2019,46(10):524-527.
[18]江慧洪,王晖,李阿建,等.中性粒细胞/淋巴细胞比值对局部进展期结直肠癌患者预后的影响[J].中华胃肠外科杂志,2017,20(5):550-554.
[19]梁铭,张辉,陈福雄,等.肿瘤浸润性淋巴细胞在血液腫瘤中作用的临床研究进展[J].中国实验血液学杂志,2016, 24(4):1241-1247.
[20]沈金闻,刘鲁迎,李德川,等.术前系统性炎症反应与结直肠癌临床病理特征的相关性探讨[J].中国现代医学杂志,2016,26(21):87-93.
[21]Huang B,Feng Y,Mo SB,et al.Smaller tumor size is associated with poor survival in T4b colon cancer[J].World J Gastroenterol,2016,22(29):6726-6735.
[22]童国俊,严强,张贵阳,等.肿瘤大小分类对0~Ⅲ期结直肠癌预后的影响[J].浙江医学,2017,39(19):1664-1666, 1734.
[23]王淑强,钟文洲.结直肠癌患者住院费用构成分布及其影响因素分析[J].中国医药导报,2019,16(23):118-121.
[24]肖英著.胃肠肿瘤标志物诊断大肠癌的临床效果与价值分析[J].现代消化及介入诊疗,2018,23(A2):59-60.
(收稿日期:2019-12-10)

