整合素α5对宫颈癌转移及预后的作用*
杨晓新, 王泽华, 蔡 娥△
1武汉大学附属同仁医院(武汉市第三医院)妇产科,武汉 430060 2华中科技大学同济医学院附属协和医院妇产科,武汉 430022
宫颈癌是全球女性第4常见的恶性肿瘤,2018年新发病例约57万例,死亡人数高达31.1万例,并且80%发生在发展中国家[1]。尽管宫颈癌筛查及HPV疫苗的普及一定程度上降低了宫颈癌的发病率,但仍有一部分患者发现时已处于宫颈癌的中晚期,治疗效果及预后较差。宫颈癌局部浸润是导致患者临床分期靠后的主要原因,因此探究宫颈癌浸润转移的机制十分必要。
上皮间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞失去细胞极性和细胞间粘附能力,获得迁移及侵袭等间质细胞特性的过程,该过程伴随着上皮细胞表型如E-钙粘蛋白(E-cadherin)的表达下降以及间质细胞表型如波形蛋白(Vimentin)、N-钙粘蛋白(N-cadherin)等分子的表达上升。已有证据表明宫颈癌细胞发生EMT与浸润转移密切相关[2],然而调控宫颈癌浸润转移及EMT的关键分子仍待进一步研究。整合素是一类异二聚体跨膜粘附分子,由18种α亚基和8种β亚基可以组合出24种亚型,在人体内表达于多种细胞表面,可以介导细胞与细胞、细胞与基质的相互作用[3-4]。近年来研究发现整合素α5参与调控肿瘤的发生发展过程。例如,在乳腺癌、结直肠癌及卵巢癌等肿瘤细胞中,整合素α5均高表达,并且与患者的不良预后相关,体外实验进一步证实其能够调节肿瘤细胞增殖、凋亡、迁移、侵袭及耐药等多种恶性生物学行为[5-7]。Wang等[8]的研究显示宫颈癌组织中整合素α5β1表达水平明显高于正常宫颈组织,然而整合素α5的具体作用尚不清楚。因此,本研究旨在进一步探究整合素α5对宫颈癌的预后意义以及对宫颈癌细胞SiHa迁移、侵袭及EMT的影响。
1 材料与方法
1.1 实验材料
人宫颈癌细胞系SiHa购于中国科学院典型培养物保藏委员会细胞库。RPMI-1640培养液、四季青胎牛血清、胰蛋白酶、青霉素链霉素溶液及LB培养液均购自上海源培有限公司;Lipofectamine 2000购自Invitrogen公司;人整合素α5质粒、NC质粒及菌液均购自上海吉玛有限公司。高纯度质粒小提试剂盒购自天根生化科技有限公司。Transwell小室和基质胶购自美国Corning公司;整合素α5、E-cadherin、Vimentin、N-cadherin、GAPDH一抗均购自英国Abcam公司,二抗及DAPI均购自美国KPL公司。Trizol、反转录试剂盒、qRT-PCR试剂盒均购自日本TaKaRa公司。NP40裂解液、Cocktail、ECL超敏检测试剂、SDS-PAGE配制试剂盒、蛋白上样缓冲液、电泳液及转膜液均购自上海碧云天生物技术有限公司。
1.2 实验方法
1.2.1 分析整合素α5对宫颈癌患者预后的影响 利用在线工具Kaplan-Meier Plotter(KM-plotter,https://kmplot.com/analysis/[9])分析整合素α5 mRNA表达水平与宫颈癌患者总生存期(overall survival,OS)的相关性。筛选的条件设定为:①mRNA RNA-seq:Start KM plotter for pan-cancer;②Gene symbol:ITGA5,RNA-Seq ID;③Split patients by:Auto select best cutoff;④Survival:OS;⑤Follow up threshold:all;⑥Select all:Cervical squamous cell carcinoma(n=304);其余选择默认设置。
1.2.2 细胞培养 将SiHa细胞接种于RPMI-1640培养液中(含10%胎牛血清、100 U/mL青霉素和链霉素),放置37℃和5%CO2培养箱中培养,待细胞融合度达80%左右即可传代处理。
1.2.3 质粒提取 取10 μL菌液加入含20 mL LB培养液的无菌离心管中,加入20 μL 100 mg/mL氨苄青霉素溶液(所购整合素α5和NC质粒均含氨苄青霉素抗性基因),37℃,220 r/min振荡培养12~16 h。按质粒提取试剂盒说明书进行操作。利用NanoDrop 2000测量质粒溶液浓度,直接进行转染操作或-20℃保存。
1.2.4 细胞转染 SiHa细胞转染分为2组:plasmid NC组,plasmid α5组,分别转染对照质粒和过表达整合素α5质粒。取对数生长期细胞,胰蛋白酶消化成单个细胞,进行细胞计数,取2×105个细胞接种于6孔板中,待细胞贴壁并生长至70%左右密度进行转染,具体转染操作参照Lipofectamine 2000说明书。转染48 h后收集细胞用于检测转染效率及进行后续实验。
1.2.5 Transwell迁移侵袭实验 侵袭实验:在冰上按无血清RPMI培养液∶基质胶=30∶1的比例配制所需基质胶,吸取100 μL轻柔加入Transwell小室上层,37℃培养箱孵育1 h后取出小室,吸弃上室多余液体,加入2×105的SiHa细胞悬液,下室加入600 μL含10%胎牛血清的RPMI培养液。细胞37℃培养箱孵育36 h。取出小室,棉签擦去上室表面细胞,4%多聚甲醛室温固定30 min,0.1%结晶紫溶液染色2 h,PBS冲洗3次,显微镜下拍照并计数。迁移实验:不需要加入基质胶稀释液,其余步骤同侵袭实验。
1.2.6 Western blot实验 收集转染后的细胞,加入含1% Cocktail的NP40裂解液提取细胞总蛋白,BCA法检测蛋白浓度。取20 μg蛋白进行SDS-PAGE凝胶电泳,4℃转膜1.5 h,5%脱脂牛奶室温封闭1 h。分别加入稀释后的整合素α5(1∶2000)、E-cadherin(1∶1000)、N-cadherin(1∶200)、Vimentin(1∶400)、GAPDH(1∶5000)一抗,4℃孵育过夜,TBST漂洗3次,加入二抗(1∶5000),室温孵育1.5 h,TBST漂洗3次,采用ECL法发光显影。
1.2.7 qRT-PCR检测 收集转染后的细胞,采用Trizol法提取细胞总RNA,NanoDrop 2000测定RNA浓度,按照逆转录试剂盒操作合成cDNA。Amplification机器进行DNA扩增,条件如下:酶活化95℃ 30 s,变性95℃ 5 s,退火及延伸60℃ 30 s。反应完成后得到各孔Ct值,采用2-ΔΔCt法计算目的基因mRNA表达水平。
1.2.8 免疫荧光检测 将转染后的细胞用胰酶消化成单个细胞,细胞计数仪计数,取1.5×104的细胞接种于24孔板,于培养箱继续培养。待细胞贴壁后吸去培养液,每孔加入4%多聚甲醛300 μL,室温固定30 min,PBS漂洗2次,加入0.5%Triton X-100破膜液300 μL,室温静置10 min,吸弃破膜液,加入0.5%BSA封闭液300 μL处理1 h。吸弃封闭液,分别加入一抗E-cadherin(1∶200),Vimentin(1∶400),N-cadherin(1∶200),4℃孵育过夜。次日弃一抗,加入PBS放置摇床上漂洗3次,每次5 min。然后E-cadherin组加入绿色荧光二抗(1∶200),Vimentin、N-cadherin组加入红色荧光二抗(1∶200),室温孵育1 h,随后PBS摇床上避光漂洗3次,每次5 min。随后每孔加入核染色剂DAPI(1∶5000),孵育5 min,PBS漂洗3次。随后荧光倒置显微镜下观察并拍照。
1.3 统计学分析

2 结果
2.1 整合素α5表达与宫颈癌患者预后的关系
KM-plotter生存分析结果发现,宫颈癌中整合素α5 mRNA表达水平与患者总生存期(OS)呈负相关,即整合素α5表达越高,患者总生存时间越短(HR=2.86,95%CI=1.79~4.57,P<0.01)。见图1。
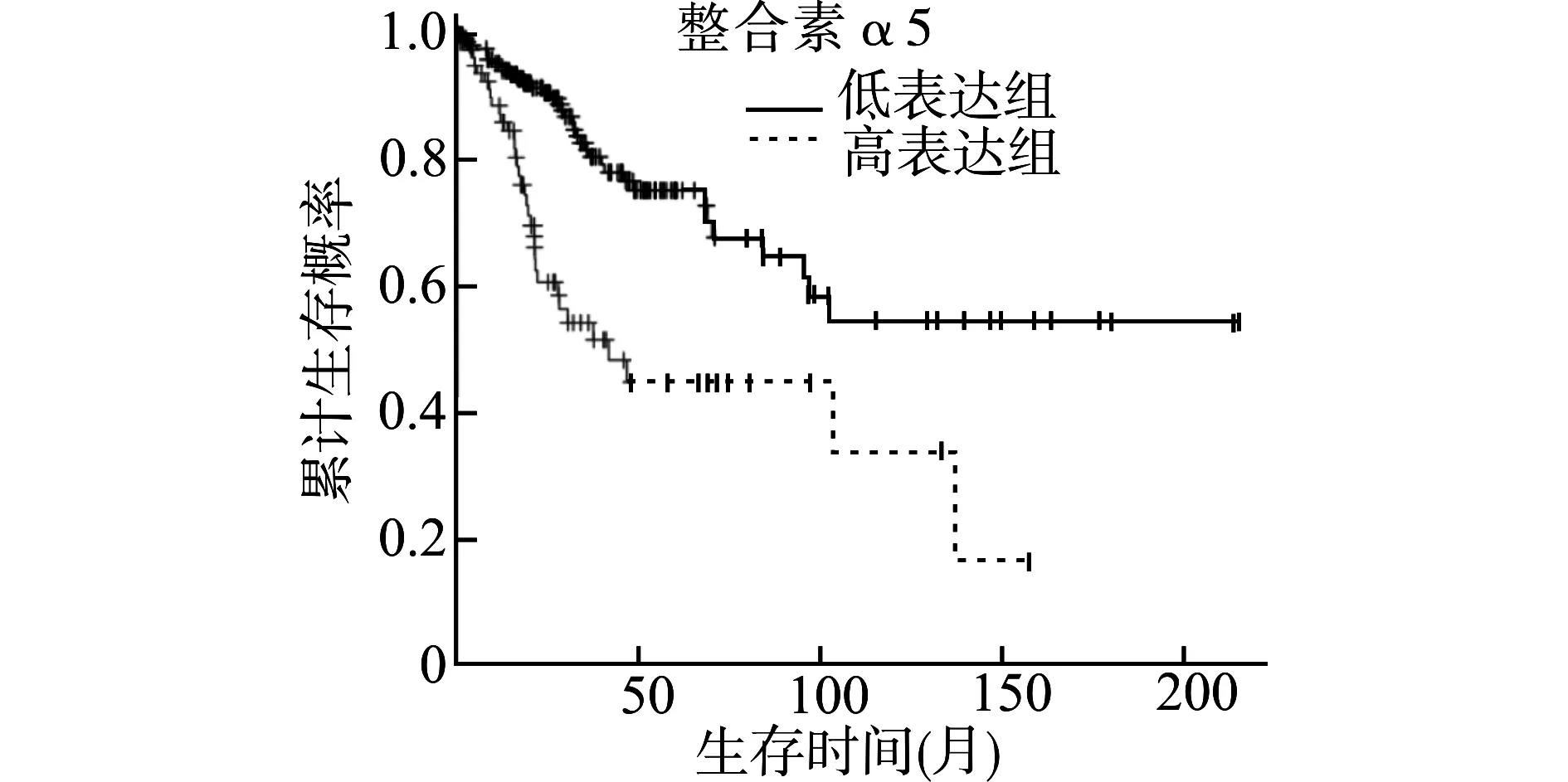
图1 宫颈癌中整合素α5表达与患者预后的相关性Fig.1 Correlation between the expression of integrin α5 and prognosis of patients with cervical cancer
2.2 整合素α5质粒成功上调SiHa细胞中α5表达水平
为了检测整合素α5过表达质粒的调控效率,我们采用qRT-PCR和Western blot检测发现,相较于NC质粒组,转染了α5过表达质粒的SiHa细胞其整合素α5在mRNA水平上调了17330.3倍,P<0.05,差异具有统计学意义(图2A)。Western blot显示转染α5质粒组较NC组整合素α5蛋白表达明显增多(图2B)。
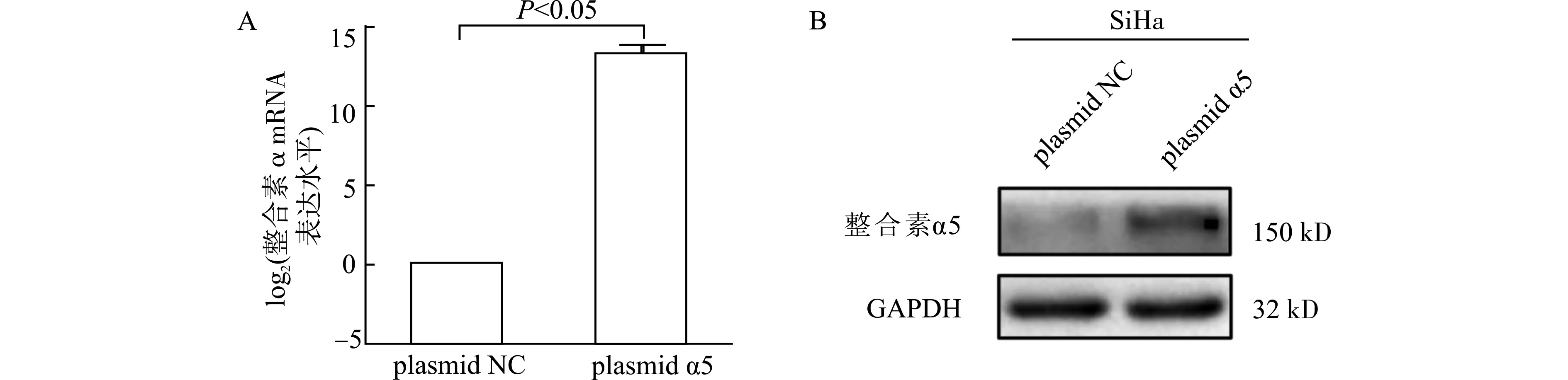
图2 qRT-PCR(A)和Western blot(B)验证SiHa细胞中整合素α5上调Fig.2 Detection of the upregulation of integrin α5 expression in SiHa cells by qRT-PCR(A)and Western blot(B)
2.3 上调整合素α5增强宫颈癌SiHa细胞迁移和侵袭能力
为了确定整合素α5对宫颈癌SiHa细胞迁移和侵袭的影响,我们采用Transwell实验检测细胞迁移和侵袭能力变化。迁移实验结果显示,转染NC质粒的对照组中,穿膜细胞个数为(36.0±5.0),α5质粒上调组穿膜细胞个数为(69.3±5.7),差异有统计学意义(P<0.05);侵袭实验结果显示,NC组穿膜细胞个数为(22.3±2.1),α5质粒上调组穿膜细胞个数为(38.7±2.1),差异具有统计学意义(P<0.05)。说明上调SiHa细胞中整合素α5可以增强细胞迁移和侵袭能力(图3)。
2.4 上调整合素α5促进宫颈癌细胞SiHa发生EMT
为了进一步探究整合素α5对宫颈癌细胞SiHa上皮间质转化过程的影响,我们采用Western blot和免疫荧光技术检测整合素α5上调组及NC组中EMT相关分子E-cadherin、Vimentin、N-cadherin的表达变化。结果显示(图4):在SiHa细胞中上调整合素α5后,E-cadherin表达下降,荧光强度减弱,而Vimentin、N-cadherin表达增加,荧光强度增强,说明整合素α5促进SiHa细胞发生上皮间质转化。
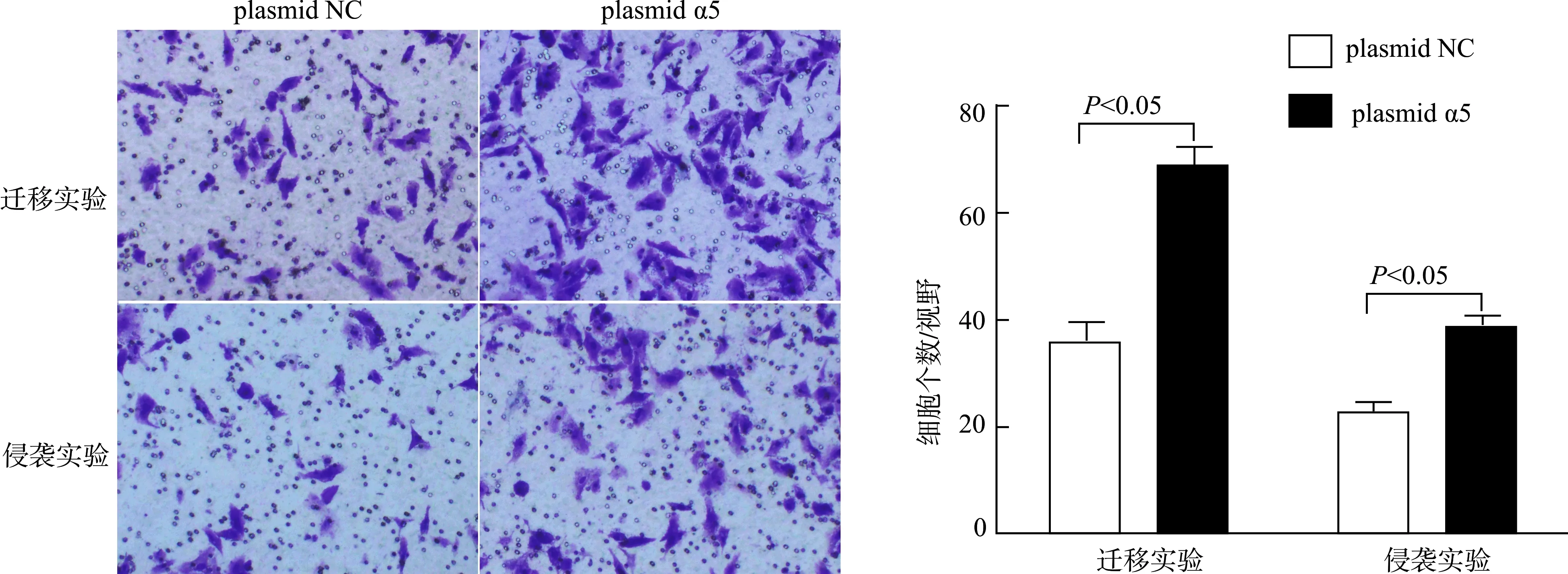
图3 整合素α5对宫颈癌细胞SiHa迁移和侵袭能力的影响Fig.3 Effect of integrin α5 on migration and invasion of cervical cancer cells SiHa

A:Western blot检测E-cadherin、Vimentin及N-cadherin蛋白表达水平变化;B:免疫荧光检测E-cadherin、Vimentin及N-cadherin蛋白表达水平变化,标尺=50μm。图4 整合素α5对EMT相关分子的影响Fig.4 Effect of integrin α5 on EMT-related proteins
3 讨论
宫颈癌是我国最常见的妇科恶性肿瘤,发生转移的晚期患者5年生存率明显下降。肿瘤细胞迁移、侵袭能力增强是导致肿瘤转移的关键[10],本研究利用在线数据库KM-plotter进行预后分析,结果显示宫颈癌患者整合素α5高表达与不良预后相关,并且首次探究了整合素α5对宫颈癌细胞SiHa迁移侵袭的作用,发现整合素α5可以促进SiHa细胞的迁移侵袭能力及上皮间质转化(EMT)。
整合素α5作为细胞粘附分子中的一员,在多种肿瘤中发挥促癌基因的功能。在乳腺癌中,整合素α5通过ITGA5/Src/Vav2/Rac1通路促进肿瘤细胞生长及转移[5];在结肠癌中,下调整合素α5可减缓肿瘤生长,促进肿瘤凋亡[6]。在本研究中,我们首先通过数据库大样本分析304例宫颈癌患者组织中整合素α5表达水平与预后的相关性,发现整合素α5高表达的患者总生存时间明显短于低表达患者,这与之前Wang等[8]研究报道相一致。随后,通过体外质粒转染上调宫颈癌细胞SiHa中整合素α5的表达,并采用Transwell实验检测细胞迁移、侵袭能力,发现SiHa细胞整合素α5表达增加后,细胞迁移、侵袭明显增强。这一结果提示整合素α5在宫颈癌的进展尤其是转移过程中发挥重要促进作用。
EMT被认为是肿瘤转移的起始步骤,它使肿瘤细胞运动及侵袭能力增强,从而促进肿瘤脱离原发病灶,向远处播散[11]。有研究提示在乳腺癌中,整合素α5可以通过使Rac1b定位于细胞膜从而促进肿瘤细胞发生EMT[12]。通过Western blot及细胞免疫荧光技术,我们发现在SiHa细胞中上调整合素α5表达可以使E-cadherin表达下降,Vimentin、N-cadherin表达上升,提示整合素α5促进SiHa细胞的EMT过程。这与上述整合素α5促进SiHa细胞迁移、侵袭能力的结果相符合。提示整合素α5可能通过影响肿瘤细胞EMT过程从而影响细胞迁移、侵袭能力,具体机制仍待进一步研究。
综上所述,本研究首次通过生物信息学方法分析了临床大样本数据库资料,发现了整合素α5在宫颈癌中的预后意义,提示其作为宫颈癌预后生物标记物的潜在意义。并且在体外水平揭示了整合素α5对宫颈癌细胞SiHa迁移、侵袭能力及EMT的促进作用,为研究整合素α5在宫颈癌转移中作用提供了一定的理论基础,也为晚期宫颈癌的治疗提供了新思路。

