峨眉岩白菜总三萜纯化及活性分析
罗思源,曾 辰,冯士令,陈 涛,周莉君,丁春邦
(四川农业大学生命科学学院,四川 雅安,625000)
峨眉岩白菜(BergeniaemeiensisC. Y. Wu)隶属于虎耳草科(Saxifragaceae)岩白菜属(Bergenia),为我国特有多年生草本植物,分布于四川西南地区[1-2].岩白菜属植物中主要的活性成分为岩白菜素,是治疗慢性支气管炎、支气管哮喘等呼吸系统疾病的特效药物[3].但目前大多研究主要集中在岩白菜素的提取、修饰及其活性,忽略了其他活性成分的相关研究[4-5].有研究指出岩白菜中还含有三萜、黄酮、多糖等活性成分[6-7].陈蕉等发现峨眉岩白菜多糖和黄酮提取物均具有一定的抗氧化活性[6],但关于三萜化合物的提取和活性研究报道较少.
从植物中提取出的三萜化合物已被证实具有抑菌、抗癌、保肝、降糖等多种活性[8-11],但不同植物中三萜的含量不同.马比木根中总三萜含量为145 mg·g-1(干重),茎中总三萜含量为225.17 mg·g-1[12](干重);女贞叶中总三萜含量仅为5.11 mg·g-1[13](干重).目前研究仅对岩白菜中三萜化合物进行了定性分析,并没有进行定量分析[7].三萜纯化是三萜类化合物分离、鉴定和应用的一个重要步骤.樊梓鸾等用大孔树脂纯化红豆越橘总三萜,其纯度由原来的5.13%提高到29.46%[14];Luo等采用吸附色谱的方法从灵芝中分离纯化得到不同三萜单体[15].但关于峨眉岩白菜总三萜的纯化研究较少.
峨眉岩白菜目前属于野生资源,还没有被充分开发利用.因此本实验以我国特有物种峨眉岩白菜为研究对象,对其根中的总三萜进行分离纯化,并比较纯化前后体外抗氧化、抑菌和抑癌活性,为峨眉岩白菜的进一步开发利用提供理论和技术支撑.
1材料与方法
1.1材料与仪器
1.1.1实验材料 供试材料采自四川峨眉山海拔1 300~1 500 m地区,由四川农业大学胡超副教授鉴定为峨眉岩白菜(BergeniaemeiensisC. Y. Wu).将根用超纯水清洗3遍,50 ℃恒温烘干至恒重,粉碎过60目筛,干粉-20℃储存备用.
1.1.2仪器与试剂 Scientz-10N台式冷冻干燥机(宁波新芝生物科技股份有限公司);BT-124S电子天平(德国Sartorius公司);RM-220实验室超纯水机(四川沃特尔科技发展有限公司);DNP-9082电热恒温培养箱(上海三发科学仪器有限公司);RE-2000B旋转蒸发器(上海亚荣生化仪器);AIR TECH超净工作台(苏净集团安康公司制造);Spectra Max M2酶标仪(美国Molecular Devices公司).
2,2-二苯基-1-苦味基肼(DPPH)购自美国Sigma公司;熊果酸标准品、抗坏血酸(Vc)、乙醇、冰乙酸、高氯酸、氢氧化钠、氯化钠、氯化铁、盐酸、三氯乙酸、铁氰化钾、香草醛、二甲亚砜购自成都科龙化工试剂厂;氨苄青霉素钠和琼脂粉购自北京索莱宝公司;酵母提取物和胰蛋白胨购自英国OXOID公司;DMEM高糖培养基、RPMI1640培养基、消化酶、青霉素-链霉素(双抗)和PBS购自Hyclone公司;CCK-8试剂购自武汉博士德生物公司;FBS购自杭州四季青生物有限公司.
1.2实验方法
1.2.1三萜提取 3 L 80 %乙醇与100 g岩白菜根粉末充分混匀,45 ℃下210 W超声提取40 min.将提取液抽滤所得滤液蒸发浓缩,冷冻干燥4 d得粉末状提取物.
1.2.2总三萜含量测定 采用香草醛-高氯酸法测定总三萜含量[16].取50 μL样液加入100 μL 5%香草醛-冰乙酸溶液(m/V)和200 μL高氯酸,60 ℃水浴15 min后加入冰乙酸定容至1 mL,混匀静置5 min,于550 nm处测定吸光值.标准曲线采用熊果酸标准品制作,将样品吸光值带入标准曲线计算总三萜含量.
1.2.3沉淀分级溶解法纯化 第一次提取液冷冻干燥4 d得粉末状提取物为第一次冻干提取物.取冻干后的提取物用500 mL无水乙醇50 ℃超声溶解,抽滤3次,滤液蒸发浓缩后冷冻干燥4天得第二次冻干提取物,称量并测定提取物中总三萜含量.重复以上步骤3次,分别得到第1次、第2次、第3次、第4次冻干提取物.
1.2.4体外抗氧化活性测定
1) DPPH清除能力测定.将第一次和第四次冻干提取物用80 %乙醇溶解成相应浓度.根据Marsden的方法测定DPPH自由基清除能力[17].30 μL样液与170 μL DPPH乙醇溶液(0.8 mM)混匀,黑暗处放置15 min.于517 nm处测定吸光值.DPPH自由基清除率根据以下公式计算:

其中,A1为样品处理组吸光值,A0为乙醇代替样品空白组吸光值.
2) 总还原能力测定.将第1次和第4次冻干提取物用80%乙醇溶解成相应浓度.根据Liyana等的方法测定总还原能力[18].0.5 mL样液与0.5 mL 1%铁氰化钾溶液(m/V)和0.5 mL PBS(0.2 mol·L-1)混匀,50 ℃水浴20 min,加入0.5 mL 10 %三氯乙酸溶液(m/V),冷却5 min.取上清液0.5 mL加入0.1 mL 0.1 %三氯化铁溶液(m/V)和0.5 mL蒸馏水,混匀后在700 nm处测定吸光值.吸光值越大表示总还原能力越强.
1.2.5抑菌活性测定
1) 菌种准备.枯草芽孢杆菌和铜绿假单胞杆菌由四川农业大学生命科学学院植物学系保种.取菌种加入LB液体培养基,37 ℃下200 r·min-1摇菌24 h.接种环蘸取菌悬液在LB固体培养基上划线.放于37 ℃培养箱中培养24 h后,挑取单菌落于LB液体培养基中,37 ℃下200 r·min-1摇菌24 h获得活化菌悬液.
2) 抑菌圈测定.采用牛津杯法测定抑菌圈[19].将第一次和第四次冻干提取物用DMSO溶解成相应浓度,DMSO最终含量低于0.05%.根据麦氏比浊法测定活化菌悬液菌浓度,并调整为1×107CFU·mL-1.取0.5 mL菌液均匀铺满培养基表面,待液体吹干后放置灭菌过的牛津杯,在牛津杯中加入200 μL不同浓度的药物.100 μg·mL-1氨苄青霉素钠作为阳性对照,0.05% DMSO溶液作为空白对照.将培养基放于37 ℃培养箱中培养24 h测定抑菌圈大小.
1.2.6抑癌活性测定 Hela和A549细胞由四川农业大学生命科学学院生物工程系惠赠.Hela细胞用DMEM高糖培养基培养(含10%FBS和0.1%双抗),A549细胞用RPMI1640培养基培养(含10%FBS和0.1%双抗)在含5%二氧化碳37℃恒温培养箱中培养,每隔2~3 d传代一次.待细胞处于对数生长期时,消化细胞并用PBS缓冲液冲洗两次,用DMEM培养基调整细胞浓度为1×105个·mL-1,取90 μL细胞悬浮液到96孔板中,边缘用100 μL PBS填充.培养12 h后加入10 μL不同浓度的药物.培养24和48 h后用100 μL新鲜培养基代替旧培养基,并加入10 μLCCK-8培养30 min,在450 nm处测定吸光值.细胞抑制率根据以下公式计算:

其中,A1为加入药物组的吸光值,A0为空白组的吸光值.
1.3数据处理
实验均独立重复3次,结果以平均值±相对误差(mean±SD)表示.采用Graphpad Prism 6.0软件进行作图和数据统计分析.p<0.05认为具有统计学意义.
2结果与分析
2.1沉淀分级溶解法提高三萜纯度
从图1中可以看出提取物中总三萜含量较高,说明峨眉岩白菜中富含三萜类化合物.从表1中可以看出,第1次冻干的样品提取率为38.13%,提取物中总三萜含量为48.58%(图1).经4次冻干后,样品提取率有所下降,为26.79%,而提取物中总三萜含量显著提高,为70.99%.说明在沉淀分级溶解过程中,提取率下降表示不溶于醇的杂质被过滤掉,显著提高峨眉岩白菜提取物中总三萜含量.冻干3次和4次的样品提取率无显著差异,提取物中总三萜含量也无显著变化.因此,可以用沉淀分级溶解的方法对峨眉岩白菜总三萜进行纯化.
2.2纯化前后体外抗氧化活性比较
从图2A中可以看出纯化前即第1次冻干总三萜提取物对DPPH自由基最大清除率为90.91%,IC50为0.32 mg·mL-1.纯化后即第4次冻干总三萜提取物对DPPH自由基的最大清除率为94.45%,IC50为0.27 mg·mL-1.IC50越小代表抗氧化能力越强,纯化后,能降低总三萜提取物对DPPH自由基的IC50,由此可见经纯化后峨眉岩白菜总三萜对DPPH自由基的清除率显著提高.从图2(b)中可以看出,在0.2到1.0 mg·mL-1之间,纯化后总三萜的总还原能力高于纯化前.蔡天娇等人发现红枣三萜酸经纯化后,对ABTS自由基清除能力增强,IC50由1.18 mg·mL-1变为0.73 mg·mL-1[21].本实验中经纯化后,峨眉岩白菜总三萜的体外抗氧化能力提高,说明有效成分经沉淀分级溶解纯化后达到了富集的效果.

图1 多次冻干后总三萜含量变化Fig.1 The content of triterpenes in extract after repeatedly freeze-dried times

表1 不同次数冻干后样品提取率
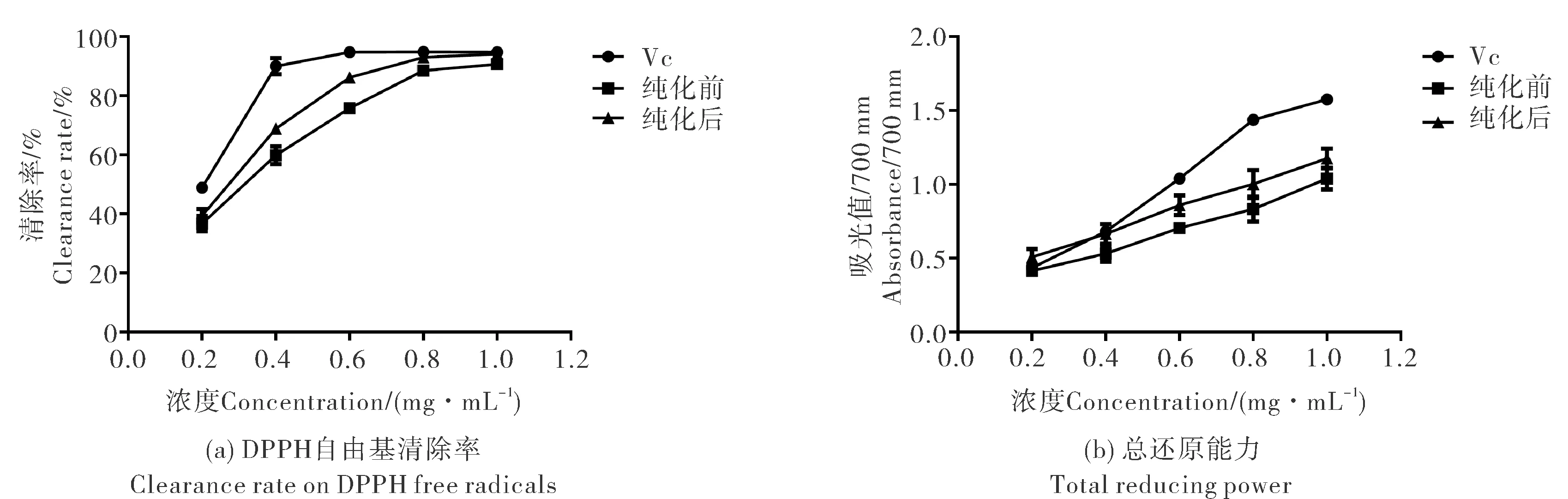
图2 纯化前后体外抗氧化活性比较Fig.2 The comparison of antioxidant abilities before and after purification
2.3纯化前后抑菌活性比较
植物三萜提取物被证实具有一定的抑菌能力,例如金银花总三萜对7种常见致病菌均有较强的抑制能力,而关于峨眉岩白菜总三萜抑菌活性研究报道较少[7].从表2中可以看出纯化前后的峨眉岩白菜总三萜化合物对枯草芽孢杆菌和铜绿假单胞杆菌均有一定的抑制能力(抑菌圈均大于8 mm).抑菌圈为10~14 mm时,表明药物对致病菌为轻度敏感;抑菌圈为15~20 mm时,药物对致病菌为中度敏感.纯化前峨眉岩白菜总三萜在4~8 mg·mL-1浓度下对两种菌均具有轻度敏感(抑菌圈均在10~14 mm内).纯化后在4 mg·mL-1浓度下峨眉岩白菜总三萜对两种菌为轻度敏感,8 mg·mL-1浓度下对两种菌为中度敏感(抑菌圈均在15~20 mm内).说明经纯化后,峨眉岩白菜总三萜的抑菌活性得到提高.
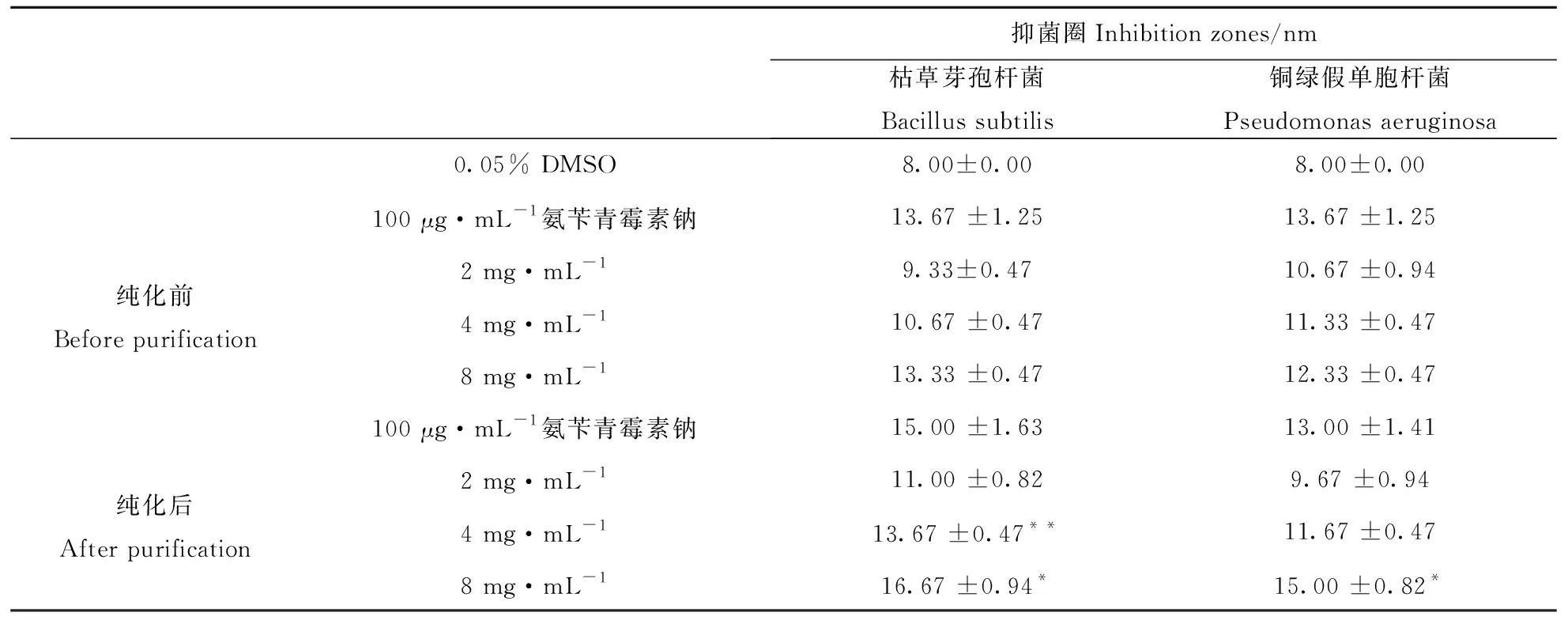
表2 纯化前后抑菌活性比较Tab.2 The comparison of antimicrobial abilities before and after purification
2.4纯化前后对Hela细胞的抑制能力比较
多种植物三萜提取物表现出较强的抑癌活性.灵芝三萜和金丝小枣三萜对前列腺癌细胞均具有较好的抑制能力[22-23].刘素君等人发现峨眉岩白菜提取物对A549肺癌细胞和小鼠腹水瘤细胞有较好的抑制能力[24].从图3(a)中可以看出,纯化前峨眉岩白菜三萜提取物对Hela细胞具有较好的抑制能力,24 h和48 h的IC50分别为102.5和69.00 μg·mL-1.从图3(b)中可以看出纯化后三萜提取物对Hela细胞的抑制能力显著提高,24 h和48 h的IC50分别为59.01和28.56 μg·mL-1.说明经过重结晶纯化后,能显著提高峨眉岩白菜总三萜对Hela细胞的抑制能力.

图3 纯化前后抑癌活性比较Fig.3 The comparison of anticancer ability before and after purification
2.5纯化前后对A549细胞的抑制能力比较
从图4中可以看出峨眉岩白菜三萜提取物对A549肺癌细胞具有一定的抑制能力.未纯化前随着三萜提取物浓度升高,抑制率也逐渐上升,48 h最高抑制率达到55.80 %,24和48 h的IC50分别为238.90 μg·mL-1和172.00 μg·mL-1(图4(a)).从图4(b)中可以看出,纯化后的三萜提取物对A549肺癌细胞的抑制能力提高,当浓度高于200 μg·mL-1时,抑制率趋于平稳,48 h最高抑制率为66.21 μg·mL-1,24和48 h的IC50分别为84.32 μg·mL-1和65.99 μg·mL-1.经纯化后,能显著降低对A549的IC50,说明经过重结晶纯化后,能显著提高峨眉岩白菜总三萜对A549细胞的抑制能力.本实验发现峨眉岩白菜总三萜具有较强的抑癌活性,因此表明峨眉岩白菜提取物中抑癌活性成分可能为总三萜.
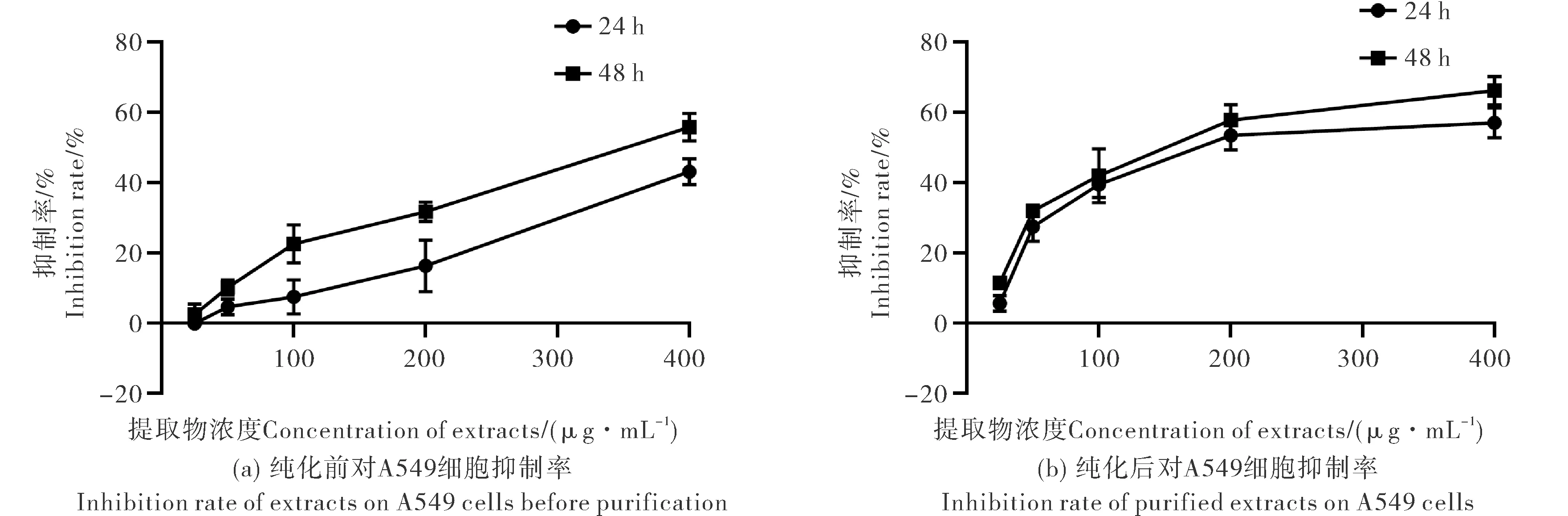
图4 纯化前后抑癌活性比较Fig.4 The comparison of anticancer ability before and after purification
3结论
峨眉岩白菜中含有较丰富的总三萜.经沉底分级溶解纯化后,样品提取率从38.13%降低到26.79%,提取物中总三萜含量从48.58%升高到70.99%,说明沉底分级溶解法能有效提高峨眉岩白菜中总三萜含量.经纯化后,峨眉岩白菜总三萜的总还原能力增强,对DPPH自由基的IC50由0.32 mg·mL-1降低到0.27 mg·mL-1.抑菌结果表明峨眉岩白菜总三萜对铜绿假单胞杆菌和枯草芽孢杆菌均有一定的抑制能力,在4~8 mg·mL-1浓度下,对两种菌为轻度敏感.经纯化后,在8 mg·mL-1浓度下对两种菌为中度敏感.并且总三萜提取物能有效抑制Hela细胞增殖,纯化前处理24 h和48 h后的IC50分别为102.5 μg·mL-1和69.00 μg·mL-1.纯化后IC50降小为59.01 μg·mL-1和28.56 μg·mL-1.对A549肺癌细胞有一定的抑制能力,纯化后能显著降低IC50为84.32 μg·mL-1和65.99 μg·mL-1.说明经纯化后,能提高峨眉岩白菜总三萜的抑癌活性.因此沉淀分级溶解法可适用于峨眉岩白菜总三萜的纯化,纯化后的总三萜 体外抗氧化、抑菌活性和抑癌活性均有一定程度的提高.

