离子半径比规则对离子晶体结构影响的探讨
石 萌
(安徽省师范大学附属中学 241000)
由于正负离子半径大小不同,故离子化合物的结构可以归结为不等径圆球密堆积的几何问题.具体处理时一般可以按负离子(大球)先进行密堆积,正离子(小球)填充空隙的过程来分析讨论离子化合物的堆积结构问题.下面将对离子晶体的几种典型结构型式进行探讨.
一、正三角形空隙
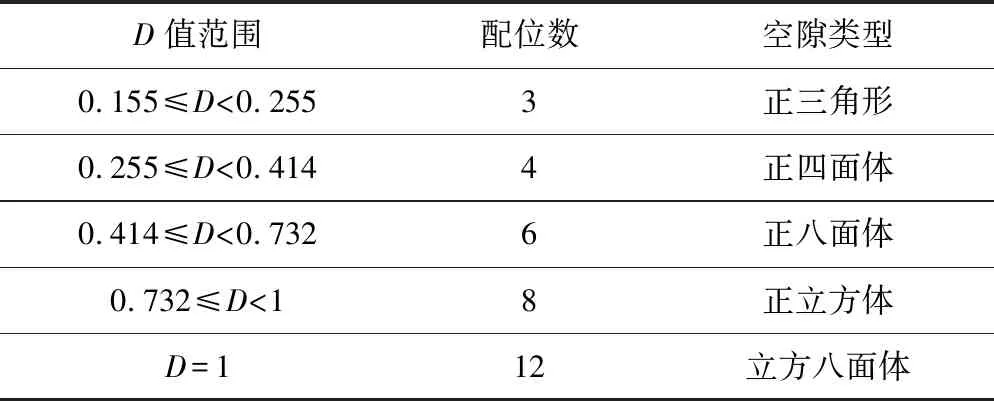
首先,将3个半径较大的球相切堆积,3个球中心位置有个空隙,然后将1个半径较小球放入空隙,使得小球刚好和3个打球相切,此时大小球半径之间存在1个几何关系,如图1所示.

假设D=r+/r-,当D=0,155时,小球在此空隙中既不滚动也不撑开;当D<0.155时,此时3个大球带负电斥力太大,小球阳离子无法将3个球吸引到一起,故不稳定;当D>0.155时,小球阳离子会将3个大球阴离子撑开,斥力变小,当D大到一定程度,4个球即阴阳离子便会稳定形成.这种情况阳离子所填充的是正三角形空隙,阳离子的配位数为3.但当D值大于正四面体空隙的最小值时,离子晶体的结构类型将会发生变化,配位数相应的也会增加.
二、正四面体空隙
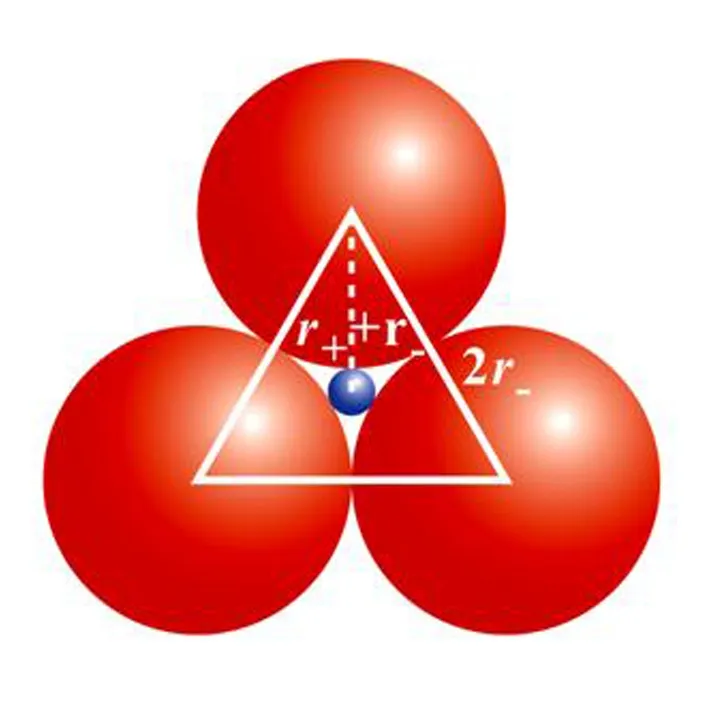
将4个等径大小的球堆积成正四面体结构,中心位置出现1个空隙.将1个半径小的球填入此空隙刚好使得小球与4个大球相切.根据几何关系可以算出D的临界值,如图2所示.
图2

同理,当0.115
(1)若S2-作面心立方最密堆积,此时根据“最密堆积球数:八面体空隙数∶四面体空隙数=1∶1∶2”可推知,八面体空隙有4个,四面体空隙有8个;又因为0.225 (2) 若S2-作六方最密堆积,Zn2+仍填入四面体空隙中.根据“球数∶八面体空隙数∶四面体空隙数=1∶1∶2”的关系推知,有一半四面体空隙未被占据. 图3 立方ZnS和六方ZnS是非常重要的两种晶体结构. 已投入使用的半导体除Si、Ge单晶为金刚石型结构外,Ⅲ-V族和Ⅱ-Ⅵ族的半导体晶体都是ZnS型,且以立方ZnS型为主.属于六方ZnS结构的化合物有Al、Ga、In的氮化物,一价铜的卤化物,Zn、Cd、Mn的硫化物、硒化物. 当大球作最密堆积时,由上下两层各3个球相互错开60°而围成的空隙为八面体空隙,将小球填入空隙使得小球与空隙中的6个大球相切,由几何关系可计算出D的临界值,如图4所示. 图4 当0.225 图5 例如NaCl型(如图5所示). Cl-作面心立方最密堆积,此时根据“最密堆积球数∶八面体空隙数∶四面体空隙数=1∶1∶2”可推知,八面体空隙有4个,四面体空隙有8个;又因为0.414 当8个等径大小的球堆积成1个立方体时,中心位置出现了1个空隙.将1个小球填进此空隙且与8个球均相切时,根据几何关系算出D得临界值,如图6所示. 图6 图7 当0.414 例如CsCl型(如图7所示). Cl-作简单立方堆积,0.732 综上所述,阳阴离子半径比与配位数、所占空隙类型的关系见下表: D值范围配位数空隙类型0.155≤D<0.2553正三角形0.255≤D<0.4144正四面体0.414≤D<0.7326正八面体0.732≤D<18正立方体D=112立方八面体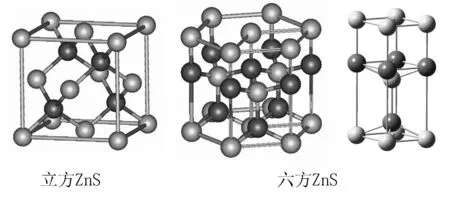
三、正八面体空隙

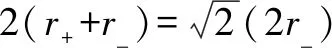

四、立方空隙