酶解法制备牡丹籽ACE抑制肽及其稳定性
陈秋銮,陈雪芹,马 倩,谢李玲,薛婉茹,孟 春,洪 晶
(福州大学生物科学与工程学院,福建福州 350000)
高血压是一种心血管综合征,高血压患者是我国患病人群中最大的一个群体。肾素-血管紧张素系统(RAS)是人体内重要的体液调节系统,在血压的调节中发挥直接作用。在RAS系统中,体内肾素作用于血管紧张素原将其转换为血管紧张素Ⅰ,血管紧张素Ⅰ在血管紧张素酶(ACE)催化作用下转为为血管收缩因子——血管紧张素Ⅱ,最终导致机体血压升高。ACE抑制剂(ACEI)能够抑制ACE酶活性,起到调节血压作用,是第五种最常见的处方药,ACE抑制剂可使心血管病人的5年死亡率降低近五分之一,也是临床首选的药物之一[1-2]。常见的ACE 抑制剂药物有卡托普利、苯那普利、依那普利、培哚普利等,但是临床上显示长期服用降压药,会有咳嗽、血管性水肿、头痛等不良反应[3]。目前植物蛋白质源的生物活性肽研究得到被重视,特别是降压肽,因其具有天然、安全性高、易吸收、无副作用的特点而备受关注[4]。ACE抑制肽是一种小分子活性肽,能够抑制血管紧张素转化酶,起到降血压的作用。
现已从多种食物蛋白源中发现不同ACE抑制肽,包括从乳源蛋白[5]、植物蛋白(比如油棕榈、核桃、葵花籽、花生、大豆、藻类等)[6-11]、鱼类[12]等天然蛋白源发现ACE抑制肽,说明ACE抑制肽来源丰富,得到了广泛地研究。
牡丹籽经榨油后的籽粕大多丢弃或者作为动物饲料,其生物利用率低。有研究表明牡丹籽蛋白含量为18%~35%[13-14],其蛋白中必需氨基酸含量与大豆分离蛋白的相似[15],具有很高的营养价值,可作为天然植物蛋白的重要来源,也可作为生物活性肽的很好来源。但目前关于牡丹籽活性肽的研究较少,颜辉等[16]采用超声酶法制备降血糖肽,Zhang等[17]从牡丹籽中分离鉴定了一种新型的抗氧化肽SMRKPPG,说明牡丹籽粕蛋白并未得到很好的研究利用,因此有必要对牡丹籽粕蛋白来源的活性肽进一步研究。本研究探索牡丹籽粕ACE抑制肽的制备工艺,以及牡丹籽ACE抑制肽在高温及酸、碱条件下的稳定性和经过胃肠道蛋白酶消化后的ACE抑制活性变化,为牡丹籽多肽生产和保存提供理论基础,达到牡丹籽粕蛋白的有效利用,提高牡丹籽的附加价值,实现资源的综合利用,具有重要的意义。
1 材料与方法
1.1 材料与仪器
牡丹籽粕 购于山东菏泽市场;中性蛋白酶(105000 U/g)、碱性蛋白酶(82000 U/g)、风味蛋白酶(18000 U/g)、胃蛋白酶(5700 U/g)、胰蛋白酶(97000 U/g) Notlas生物科技有限公司;血管紧张素转化酶(ACE)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG) 美国Sigma公司;茚三酮 上海源叶生物科技有限公司;BCA蛋白浓度测定试剂盒 碧云天生物技术有限公司。
HH-4数显恒温水浴摇床 国华电器有限公司;Z323K低温离心机 德国赫默公司;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;pH700 pH计 美国Eutech公司;SpectraMax i3酶标仪 美国美谷分子仪器有限公司。
1.2 实验方法
1.2.1 牡丹籽粕蛋白的提取 参考宋艳秋等[14]报道的方法从牡丹籽粕中提取蛋白,提取工艺条件为:料液比1∶25,浸提pH9. 25,提取温度53 ℃,提取时间70 min。4 ℃条件下10000 r/min离心15 min,获得上清液,测定蛋白浓度,计算蛋白提取率。调节上清液pH3.5进行酸沉,于4 ℃条件下10000 r/min离心15 min,沉淀用水复溶,调节pH为中性,冷冻干燥备用。采用凯氏定氮法(GB 5009.5-2016)测定提取蛋白的蛋白含量。
式(1)
式(1)中:c:上清液蛋白浓度,mg/mL;V:上清液体积,mL;m:原料牡丹籽粕的量,g;p:原料牡丹籽粕的蛋白含量,%。
1.2.2 牡丹籽ACE抑制肽的制备 牡丹籽粕ACE抑制肽的酶解工艺流程为:牡丹籽粕蛋白→酶解→灭酶→离心取上清液,操作要点:将牡丹籽粕蛋白配制为一定浓度的蛋白质溶液,100 ℃预处理10 min,调pH,加入一定量的酶,恒温水浴摇床酶解,酶解后于沸水浴灭酶10 min,冷却至室温,调pH至中性后于4 ℃条件下10000 r/min离心15 min,取上清测定ACE抑制活性。
1.2.3 蛋白酶的筛选 以牡丹籽粕蛋白为原料,选取5种蛋白酶并在其最适的条件下进行酶解,分别为中性蛋白酶(pH7.0,50 ℃)、胃蛋白酶(pH3.0,37 ℃)、胰蛋白酶(pH8.0,37 ℃)、风味蛋白酶(pH6,50 ℃)和碱性蛋白酶(pH8.5,60 ℃)。在底物浓度为2%,加酶量6000 U/g,酶解3 h,灭酶,离心,取酶解液冷冻干燥,将冻干粉配制为2 mg/mL的多肽溶液,测定ACE的抑制率,选择合适的蛋白酶。
1.2.4 单因素实验
1.2.4.1 pH对酶解液ACE抑制率及水解度的影响 配制浓度为2%(w/v)的蛋白溶液,分别调节pH为6.0、6.5、7.0、7.5、8.0,加酶量为6000 U/g,在50 ℃条件下水解3 h,探究pH对酶解液ACE抑制率和水解度的影响。
1.2.4.2 加酶量对酶解液ACE抑制率及水解度的影响 配制浓度为2%(w/v)的蛋白溶液,调节pH为7.0,加酶量分别为2000、4000、6000、8000、10000 U/g,在50 ℃条件下水解3 h,探究加酶量对酶解液ACE抑制率和水解度的影响。
1.2.4.3 底物浓度对酶解液ACE抑制率及水解度的影响 分别配制浓度为0.5%、1%、2%、3%、4%、5%(w/v)的蛋白溶液,调节pH为7.0,加酶量为6000 U/g,在50 ℃条件下水解3 h,探究底物浓度对酶解液ACE抑制率和水解度的影响。
1.2.4.4 时间对酶解液ACE抑制率及水解度的影响 配制浓度为2%(w/v)的蛋白溶液,调节pH为7.0,加酶量为6000 U/g,在50 ℃下分别酶解1、2、3、4、5 h,探究时间对酶解液ACE抑制率和水解度的影响。
1.2.4.5 温度对酶解液ACE抑制率及水解度的影响 配制浓度为2%(w/v)的蛋白溶液,调节pH为7.0,加酶量为6000 U/g,分别在40、45、50、55、60、65 ℃下酶解2 h,探究温度对酶解液ACE抑制率和水解度的影响。
1.2.5 牡丹籽ACE抑制肽制备条件的响应面优化 根据单因素的实验结果,选定底物浓度为2%(w/v),酶解时间2 h,选择pH、加酶量(U/g)和温度(℃)这三个因素为响应变量,ACE抑制率(%)为响应值,设计响应面分析实验。因素水平及编码表见表1。

表1 响应面试验的因素水平
1.2.6 ACE抑制活性的检测 ACE抑制率的检测参考骆琳等[18],以FAPGG为底物,在酶标板中按照表2添加反应物,借助酶标仪在340 nm下,测定反应前的吸光度A1,而后在37 ℃下孵育30 min后测定吸光值A2,计算ΔA,ΔA=A1-A2,以单位时间内吸光度值的变化表示ACE酶活性,ACE抑制率的计算为式(2):
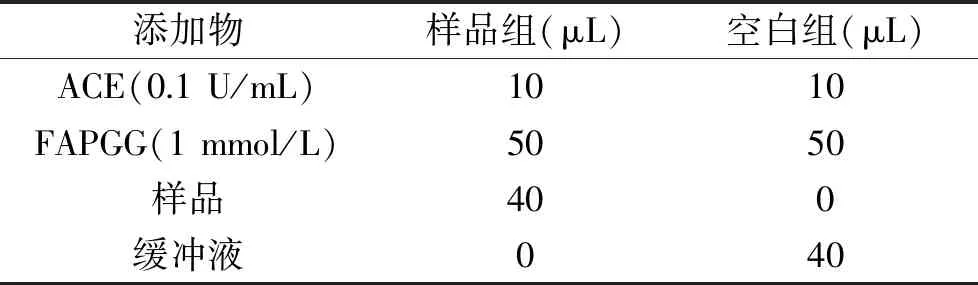
表2 ACE抑制活性的测定
式(2)
式(2)中:ΔAb为加入缓冲液时吸光度在30 min内的变化;ΔAa为加入抑制剂时吸光度在30 min内的变化。
1.2.7 水解度DH的测定 采用茚三酮法[19],水解度的计算为式(3):
式(3)
式(3)中:htot:每克原料蛋白的肽键毫摩尔数,mmoL/g;c:水解液游离氨基浓度,μmoL/mL;p:水解液蛋白浓度,mg/mL;m:每克原料蛋白的游离氨基的毫摩尔数,mmoL/g。
1.2.8 牡丹籽ACE抑制肽的稳定性 分析根据最佳条件制备ACE抑制酶解液,并冻干即得牡丹籽ACE抑制肽粗肽粉,配制浓度为3 mg/mL的多肽溶液,以ACE抑制率为指标,分别考察温度、pH以及体外模拟胃肠道酶系对牡丹籽ACE抑制肽稳定性的影响。
1.2.8.1 温度对牡丹籽ACE抑制肽的稳定性影响 将ACE抑制肽溶液(pH为7.0)分别置于20、40、60、80和100 ℃水浴中保温2 h,冰水浴冷却,测定ACE抑制率。
1.2.8.2 pH对牡丹籽ACE抑制肽的稳定性影响 将牡丹籽ACE抑制肽的pH分别调至2.0、4.0、6.0、8.0和10.0,在4 ℃条件下冷藏保存24 h后,调节pH为7.0,测定ACE抑制率。
1.2.8.3 模拟胃消化道对牡丹籽ACE抑制肽活性的影响 将牡丹籽ACE抑制肽溶解于0.1 mol/L的HCl缓冲液(pH2.0)并加入4%(w/w)的胃蛋白酶。在37 ℃水浴条件下水解3 h,然后沸水浴灭酶10 min,冷却后用NaOH调pH至7.0。8000 r/min离心10 min,测定上清液的ACE抑制率。
1.2.8.4 模拟肠消化道对牡丹籽ACE抑制肽活性的影响 取1.2.8.3中离心前pH为7.0的溶液,加入4%(w/w)的胰蛋白酶,37 ℃水浴条件下继续水解3 h,然后沸水浴灭酶10 min,冷却后,8000 r/min离心10 min,测定上清液的ACE抑制率。
1.3 数据处理
采用Graph Pad Prism 7作图与方差分析、显著性分析。
2 结果与分析
2.1 牡丹籽粕蛋白的提取
牡丹籽粕蛋白的提取率为65.28%±0.67%,提取的牡丹籽粕蛋白中蛋白含量为77.80%±1.15%。
2.2 水解蛋白酶的筛选
将上述五种酶在各自的最适条件下酶解牡丹籽粕蛋白,以ACE抑制率为指标,同时与未酶解的蛋白进行对比,筛选出制备ACE抑制肽最优的蛋白酶,结果见图1。

图1 五种蛋白酶水解对牡丹籽蛋白的ACE抑制率的影响
由图1可得,牡丹籽蛋白经五种蛋白酶水解作用后,ACE抑制率显著提高(P<0.05),采用中性蛋白酶得到的酶解液的ACE抑制率最高,碱性蛋白酶次之,且由中性蛋白酶解得到的酶解液的ACE抑制活性显著高于胃蛋白酶、胰蛋白酶和风味蛋白酶的酶解液(P<0.05)。姜莉等[20]采用木瓜蛋白酶酶解核桃蛋白制备ACE抑制肽,抑制率达88.86%,拉升·再尼西等[21]采用碱性蛋白酶酶解葵花籽粕制备ACE抑制肽,其抑制率为85.49%,宋亮等[22]采用中性蛋白酶酶解玉米蛋白制备ACE抑制肽,得到的最大ACE抑制率为85.65%,周晓晴等[23]采用胃蛋白酶优化酶解鲫鱼加工下脚料制备ACE抑制肽,优化后的抑制率可达75.79%。可见在制备ACE抑制肽的过程中,选择的最佳水解酶不全相同,造成最佳酶制备ACE抑制肽的选择差异可能与蛋白酶的酶切位点与底物特性相关。研究表明,当多肽C端为Tyr、Pro、Trp、Phe和Leu能表现出较高的ACE抑制活性[22,24],而中性蛋白酶主要酶切位点为Tyr-、Phe-、Trp-,同时在牡丹籽蛋白的氨基酸分析结果显示,苯丙氨酸与酪氨酸的含量较多[15],所以中性蛋白酶酶切位点较多。综上,本实验采用中性蛋白酶为牡丹籽ACE抑制肽制备酶。
2.3 中性蛋白酶酶解制备ACE肽的工艺研究
2.3.1 单因素实验
2.3.1.1 pH对酶解液ACE抑制率及水解度的影响 由图2可得,在pH为7.0的条件下,ACE抑制率和水解度达到最大,同时ACE抑制率在pH=7.0时差异显著(P<0.05),这主要是pH为7.0时是中性蛋白酶的最适pH。在偏离中性蛋白酶的最适pH时,ACE抑制率与水解度同时降低,因为此时中性蛋白酶酶活受到抑制,酶的活性基团的解离状态发生改变,酶和底物的结合力降低,因而酶反应速率降低,酶解效率也降低,进而使得ACE抑制率和水解度降低。因此选择最佳酶解pH为7.0。

图2 pH对水解度和酶解液ACE抑制活性的影响
2.3.1.2 加酶量对酶解液ACE抑制率及水解度的影响 由图3可得,ACE抑制率随着加酶量的增加呈先增大后降低的趋势,加酶量从2000 U/g增加到6000 U/g时,ACE抑制率和水解度显著增加(P<0.05),且ACE抑制率在加酶量为6000 U/g达到最大。而后继续增大加酶量,水解度继续升高,而ACE抑制率降低,主要可能是ACE抑制肽被水解更多不具有ACE抑制活性的片段小肽,以致于活性降低[25]。故选择最佳加酶量为6000 U/g。
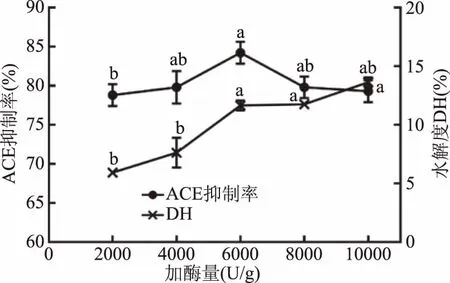
图3 加酶量对水解度和酶解液ACE抑制活性的影响
2.3.1.3 底物浓度对酶解液ACE抑制率及水解度的影响 由图4可得,在底物浓度为0.5%~2%(w/v)的范围内,ACE抑制率和水解度随着底物浓度的增加而增加,且变化显著(P<0.05);当底物浓度为2%(w/v)时,ACE的抑制率与水解度达到最高值,在底物浓度达到2%(w/v)后继续增大底物浓度,ACE抑制率与水解度变化不显著(P<0.05)。原因可能是底物浓度加大,液体黏度变大,底物流动性变差,与酶的接触碰撞机会少,导致酶解效率下降[26],同时水解度也达到饱和状态。故选择最佳底物浓度为2%(w/v)。
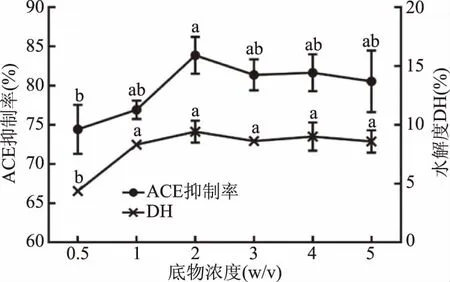
图4 底物浓度对水解度和酶解液ACE抑制活性的影响
2.3.1.4 时间对酶解液ACE抑制率及水解度的影响 由图5可得,选取的时间对于酶解液ACE抑制率的影响较小,可能在1 h前迅速水解,在2 h时酶解液ACE抑制率达到最大,在大于2 h后,水解度继续显著增加,但ACE抑制率下降,可能部分ACE抑制肽继续被水解成活性低的小肽。故选择最佳水解时间为2 h。

图5 时间对水解度和酶解液ACE抑制活性的影响
2.3.1.5 温度对酶解液ACE抑制率及水解度的影响 由图6可得,随着温度的增加,酶解液ACE抑制率与水解度都不断增大,当达到50 ℃时,ACE抑制率和水解度达到最大值,但温度继续增大时,ACE抑制率与水解度都明显下降,可能是由于温度高使得中性蛋白酶结构发生改变,蛋白酶失活[27],使得水解得到ACE抑制肽较少,水解度也降低。故选择最佳水解温度为50 ℃。
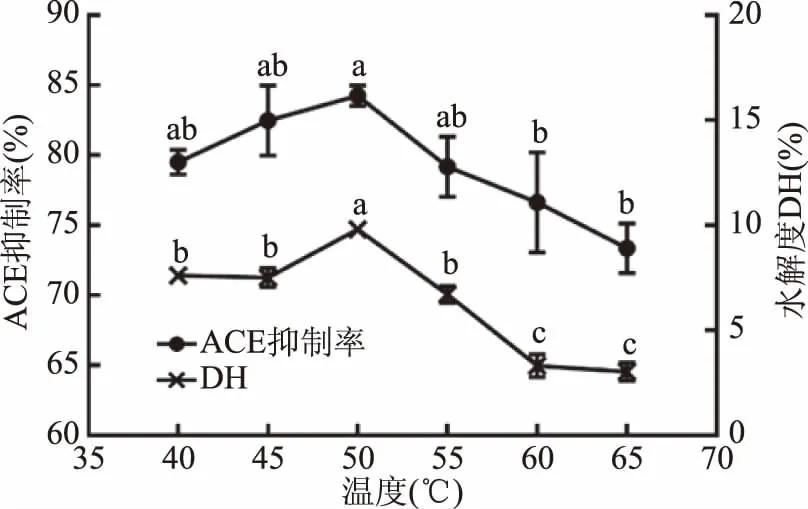
图6 温度对水解度和酶解液ACE抑制活性的影响
2.3.2 牡丹籽粕酶解制备ACE抑制肽的响应面优化
2.3.2.1 响应面回归模型的建立与分析 基于单因素实验结果分析,由于在pH和温度的单因素实验中,ACE抑制率和水解度的变化趋势同步,但在加酶量与时间的单因素实验中,ACE抑制率和水解度的变化趋势不同步,可见ACE抑制率并不总是与水解度呈正相关关系。因此本实验只采用ACE抑制率(R)为响应值,选择pH(A)、加酶量(B)和温度(C)这三个因素为自变量,进行三因素三水平的响应面试验,并选定底物浓度为2%(w/v),酶解时间为2 h,试验设计因素编码及水平见表1。具体响应面试验方案及结果见表3,利用Design-Expert 10.0.4 对响应结果进行方差分析(见表4)。

表3 响应面试验结果
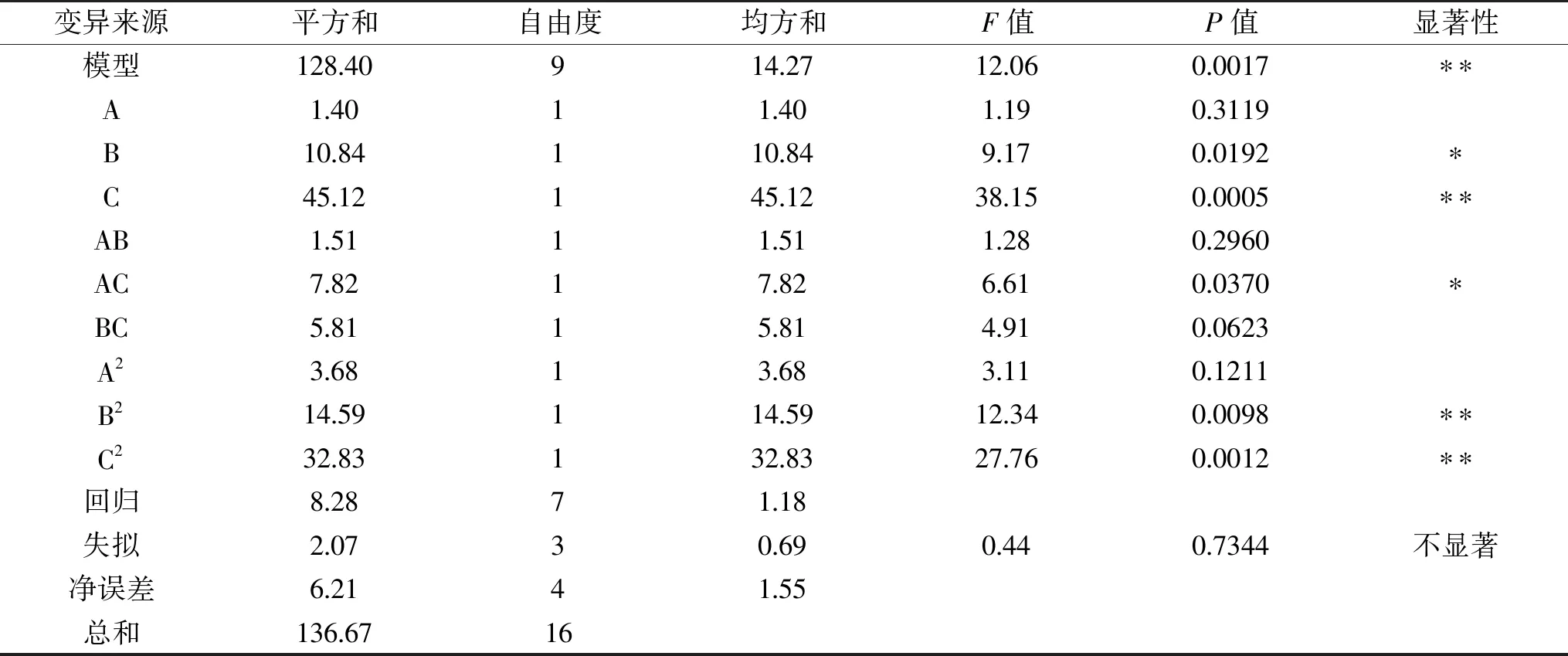
表4 响应面模型回归方程方差分析
利用Design-Expert 10.0.4对表3中的实验数据进行多元回归拟合,得到二次多项回归方程:Y=85.46-0.42A+1.16B-2.37C+0.16AB-1.4AC-1.2BC-0.93A2-1.86B2-2.79C2。模型P值极显著(P<0.01),且失拟项不显著(P>0.05),表明回归模型比较稳定,模型是理想的。表 5中,决定系数R2为0.9394,这表明该模型与实际试验拟合较好,校正后的决定系数为0.8616,与R2较接近,说明了模型具有通用性[28]。变异系数CV%<10%,表明可信度比较高。因素A一次项不显著(P>0.05),因素B显著(P<0.05),因素C极显著(P<0.01),说明温度对ACE抑制率的影响极显著,加酶量对ACE抑制率的影响显著,而pH对ACE抑制率影响不显著。交互项AC偏回归系数达到显著水平(P<0.05),说明pH与温度交互作用显著(P<0.05),而其他两项交互作用不显著(P>0.05)。这三个因素中的二次项B2、C2对ACE抑制率影响均极显著(P<0.01)。此外,从表4的F值可得,三个因子对酶解液ACE的抑制率的影响大小顺序为:温度>加酶量>pH。

表5 回归方程的可信度分析
等高线图可以直观地反映两变量交互作用的显著程度,圆形表示两因素交互作用不显著,而椭圆形或者马蹄形与之相反。由图7可以看出温度与pH的交互作用三维立体图的等高线图为椭圆,说明温度与pH的交互作用显著。
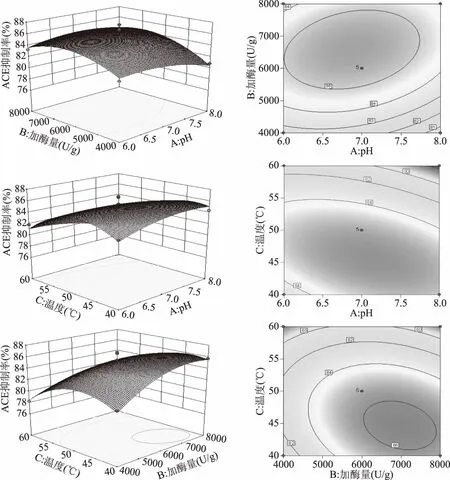
图7 各因素交互三维曲面图和二维等高线图
2.3.2.2 验证实验 利用Design-Expert 10.0.4 软件进行工艺参数的优化组合,得到中性蛋白酶酶解牡丹籽蛋白制备ACE抑制肽的最佳工艺为:底物浓度为2%(w/v),pH7.48,加酶量7222 U/g,酶解温度43.22 ℃,酶解时间2 h,在此条件下酶解液的ACE抑制率可达到86.52%。为了验证回归方程预测结果的可靠性,进行验证实验,又考虑到操作的可行性,采用酶解条件为:底物浓度为2%(w/v),pH7.5,加酶量7200 U/g,温度43 ℃,酶解时间2 h,三次试验,得到的验证结果为86.93%±2.38%,与理论相对误差为0.47%,说明该优化酶解工艺的模型预测值与实际情况拟合度很高,响应面分析法对最优工艺的预测准确可行。
2.4 牡丹籽ACE抑制肽的稳定性
2.4.1 温度对牡丹籽ACE抑制肽的稳定性影响 由图8(a)可知,当温度条件在20~100 ℃变化时,ACE抑制率变化不显著(P>0.05),说明牡丹籽ACE抑制肽的抑制活性受温度的影响不大,ACE抑制肽在一定范围内具有良好的温度稳定性。
2.4.2 pH对牡丹籽ACE抑制肽的稳定性影响 由图8(b)可知,当pH条件在2.0~10.0变化时,ACE抑制率变化不显著(P>0.05),说明牡丹籽ACE抑制肽的抑制活性受酸碱的影响小,ACE抑制肽在一定范围内具有良好的酸碱稳定性。
2.4.3 体外模拟胃肠消化道酶系对ACE抑制活性的影响 由图8(c)可知,牡丹籽ACE抑制肽在经模拟胃、肠消化酶消化前后的ACE抑制活性分别为:87.03%±2.00%、88.67%±0.41%、85.06%±0.59%。结果显示经过胃蛋白酶消化和经过胃蛋白酶与胰蛋白酶消化,ACE抑制率对比未消化的牡丹籽ACE抑制肽都变化不显著(P>0.05),说明牡丹籽ACE抑制肽具有体外胃肠消化稳定性。

图8 牡丹籽ACE抑制肽的温度、酸碱和体外消化的稳定性
3 结论
在单因素实验基础上,采用响应面设计进行试验优化,确定中性蛋白酶酶解牡丹籽粕蛋白制备ACE抑制肽的最佳工艺条件为:底物浓度为2%(w/v),pH7.5,加酶量为7200 U/g,酶解温度43 ℃,酶解时间2 h,实际抑制率可达到86.93%±2.38%。牡丹籽ACE抑制肽具有良好的温度稳定性、酸碱稳定性和体外胃肠道消化稳定性。本研究得到了较高的ACE抑制率和良好稳定性的牡丹籽多肽,为牡丹籽粕的开发利用提供了一定的指导方向,从而为进一步拓宽牡丹籽产业提供思路。

