基于青蒿素的二聚体/杂合体的抗肿瘤活性
(黄淮学院,驻马店 463000)
1 前言
据世界卫生组织(WHO)估计,全球范围内约有20%的人口会在一生中罹患癌症,而约10%的人会因癌症丧命[1]。然而,大多数市售抗肿瘤药物的特异性较差,极易引起各类副作用[2]。更为不幸的是,由于长时间、广泛使用,肿瘤细胞已对几乎所有现有药物产生了不同程度的耐药性[3]。如果情况持续恶化,临床医生可能会在不久的将来面对无药可用的窘境。因此,亟需研发特异性高、毒副作用低和疗效高(尤其是对耐药肿瘤)的新型抗肿瘤药物。
青蒿素(图1)及其半合成衍生物如二氢青蒿素、蒿甲醚和青蒿琥酯等是抗疟疾领域的明星药物,挽救了数以百万人的性命[4,5]。除经典的抗疟疾活性外,青蒿素类化合物具有潜在的抗肿瘤活性,引起了药物化学家的极大关注[6]。研究表明,青蒿素母核中的倍半萜内酯结构片段可在肿瘤细胞血红素二价铁离子(FeII)的作用下发生开环反应,产生高活性的过氧自由基和活性氧自由基(ROS)[7]。所产生的活性自由基可诱导氧化应激、DNA损伤、烷基化靶蛋白和细胞凋亡,故青蒿素类化合物的抗肿瘤作用机制包括抑制肿瘤转移、肿瘤相关信号通路和血管生成等。特别值得一提的是,肿瘤细胞与疟原虫一样,FeII的含量远高于正常细胞,使得这类化合物的特异性较高,毒副作用较低。
然而,青蒿素单核衍生物普遍不足以在体内达到杀灭肿瘤细胞的有效浓度,这就严重限制了此类化合物在抗肿瘤领域的应用[8]。青蒿素二聚体的生物活性普遍优于单核化合物,且二聚体具有良好的体内外抗肿瘤活性,对其进行适当的结构修饰可能会从中筛选出新型抗肿瘤候选物[9]。而将青蒿素母核与其它抗肿瘤药效团杂合所得的杂合体不仅可能具有更高的抗肿瘤活性,而且还有克服耐药性的潜力。因此,近年来青蒿素二聚体和杂合体在抗肿瘤领域的应用引起了药物化学家的极大关注。本文综述了近五年青蒿素二聚体和杂合体在抗肿瘤领域的最新研究进展,以启迪药物化学家更合理的设计此类化合物。
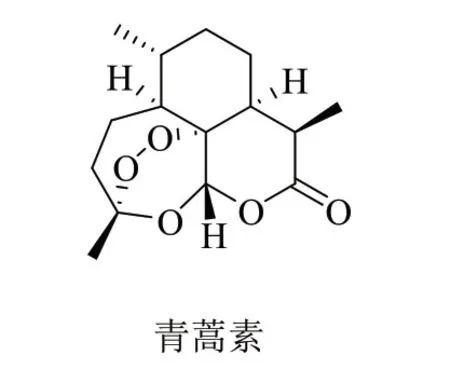
图1 青蒿素的化学结构
2 青蒿素二聚体
酰胺连接的青蒿素二聚体1(图2,半抑制浓度/IC50:1.32~5.08μmol/L)的抗HepG2,MCF-7和HL-60肿瘤细胞活性是母药二氢青蒿素(IC50:14.9~18.3μmol/L)的3.1~11.2倍[10],而二聚体2~5(IC50:1.56~33.71μmol/L)不仅对A375、A549、SH-SY5Y、HCT116和PC12肿瘤细胞具有广谱活性,活性远高于青蒿素(IC50:>50μmol/L),而且对正常L02细胞无毒[11]。作用机制研究结果表明,活性最高的二聚体2a(IC50:1.56~10.26μmol/L)不仅可阻滞细胞周期G1期,而且可通过上调Bad,Bax,caspase-3,caspase-9和下调Bcl-xL蛋白表达水平诱导细胞凋亡。
对一系列不同连接子连接的青蒿素体二聚体的外抗肿瘤活性研究结果表明,二聚体6(IC50:0.69~1.82μmol/L)具有良好的抗人子宫内膜癌细胞RL95-2、KLE、HEC-50、HEC-1-A、HEC-1-B和AN3CA活性[12]。进一步研究发现,该化合物对半胱天冬酶-3,-8和-9的抑制作用呈时间和浓度依赖性。在RL95-2移植瘤Balb/C裸鼠模型中,二聚体6在给药2.5和5mg/kg时分别可抑制35.77%和49.92%的肿瘤生长,活性优于对照药顺铂(给药3mg/kg时可抑制29.76%的肿瘤生长)。不仅如此,二聚体6组未见小鼠行为和组织病理学异常,提示该化合物安全性良好。药代动力学研究发现,该化合物可在小鼠子宫内聚集。显然,该二聚体可作为新型抗子宫癌候选物进一步研究。
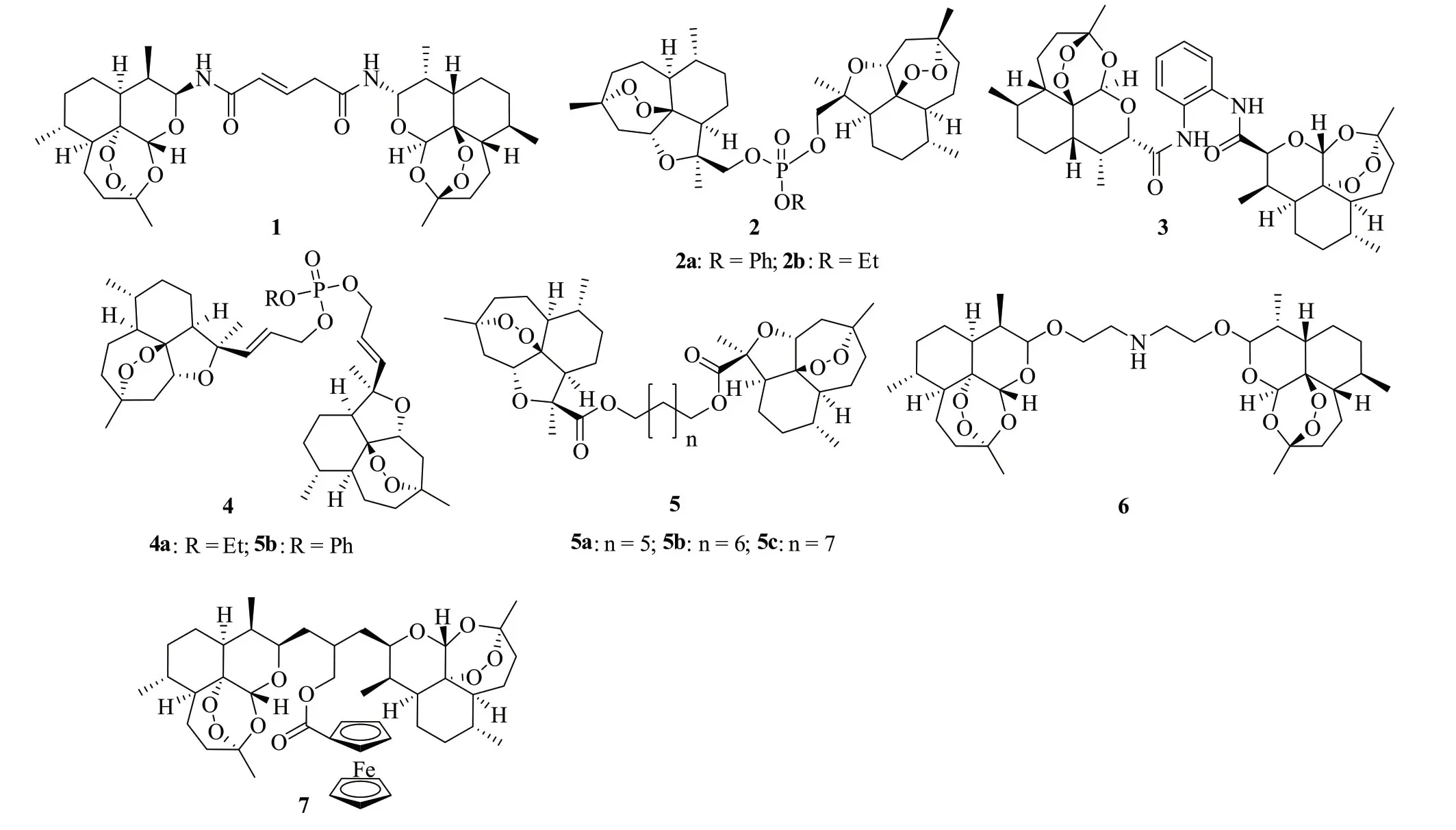
图2 青蒿素二聚体1~7的化学结构
含有二茂铁的二聚体7(IC50:10nmol/L)抗野生型CCRF-CEM细胞活性与阿霉素(IC50:9nmol/L)相当,远优于母药青蒿素(IC50:36.90μmol/L)[13]。该化合物(IC50:1.96μmol/L)对P-糖蛋白过度表达的耐多药CEM/ADR5000白血病细胞也具有潜在的活性,且优于阿霉素(IC50:23.27μmol/L)和青蒿素(IC50:26.90μmol/L),值得进一步研究。
3 青蒿素杂合体
Kapkoti等研究发现,青蒿素-1,2,3-三氮唑杂合体8(图3,IC50:4.06~89.85μmol/L)和9(IC50:17.98~77.30μmol/L)具有潜在的抗K562、PC-3、A431、MDA-MB-231、COLO-205、A549和HEK-293肿瘤细胞活性[14]。其中,代表物8a,b(IC50:4.06~36.65μmol/L)对所测7株肿瘤细胞的活性与阿霉素(IC50:1.43~11.99μmol/L)处于同一水平,而优于青蒿素(IC50:39.03~68.82μmol/L)和二氢青蒿素(IC50:15.74~77.19μmol/L)。不仅如此,二者(IC50:>100μg/mL)对正常HEK-293细胞无毒,值得进一步研究。
杂合体10a,b(IC50:0.047~8.11μmol/L)的抗HL-60,MCF-7和耐阿霉素MCF-7/Adr肿瘤细胞构-效关系(SAR)研究结果显示,延长1,2,3-三氮唑与苯环之间烷基的碳链长度对活性不利[15]。特别值得一提的是,二者抗MCF-7/Adr细胞活性(IC50:0.047和0.11μmol/L)高于抗MCF-7细胞活性(IC50:2.89和8.11μmol/L),提示这类杂合体与阿霉素无交叉耐药性,作用机制异于阿霉素。其中,杂合体10a(IC50:0.047~2.89μmol/L)对所测3株肿瘤细胞的活性是二氢青蒿素(IC50:0.299~20.67μmol/L)的4.6~31.9倍,可作为先导物进一步优化。

图3 青蒿素-唑杂合体8~20的化学结构
Tien 等研究表明,杂合体11 (IC50:12.5~>225μmol/L)的抗KB和HepG2肿瘤细胞活性尽管弱于玫瑰树碱(IC50:0.81和0.93μmol/L),但代表物11a(IC50:12.5和32.9μmol/L)的活性优于青蒿琥酯(IC50:78.5和59.4μmol/L)和二氢青蒿素(IC50:95.3和63.7μmol/L)[16]。杂合体12(IC50:2.5~4.7μmol/L)的抗MCF-7,LU-1,HL-60和P388肿瘤细胞活性与玫瑰树碱(IC50:1.7~3.5μmol/L)相当,而是二氢青蒿素(IC50:39.9~84.3μmol/L)的10.5~21.6倍[17]。杂合体13(IC50:10~39μmol/L)和14(IC50:2.7~21μmol/L)也具有潜在的抗CME和HeLa肿瘤细胞活性,值得进一步研究[18]。
青蒿素-吡唑杂合体15(GI50:0.019~1.42μmol/L)及其差向异构体16(GI50:0.018~0.92μmol/L)和相应的吡唑啉杂合体17(GI50:0.035~1.23μmol/L)及18 (GI50:0.026~0.50μmol/L)具有良好的抗MDA-MB-231,MCF-7和MCF-7/Adr肿瘤细胞活性[19-20]。其中,杂合体16a(GI50:18~240nmol/L)和18a(GI50:30~220nmol/L)多所测肿瘤细胞的活性与阿霉素(GI50:54~540nmol/L)相当或更优,而是二氢青蒿素(GI50:3.32~33.22μmol/L)的52.4~184.4倍,极具进一步开发前景。
青蒿素-咪唑杂合体19(IC50:9.78~>100μmol/L)对大多数所测A549、HepG-2、MDA-MB-231、L02,MCF-7和MCF-7/Adr具有弱到中等强度的活性,而青蒿素(IC50:>100μmol/L)则完全无活性[21]。多数青蒿素-四氮唑杂合体和青蒿素-螺噁唑啉杂合体无抗肿瘤活性,但化合物20(IC50:4.04~46.30 μmol/L)的抗A549,HCT-15和HepG2肿瘤细胞活性略优于5-氟尿嘧啶(IC50:33.68~52.82 μmol/L),值得进一步研究[22~24]。
青蒿素-查耳酮杂合体21(图4,IC50:3.42~3.60μmol/L)不仅抗TK-10,UACC-62和MCF-7肿瘤细胞活性与小白菊内酯(IC50:2.40~9.71μmol/L)相当,而且对正常WI-38 HFLF细胞的毒性(IC50:72.2μmol/L)较低,选择性指数>20,可作为先导物进一步优化[25]。杂合体22(IC50:7~22μmol/L)和23(IC50:15~39μmol/L)的抗Mia PaCa-2,PC-3和HepG2肿瘤细胞活性高于二氢青蒿素(IC50:29~>100μmol/L),但弱于阿霉素(IC50:0.54~1.75μmol/L),仍需进一步结构优化[26]。
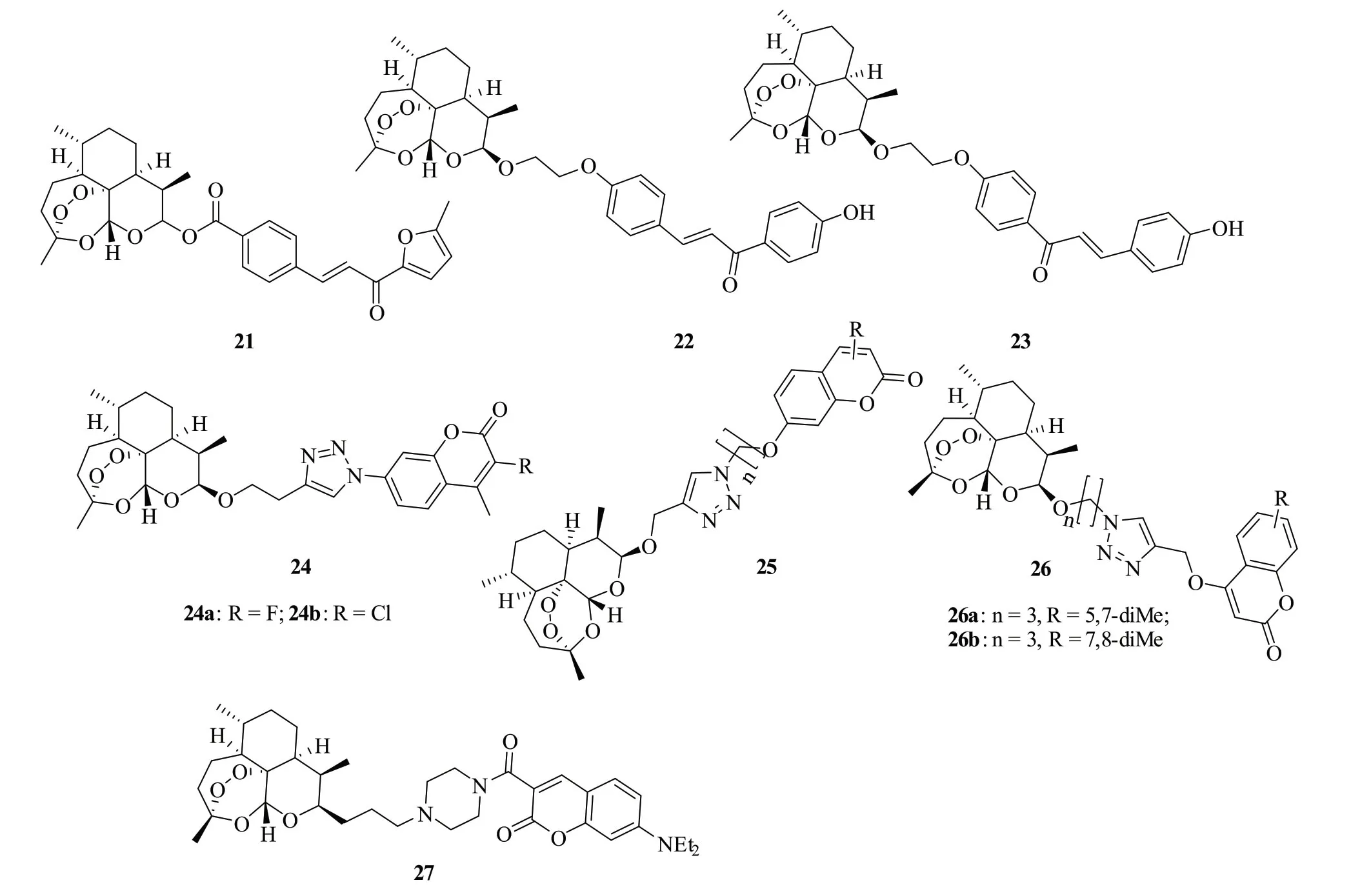
图4 青蒿素-查耳酮/香豆素/喹啉杂合体21~27的化学结构
青蒿素-1,2,3-三氮唑-香豆素杂合体24a,b(IC50:0.01~5.19μmol/L)的抗HT-29和MDA-MB-231肿瘤细胞活性与阿霉素(IC50:0.24~5.98μmol/L)相当,优于二氢青蒿素(IC50:5.64~>100μmol/L)和乙酰唑胺(IC50:>100μmol/L),可作为先导物进一步研究[27]。杂合体25(IC50:0.05~120.72μmol/L)和26(IC50:0.039~>100μmol/L)具有潜在的抗MRC-5、HCT-116、MDA-MB-231和HT-29肿瘤细胞的活性,但普遍弱于阿霉素(IC50:0.05~0.37μmol/L)[28-29]。代表物26a,b(IC50:0.039~30.4μmol/L)的活性优于二氢青蒿素(IC50:10.33~>100μmol/L),值得进一步优化。
青蒿素-哌嗪-香豆素杂合体27(IC50:2.33~23.65 μmol/L)具有潜在的抗HepG2、Hep3B、A2780和OVCAR-3肿瘤细胞活性,而青蒿素(IC50:>100μmol/L)则未显示出任何活性[30]。作用机制研究结果表明,该化合物可通过形成活性氧(ROS)诱导肿瘤细胞凋亡。
青蒿素-雌性激素杂合体28(图5,EC50:150~930 nmol/L)具有优秀的抗乳腺癌细胞MCF-7,MDAMB-231,MDA-MB-361,T47D和C33A活性,且活性优于二氢青蒿素(EC50:1.71~29.80μmol/L)、青蒿琥酯(EC50:1.83~>30μmol/L)和顺铂(EC50:3.69~19.13μmol/L)[31]。显然,该杂合体可能在抗乳腺癌领域大有作为。青蒿素-甾体杂合体29(IC50:0.192和7.159μmol/L),30(IC50:0.019~1.254μmol/L)和31(IC50:35~665nmol/L)等抗CCRF-CEM和耐多药CEM/ADR5000白血病细胞SAR显示,酰胺(X=NH)连接子优于酯(X = O)连接子[32]。代表物30b (IC50:19和345nmol/L)的抗CCRF-CEM和耐多药CEM/ADR5000白血病细胞活性是青蒿素(IC50:36.90和26.90μmol/L)的1942.1和77.9倍,抗耐多药CEM/ADR5000白血病细胞活性是阿霉素(IC50:1.61μmol/L)的4.6倍,极具进一步开发价值。
青蒿素-羟肟酸杂合体32(IC50:1.28~84.80μg/mL)的抗MCF-7,HepG2和HL-60肿瘤细胞SAR研究结果表明,羟肟酸结构片段对活性至关重要,用羧基代替羟肟酸将导致活性大幅下降[33]。代表物32d(IC50:1.28~2.62μg/mL)的活性最高,仅略低于对照药伏立诺他(IC50:0.18~1.90μg/mL),可作为先导物进一步优化。
青蒿素-喹喔啉杂合体33(IC50:110nmol/L)的抗HCT116细胞活性与紫杉醇(IC50:110nmol/L)相当,而是对照药青蒿琥酯(IC50:890nmol/L)、二氢青蒿素(IC50:2.85μmol/L)、顺铂(IC50:10.98μmol/L)和吉非替尼(IC50:19.82μmol/L)的8.0~180.1倍[34]。在HCT116裸鼠异体移植肿瘤模型中,该杂合体的活性优于吉非替尼和二氢青蒿素,且未显示出明显的体内毒性,值得进一步开发。

图5 青蒿素-杂合体28~33的化学结构
对一系列青蒿素-百里醌杂合体的抗HCT116和PC-3肿瘤细胞研究结果表明,代表物34a(图6,IC50:2.4μmol/L)的活性是母药青蒿琥酯(IC50:5.3 μmol/L)和百里醌(IC50:50.1μmol/L)的2.2和20.8倍[35-36]。细胞毒性试验显示,该杂合体(IC50:>100μmol/L)对正常HCEC细胞无毒性。作用机制研究显示,该杂合体可促使ROS的产生诱导肿瘤细胞凋亡。青蒿素-砜杂合体35(IC50:60nmol/L)不仅抗SMMC-7721细胞活性是青蒿素(IC50:440nmol/L)和二氢青蒿素(IC50:400nmol/L)的>6倍,而且对正常细胞的毒性(IC50:362.2μmol/L)极低,选择性指数高达6036[37]。
青蒿素-磺酰胺杂合体36a(IC50:0.05~2.11μmol/L)和36b(IC50:0.09~3.71μmol/L)具有良好的抗HT-29,MDAMB-231,U87MG,H460,A549和HL-60肿瘤细胞活性,且二者的活性均优于二氢青蒿素(IC50:5.29~15.82μmol/L)和顺铂(IC50:4.31~10.31μmol/L)[38-39]。细胞毒性试验结果表明,二者(IC50:37.47和28.17μmol/L)对正常WI38细胞的毒性较低,选择性指数为7.5~749.4。

图6 青蒿素-杂合体34~37的化学结构
青蒿素-吲哚杂合体37a,b(IC50:5.25~42.59μmol/L)对MCF-7,A549,HepG2和L02肿瘤细胞具有潜在的活性,但活性远逊于对照药阿霉素(IC50:0.67~1.13 μmol/L)[40]。值得注意的是,杂合体37a,b与阿霉素联合使用时可显著地提高阿霉素的抗耐多药MCF-7/ADR细胞活性(IC50由89.14μmol/L降低至0.93和0.76 μmol/L),故二者可作为先导物进一步研究。
4 结束语
癌症是仅次于心脑血管疾病的第二大类致死性疾病,每年数百万人因此丧命。抗肿瘤药物对癌症的治疗不可或缺,但由于耐药性和副作用等诸多问题,使得抗肿瘤药物的临床应用不断受到限制。因此,亟需开发新型抗肿瘤药物。青蒿素二聚体和杂合体具有潜在的体内外抗肿瘤活性,其中,二聚体7和杂合体16a,18a,30b对药敏型和耐药型肿瘤细胞均具有良好的活性,而二聚体6和杂合体33不仅具有良好的体内外活性,而且显示出良好的安全性,提示这类化合物可能在抗肿瘤领域大有作为。本文综述了青蒿素二聚体和杂合体在抗肿瘤领域的最新研究进展,为进一步合理设计打下基础。
——青蒿素

