整肠丸的长期毒性研究
熊明朋,龚玮,刘波,郑洋滨,刘宁
江西省药品检验检测研究院,国家药品监督管理局中成药质量评价重点实验室,江西省药品与医疗器械质量工程技术研究中心,南昌 330029
整肠丸主要有丁香、肉桂、陈皮、甘草、薄荷脑等组成,用于消化不良、水土不服和食物不洁所致肠胃不适,腹胀肚痛,恶心呕吐等,具有保护胃黏膜和调节肠道菌群功能的作用[1]。为了预测其可能对人体产生的不良反应,降低临床受试者和药品使用人群的用药风险,需在动物体内进行长期毒性研究。长期毒性实验是研究动物连续给予受试物后,观察受试物对动物机体产生的毒性反应,可预测受试物可能引起的临床不良反应,判断反复给药后的毒性靶器官和靶组织,推测临床试验的安全剂量以及提示临床试验中需重点监测的指标。本实验以人体推荐量的60 倍、30 倍、15 倍整肠丸对SD 大鼠进行3 个月喂养试验,评价其安全性。
1 材料与方法
1.1 试药整肠丸(香港李万山药厂有限公司,批号:903013);生化试剂盒(江西特康科技有限公司)。
1.2 仪器7020 自动生化仪(株式会社日立制作所);五分类全自动血细胞分析仪(江西特康科技有限公司);EG1150H 石蜡包埋机[徕卡显微系统(上海)有限公司];HM355S 全自动石蜡切片机(MICROM 国际股份有限公司);H11220 烘片机(上海徕卡仪器有限公司);全自动封片机(赛默飞世尔科技公司);BX63 双人共览荧光显微镜[奥林巴斯(中国)有限公司]。
1.3 实验动物及环境SPF 级SD 大鼠120 只,雌雄各半,体重80~100 g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2016-0002,饲养于本实验室屏障环境中,实验动物使用许可证号:SYXK(赣)2019-0001,动物自由摄食和饮水。
1.4 实验方法设低、中、高剂量分别为0.99、1.98、3.96 g/kg·bw;阴性对照组给予相同体积纯化水,每组雌雄各15 只,按0.1 mL/kg·bw 经口灌胃,每日一次,每周6 天。连续给药3 个月,并停药2 周作恢复性观察。
实验期间,每天观察并记录动物的一般表现、中毒体征和死亡情况,每周称一次体重,按体重调整灌胃体积,计算动物体重增长量。实验结束(3个月给药期结束时,各组取20 只大鼠)及停药后2周(恢复期,各组取剩余10 只大鼠)分别取血测定血红蛋白、红细胞计数、白细胞计数、血小板、淋巴细胞、红细胞平均血红蛋白浓度、中性细胞、血小板比容、平均血小板体积等血液学指标;取血清测定谷丙转氨酶、谷草转氨酶、尿素氮、肌酐、血糖、甘油三酯、总胆固醇、总蛋白和血清白蛋白、碱性磷酸酶等生化指标。
实验结束(3 个月给药期结束时,各组取20 只大鼠)及停药后2 周(恢复期,各组取剩余10 只大鼠)分别处死动物,解剖,观察大体变化并称重(心脏、胸腺、肾上腺、肝、肾、脾、子宫、脑、肺、卵巢、附睾、睾丸),计算脏/体比值。取心、肝、脾、肺、肾、胃、小肠、甲状腺、主动脉、胰腺、胸腺、大脑、小脑、脊髓、肾上腺、膀胱、坐骨神经、睾丸、前列腺、附睾、气管、食管、卵巢、子宫等脏器固定保存,对各剂量组的上述脏器进行组织病理检查,按组织固定、脱水、浸蜡、包埋、切片、烘片、染色和封片顺序制作病理切片[2-5]。
1.5 统计学方法实验数据处理采用Excel 2007 软件,统计分析采用SPSS 13.0 进行处理,数据以的形式表示。
2 实验结果
2.1 对一般状态的影响试验期间各组大鼠生长良好,活动、进食饮水及大小便情况正常。
2.2 对体重的影响在给予0.99、1.98、3.96 g/kg·bw剂量的整肠丸3 个月及停药2 周后,各剂量组大鼠体重增长趋势与阴性对照组基本一致,与阴性对照组比较均差异无统计学意义(P>0.05)。
2.3 对血液学指标的影响整肠丸对大鼠血液学指标的影响见表1 和表2,试验结束期雄性低剂量组的红细胞分布宽度(RDW)与阴性对照组比较有显著性差异(P<0.05),其它指标均无显著性差异;停药两周后均能恢复,所测血液指标均无显著性差异(P>0.05)。
2.4 对血生化指标的影响整肠丸对大鼠血生化指标的影响见表3 和表4。试验结束期,雄性低剂量大鼠的谷草转氨酶(AST)和尿素(BUN)与阴性对照组比较有显著性差异(P<0.05);雌性低剂量大鼠的谷草转氨酶(AST)与阴性对照组比较有显著性差异(P<0.05);雌性中剂量大鼠的肌酐(CRE)与阴性对照组比较有显著性差异(P<0.05);雌性中剂量大鼠的甘油三酯(TG)与阴性对照组比较有极显著性差异(P<0.01);雄性高剂量组白蛋白(ALB)与阴性对照组比较有显著性差异(P<0.05);其余指标均无显著性差异(P>0.05)。
表1 试验结束整肠丸对大鼠血常规的影响(,n=10)
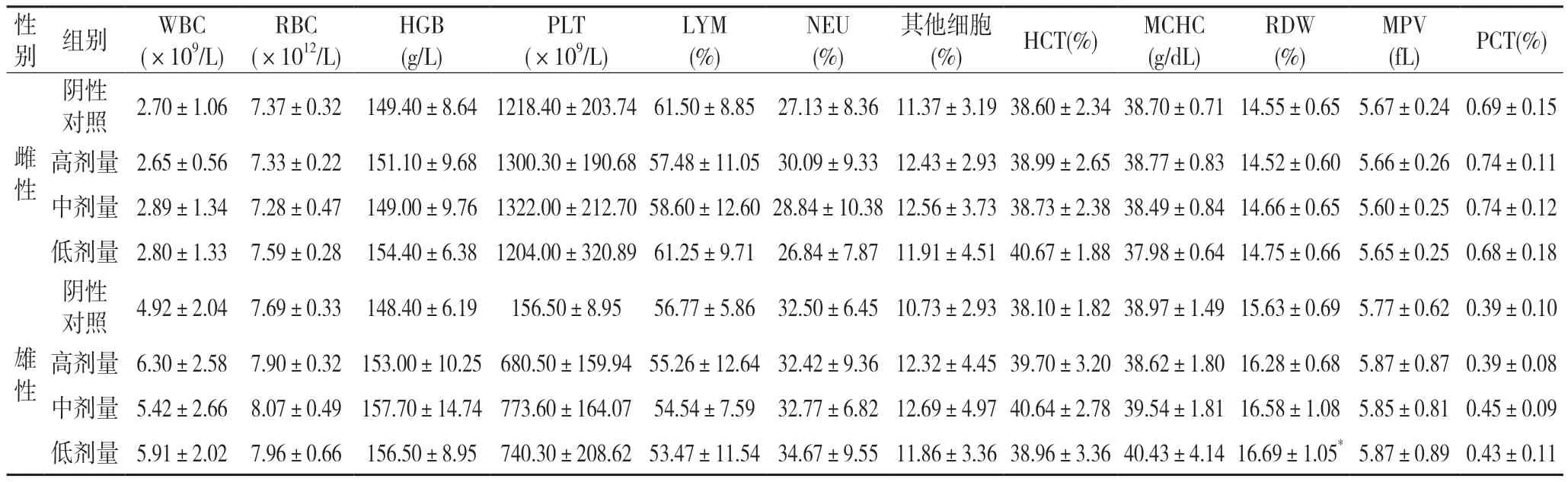
表1 试验结束整肠丸对大鼠血常规的影响(,n=10)
注:1.与阴性对照组比较,*:P<0.05。2.WBC:白细胞计数;RBC:红细胞计数;HGB:血红蛋白;PLT:血小板;LYM:淋巴细胞;NEU:中性细胞;HCT:红细胞比容;MCHC:红细胞平均血红蛋白溶度;RDW:红细胞分布宽度;MPV:平均血小板体积;PCT:血小板比容;下同。
表2 试验恢复期整肠丸对大鼠血常规的影响(,n=5)

表2 试验恢复期整肠丸对大鼠血常规的影响(,n=5)
表3 试验结束整肠丸对大鼠血生化的影响(,n=10)

表3 试验结束整肠丸对大鼠血生化的影响(,n=10)
注:1.与阴性对照组比较,*:P<0.05 ;与阴性对照组比较,**:P<0.01;2.CRE:肌酐;AST:谷草转氨酶;ALT:谷丙转氨酶;TP:总蛋白;ALB:血清白蛋白;GLU:血糖;BUN:尿素氮;ALP:碱性磷酸酶;TC:总胆固醇;TG:甘油三酯;下同。
表4 试验恢复期整肠丸对大鼠血生化的影响(,n=5)

表4 试验恢复期整肠丸对大鼠血生化的影响(,n=5)
试验恢复期,各剂量组大鼠生化指标与阴性对照组比较均无显著性差异(P>0.05)。
2.5 对脏器重量和脏器/体重比值的影响整个试验期间各剂量组大鼠心脏、胸腺、肾上腺、肝、肾、脾、子宫、睾丸、脑、肺、卵巢、附睾脏器重量和脏体比与阴性对照组比较均无显著性差异(P>0.05)。
2.6 对大体观察及组织学检查对全部实验动物进行大体肉眼解剖检查,试验结束期中、高剂量组各1 只动物出现子宫积液;其余动物大体形态正常,各器官均未见异常。停药2 周恢复期各组动物器官均未见明显异常。
试验结束及恢复期分别取各组的肝、肾、脾、胃肠、子宫和卵巢等器官进行病理组织学检查,均未见异常,组织结构均正常。
3 讨论
整肠丸的临床人体推荐剂量为0.066 g/kg·bw,参照拟用临床剂量法[3],本实验选用临床剂量的15、30 和60 倍设定低、中、高剂量组,即0.99、1.98、3.96 g/kg·bw。为了维持药物浓度在大鼠体内有较稳定的水平,采用连续给药方式[4],连续三个月每周给药6 天,保持药物在机体内的生物学效应。
对大鼠进行大体肉眼解剖检查,结束期偶见3只雌性大鼠出现子宫积液,但对其病理组织学检查,均未见异常,可能原因是生理性子宫积液,多见于月经期,是非病理性的。
血液生理生化指标值不仅受个体遗传物质控制[6],还受年龄、性别、环境营养等因素影响,若其中一个因素发生改变,都可能引起最终测定值的变化。在本实验中,有少量的血常规指标如血红蛋白和血生化指标如谷草转氨酶与阴性对照组比较有显著性差异(P<0.05),但这些指标差异无剂量依赖趋势[7-10],且病理学未检出与药物毒性相关的病理变化,表明这些指标差异可能非该药的毒性所致,这与停药2 周后各项指标恢复正常相一致。然而血液生理生化值是判定药物对靶器官和靶组织毒性的重要指标[3],提示在后续的临床试验中需重点监测血液生理生化指标。
4 结论
本研究结果表明以整肠丸人体推荐量的60 倍、30 倍、15 倍对SD 大鼠进行3 个月喂养试验,大鼠少数血液生理生化指标有一定的改变,但停药2 周后可以恢复,在今后的临床应用过程中仍值得继续关注。

