结直肠广基锯齿状病变临床病理研究进展
范思斯,曾 俊,刘 勇
1996年Torlakovic和Snover[1]首次报道6例“增生性息肉病”中观察到广基锯齿状息肉(sessile serrated polyp, SSP),并称之为形态学类似增生性息肉的“锯齿状腺瘤”。2003年Torlakovic等[2]再次对无“增生性息肉病”的289例锯齿状息肉进行详细评估,发现了一组异常增殖的锯齿状息肉,与1996年观察到的广基锯齿状息肉形态学相似,为使此类息肉患者接受密切结肠镜监测,作者建议将其命名为广基锯齿状腺瘤(sessile serrated adenoma, SSA)。鉴于上述锯齿状息肉缺乏腺瘤样上皮,WHO(2010)消化系统肿瘤分类中采纳广基锯齿状腺瘤/息肉(SSA/P)并列的命名方式。2017年英国胃肠病学会发布结直肠锯齿状息肉临床指南,考虑缺乏细胞学异型性且不完全呈息肉状,因而推荐使用广基锯齿状病变(sessile serrated lesion, SSL)[3]。WHO(2019)消化系统肿瘤分类[4]中采纳广基锯齿状病变或广基锯齿状病变伴异型增生(sessile serrated lesion with dysplasia, SSLD)的命名,不再推荐SSA/P的命名。
1 结直肠广基锯齿状病变临床表现
SSL多位于近端结肠,即乙状结肠以近,有文献报道国人乙状结肠也是好发部位[5]。直径常>5 mm,中位年龄61岁[6],无明显性别差异。普通白光内镜下易遗漏,病变多扁平,边界模糊。巴黎分型主要为0~Ⅱa型,部分为0~Ⅰs型,偶有0~Ⅱa+Ⅱc型或0~Ⅰs+Ⅱc型。放大内镜下SSL具有独特的隐窝开口模式,即工藤分类Ⅱ-open(Ⅱ-O)型,较经典Ⅱ型星芒状隐窝开口更宽更圆。Aoki等[7]比较了388例结直肠锯齿状病变和普通型腺瘤的放大内镜表现,91例Ⅱ-O型病变中87.9%为SSL。窄带成像内镜下黏液帽呈红色,隐窝表面见黑点及曲张微血管,NICE分型Ⅰ型多见。
SSLD较少见,占全部SSL的2%~14%[6,8-9],也主要位于近端结肠,中位直径为9~12 mm[9-10],中位年龄66~75岁[6,9-10],女性多发[6,9-10]。普通白光内镜下巴黎分型为Ⅱa+Ⅰp或Ⅱa+Ⅲ型,放大内镜下工藤分类为Ⅱ-O+Ⅲ/Ⅳ型[11]。Aoki等[7]的研究发现36例Ⅱ-O+Ⅲ/Ⅳ型病变中69.4%为SSLD。窄带成像内镜下也类似普通型腺瘤改变,NICE分型呈Ⅱ型。
2 结直肠广基锯齿状病变病理特征
SSL的增殖中心不同于正常结直肠中位于隐窝基底部,而是沿隐窝腔杂乱分布,隐窝上皮细胞从各增殖中心向隐窝开口及基底部双向迁移,形成了一系列结构异常:(1)隐窝整体不规则,扭曲;(2)隐窝拉长,甚至陷入黏膜下层造成“假浸润”;(3)锯齿状结构延伸至隐窝基底部;(4)隐窝下部不对称性扩张,形成分支,或平行于黏膜肌生长,呈L或倒T形、“高跟鞋样”或“锚状”隐窝。WHO(2010)分类中写到如果有2~3个以上连续隐窝显示上述特征时诊断SSL,Rex等[12]国际多学科专家组建议只要有一个明确的异常隐窝就足以诊断。Bettington等[13]比较了采用WHO(2010)诊断标准时SSL约占所有结直肠息肉的12.1%,而采用上述多学科专家组建议时SSL的占比为14.7%。WHO(2019)分类更新为1个以上明确的异常隐窝足以诊断SSL[4]。SSL细胞学形态温和,主要由杯状细胞和含微泡型黏液的细胞构成,后者胞核小且位于基底,核仁不明显。隐窝基底部出现杯状细胞而缺乏神经内分泌细胞,即成熟反转[12]。也有文献提到SSL中存在一定程度的神经内分泌细胞增生[14]。隐窝表面及腔内可见多量黏液,少数情况下固有层间质神经束膜样细胞增生,黏膜下层见显著的脂肪瘤样脂肪组织[12]。免疫组化标记Ki-67显示隐窝腔及基底部杂乱着色,无MLH1表达缺失,无p53和p16过表达或表达缺失。
诊断SSLD需要在1张HE切片中见到SSL陡然转变为异型增生的区域,该区域隐窝结构复杂程度增加伴不同程度的细胞学非典型。WHO(2010)分类中描述了两类SSLD,分别是与普通型腺瘤类似的肠型异型增生和锯齿状异型增生,许多SSLD相关研究中进一步区分低/高级别[6,8,15]。Cenaj等[15]发现与普通型腺瘤相比,SSLD中出现浸润癌的概率增加,并且肠型异型增生比锯齿状异型增生更多出现浸润癌。2017年Liu等[9]提出了四类SSLD组织学亚型,分别是微偏型异型增生、腺瘤样异型增生、锯齿状异型增生和非特指型异型增生。其中微偏型异型增生约占SSLD的19%[9],出现轻微的隐窝结构紊乱、拥挤,细胞学异型性不明显,需要借助MLH1免疫组化标记来识别,表现为几个邻近隐窝MLH1表达丢失,偶尔见到1个或多个锯齿状结构不明显的隐窝基底部MLH1丢失不足以诊断微偏型[14]。腺瘤样异型增生约占SSLD的8%[9],SSL表面为与普通型腺瘤类似的异型增生,无MLH1丢失,无BRAF V600E表达,可能代表了普通型腺瘤异型增生与SSL的碰撞[16]。锯齿状异型增生约占SSLD的12%[9],细胞学异型性明显,胞质丰富嗜酸性,胞核空泡状,核仁明显,核分裂象多见且位于隐窝腔缘。多数保留MLH1表达。非特指型异型增生约占SSLD的79%[9],隐窝结构和细胞学改变各异,异型性明显但不能归入上述三类特指型。多数MLH1表达缺失。WHO(2019)分类在WHO(2010)分类基础上增加了对于微偏型异型增生的描述[4]。实际工作中SSLD并不需要严格分型,而是结合MLH1表达情况识别SSLD以避免漏、误诊。
依据上述SSLD组织学分型,Pai等[14]认为目前消化道普遍采用的异型增生两级分类系统并不适用于SSLD分级,MLH1表达缺失与两级分类系统无可靠相关性,后者不能充分反应SSLD的恶性潜能。这一点在Pai等[4]编写的WHO(2019)分类“结直肠锯齿状病变和息肉”中也有相同描述,但此新版分类中却给出了锯齿状异型增生低/高级别异型增生的ICD-O编码。WHO(2019)分类正文中对锯齿状异型增生描述较为简单,并未详细列出相应低/高级别异型增生特点。同时新版分类中锯齿状异型增生的附图显示锯齿状增生上皮轻度异型,胞质嗜酸性,深染增大的细胞核呈轻微复层排列[4]。与之相对的是Liu等[8]描述的锯齿状异型增生细胞学异型性明显,Pai等[14]也建议锯齿状异型增生只用于具有高级别核特征的异型增生,不区分低/高级别,所谓的“低级别锯齿状异型增生”代表的可能只是SSL中出现部分上皮嗜酸性变。
3 结直肠广基锯齿状病变鉴别诊断
3.1 SSL与增生性息肉(hyperplastic polyps, HP)普通白光内镜下SSL与HP表现类似,需结合其它内镜、病变部位、大小和形态学加以鉴别。放大内镜下HP为经典Ⅱ型隐窝开口;窄带成像内镜下HP无曲张微血管。HP多见于远端结直肠,直径多<5 mm,而SSL多见于近端结肠,且直径多>5 mm。光镜下HP的锯齿状结构位于隐窝中上2/3,基底部无锯齿状结构或其它异常结构。杯状细胞型HP合并黏膜脱垂时可出现隐窝基底部对称性扩张,但无其它异常结构。准确鉴别HP与SSL有赖于正确的组织块包埋方向,必须纵切同时显示隐窝浅部和深部。内镜活检时巴黎分型为Ⅱa的病变一般能钳取到黏膜全层,而Ⅰs的病变不一定能钳取到黏膜全层,即不能见到黏膜肌时很难鉴别两者。还有SSL中可以多数隐窝基底部结构大致正常而少数甚至一个隐窝出现结构异常,由于活检取材的局限性也可能漏诊。
3.2 SSL与传统锯齿状腺瘤(traditional serrated adenoma, TSA)TSA比SSL少见,占所有结直肠息肉的1%~2%,中位年龄64岁,无明显性别差异,多见于远端结肠和直肠,中位直径12 mm[17]。内镜下巴黎分型多为Ⅰp型的隆起大息肉,偶有扁平型。放大内镜下工藤分类多为Ⅱ+Ⅲ/Ⅳ型或Ⅱ-L+Ⅲ/Ⅳ型[7]。TSA光镜下主要表现为裂隙样锯齿状结构和异位隐窝灶,细胞温和,胞质丰富强嗜酸性、胞核呈栅栏状排列,无核分裂象,Ki-67阴性。实际工作中需鉴别:(1)SSL中出现小灶上皮嗜酸性变,局限于隐窝浅部,其它区为典型SSL形态学,这可能是反应性改变[15]。(2)SSL伴锯齿状异型增生与扁平型TSA的鉴别,后者细胞温和且形态一致,若后者也伴锯齿状异型增生时,还能见到裂隙样锯齿状结构或异位隐窝灶,部分鉴别困难的病例归入未分类的锯齿状腺瘤。(3)部分扁平型TSA起源于SSL[18],需分别报告。
4 结直肠广基锯齿状病变分子病理学进展
从正常肠黏膜到SSL再到SSLD,最终发展为锯齿状腺癌的过程被称为锯齿状通路,有别于染色体不稳定性通路和微卫星不稳定性通路。锯齿状通路早期事件主要表现为BRAF突变和CpG岛甲基化表型(CpG island methylator phenotype, CIMP),Cappellesso等[19]采用微切割方法检测同一病例紧邻的SSL和黏膜下浸润癌中11个结直肠癌相关基因164个热点区域突变谱,两者具有大致相同的分子学改变,即BRAF V600E突变和CIMP阳性。依据CpG岛甲基化基因不同分为MLH1甲基化的微卫星不稳定性通路和非MLH1甲基化的微卫星稳定性通路。上述两个通路前期涉及的分子改变不同,有研究示前者出现MLH1甲基化和FBXW7突变,后者出现TP53突变,甲基化基因尚不明确,后期都可出现Wnt通路激活,表现出β-catenin异常核表达[20]。
SSL中82%为BRAF V600E突变,BRAF非V600E突变约1.2%,另外KRAS突变约10.3%,NRAS突变约0.4%[21]。60%BRAF V600E突变合并高CIMP2(NEUROG1、CACNA1G、IGF2、RUNX3、SOCS1),16%KRAS突变合并高CIMP2[21]。SSL中高CIMP、低CIMP和阴性CIMP所占比例分别为25%、55%和20%,CRAB1、NEUROG1和CDKN2A为早期甲基化标志物,CACNA1G、IGF2和RUNX3为中期甲基化标志物,而SOCS1和MLH1为晚期甲基化标志物[22]。高CIMP和(或)MLH1甲基化主要见于50岁以上、近端结肠、直径>5 mm的SSL[22]。BRAF突变/高CIMP的SSL与工藤分类Ⅱ-O型密切相关,而且Ⅱ-O型SSL可进展为BRAF突变/高CIMP/微卫星不稳定性癌[7]。另外SSL的MLH1启动子PMR值(percentage of methylated reference)明显低于SSLD[22],SSL随MLH1甲基化程度增高而进展,表现在免疫组化上SSL保留或部分保留MLH1表达而SSLD完全丢失MLH1表达。
相比SSL,Wnt通路基因突变更常见于SSLD。SSLD中见到50%RNF43、9%APC和7%ZNRF3蛋白截短突变,而SSL只见7%RNF43突变[23]。SSLD中91%Wnt通路靶基因MYC过表达,SSL中为9%,SSLD中76%β-catenin核异常表达,SSL中为11%[23]。另外保留MLH1表达和丢失MLH1表达的SSLD中Wnt通路基因突变谱系不同,前者86%为RNF43单核苷酸重复序列框移突变,后者RNF43突变和APC突变为34%、13%[23]。
5 结直肠广基锯齿状病变临床处理
目前SSL治疗主要是内镜下完整切除,根据病变外形及大小选择冷/热圈套息肉切除、内镜黏膜切除术或内镜黏膜下剥离术等。大的广基病变或病变边界不清给完整切除带来困难,另外阑尾开口和回盲瓣开口病变内镜下难于切除可能需要手术[24]。内镜下治疗2~6个月[3]后建议内镜活检病变切除边缘确保病变完整切除从而减少间期癌。
2006年Sheridan等[25]在5例SSL中观察到高级别SSLD和浸润癌,4例病变直径≤10 mm,最小的为3 mm。2009年Oono等[26]报道1例未处理的升结肠扁平息肉,8个月后复查时发现黏膜下浸润癌,并见浸润癌与管状腺瘤及SSL三者相移行。因此SSL被认为具有快速恶性转化潜能。一项大宗回顾性研究显示SSL与锯齿状腺癌中位年龄相差15年,SSL进展时间远比普通型腺瘤长[6]。2017年Bettington等[13]所做横向研究显示SSL中位年龄比SSLD早17年,而SSLD与锯齿状腺癌中位年龄相似。上述两项研究提示快速恶性转化阶段存在于SSLD后而非SSL时,这有待于大样本纵向研究证实,但纵向研究本身存在延迟SSL临床处理的伦理问题。关于SSL完整切除后内镜监测间隔问题各指南建议不一(表1)[12,27],且多数监测间隔指南都属于低水平证据,有待大样本随访资料提供高质量证据。
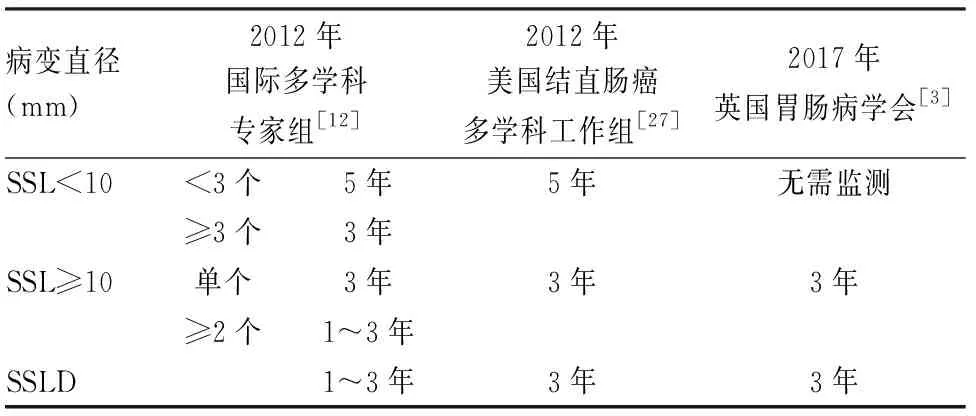
表1 结直肠广基锯齿状病变完整切除后内镜监测间隔

