层出镰孢菌连续移植菌株生物学特性及遗传多样性研究
畅引东,谭再钧,董海龙,任文勇,李新凤,王建明*
(1.山西农业大学 植物保护学院,山西 太谷 030801;2.吉林省延边州和龙市农业农村局,吉林 和龙 133500)
层出镰孢菌(Fusariumproliferatum)是一种重要的植物病原真菌,可侵染玉米引起茎基腐、穗腐和鞘腐等多种病害[1]。真菌由于个体小、繁殖快等原因,极容易发生遗传变异[2]。这使得原先致病力极强的野生真菌菌株在实验室条件下扩繁多次后,往往会出现致病力减弱或完全丧失的退化现象。真菌致病力丧失问题给试验研究的正常开展造成了许多不利的影响。因此,明确连续移植对菌株遗传变异的影响对今后如何避免此类问题有积极的指导意义。
真菌的遗传变异与其特有的生殖方式有关。真菌可通过无性繁殖进行大量的扩繁,而有性生殖或某些真菌特有的准性生殖赋予其对环境强大的适应能力[3]。长期以来正是这种能力使其在生长环境改变、病毒侵染等外界因素影响下基因发生了重组或抑制了某些基因的表达,使细胞内酶合成能力下降,导致菌株退化变异[1~4]。目前,对植物病原真菌在实验室条件下菌株退化方面的研究较少,多数研究是针对用于生防的虫生真菌和大型食用真菌的菌种退化问题。而这些研究大多是针对继代培养或连续移植对菌株的生长性状及致病力变化的影响等,并没有对菌株生长性状或致病力发生改变的原因做出进一步解释[4-8]。
有关真菌生物学特性和致病性的变异研究,大多集中在菌株因长期环境条件改变对其表型变化的影响方面,但有关其与相关分子水平上的相互联系的研究报道较少。有研究表明尖孢镰孢菌西瓜专化型菌株经连续移植多次后出现的菌落角变与DNA甲基化有关[9]。菌株的退化变异是否与其遗传分化有关,尚未有报道。ISSR分子标记技术被广泛应用于真菌的遗传分化研究,其反映出的遗传多态性与菌株致病力分化、培养性状等有一定的相关性[10,11]。因此,本试验研究了层出镰孢菌连续移植菌株的生物学特性与ISSR遗传多样性变化的相互关系,以期阐释连续移植对该菌株的影响,为进一步揭示镰孢菌的致病分子机理提供科学依据。
1 材料与方法
1.1 供试材料
供试菌株为从玉米茎基腐病严重发生的罹病植株上分离鉴定的层出镰孢菌致病菌株[12,13]。
1.2 菌株连续移植
对采用稀释法获得的单孢分离菌株进行移植。每间隔4 d挑取菌落边缘菌丝移植,置于人工气候箱中25 ℃恒温培养,共移植20代次,获得的菌株生长4 d后储存于4 ℃菌种保藏箱[12]。
1.3 连续移植菌株生物学特性的研究
1.3.1 连续移植菌株菌落形态的观测 选取第1、5、10、15、20次移植的层出镰孢菌菌株,转接于PDA培养基。每个菌株设3次重复,置于25 ℃恒温培养箱中。在接种后的第2~7天以十字划线法测量PDA培养基上菌落直径,测算菌株的菌丝生长速率,并使用SPSS软件进行不同次移植菌株间菌丝生长速率的差异显著性分析[12]。选取第1、10、20次移植的菌株,在培养4 d、7 d、30 d后,分别对其菌落形态进行记录并拍照。
1.3.2 连续移植菌株显微形态的观察 选取第1、10、20次移植的菌株,分别在培养4 d、7 d和30 d后,在显微镜下观察菌株小型分生孢子、大型分生孢子、厚垣孢子、产孢梗和分生孢子座的数量、大小和形状等,记录并拍照[13]。
1.3.3 连续移植菌株产孢量的测定 选取第1、10、20次移植的菌株,转接于绿豆汤培养液中,放置于摇床中培养4 d,温度设置为25 ℃,转速设置为150 r/min。在第5天,用血球计数板进行孢子量的测定,每个菌株测定3次,取平均值,并使用SPSS软件进行不同次移植菌株间孢子量的差异显著性分析。
1.4 连续移植菌株致病力的测定
选用经前期试验鉴定的玉米感病品种为寄主,将其种子浸入含2%有效氯的次氯酸钠消毒液中,在摇床中以150 r/min振荡消毒15 min,用无菌水清洗3~5次后,再在55 ℃无菌水中浸种10 h。然后将玉米种子置于25 ℃的恒温培养箱中进行催芽。待玉米种子长出约1.5 cm根或0.5 cm芽后进行菌株接种。
选取发芽一致的玉米种子,分别浸入层出镰孢菌第1、10和20次移植菌株的106个/mL孢子悬浮液中,15 min后将其播种于装有无菌土的塑料箱(长35 cm,宽25 cm,深15 cm)中,每箱播种15粒种子,覆盖无菌土厚度2~3 cm,以无菌水浸种为空白对照[14]。将培养塑料箱放入光照恒温培养箱中培养,白天温度设为25 ℃,光照12 h,光照强度为12000 lx;夜间温度设为15 ℃,时长为6 h。在播种30 d后,按照玉米茎基腐病病情指数进行病情调查[15]。
1.5 连续移植菌株遗传多样性的研究
选取层出镰孢菌第1~5、第8~12和第16~20次移植的菌株,采用改良的CTAB法[16]进行基因组DNA的提取。选用何婧等[17]筛选的3个ISSR引物812、831和888,并参考其PCR扩增程序及PCR反应体系,分别进行PCR扩增。采用2%琼脂糖凝胶电泳对PCR产物进行检测,并用凝胶成像分析系统拍照记录。将PCR扩增的DNA条带转换成二进制数据,有带的记为1,无带的记为0,统计成0/1矩阵。利用NTSYSpc (Version 2.10e)软件进行聚类分析并构建系统聚类图[18]。
2 结果与分析
2.1 连续移植菌株的生物学特性
2.1.1 连续移植菌株的菌落形态 层出镰孢菌第1、10、20次移植菌株在PDA培养基中生长4 d、7 d和30 d后的菌落形态见图1。从图1中可以看出,层出镰孢菌第1代菌株与第10代、第20代菌株在菌落形态和菌落颜色上无明显差异,最初几天菌落颜色为白色,随着培养时间的延长会在菌落中心产生淡紫色菌丝;该菌株第1代与第10代、第20代菌株在基物颜色上略有差异,第1代菌株的基物颜色随着培养时间的延长而逐渐变深,在第30天时产生深蓝色菌核,而第10代和第20代菌株在各培养时期的基物颜色相对于第1代菌株而言较淡,未形成深蓝色菌核。
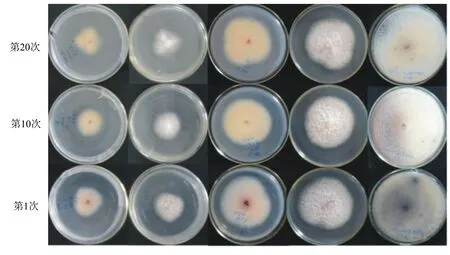
图1 层出镰孢菌连续移植菌株的菌落形态
层出镰孢菌连续移植菌株在PDA培养基中培养4 d时的菌落直径及菌丝生长速率见表1。从表1可知,层出镰孢菌连续移植菌株的菌落直径和菌丝生长速率随移植次数的增加呈下降趋势。
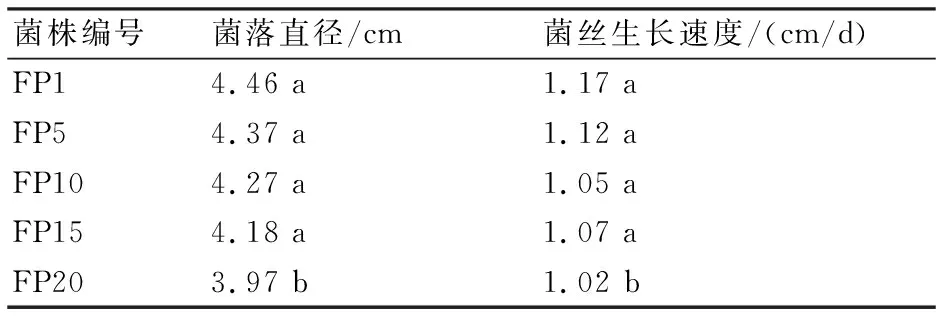
表1 层出镰孢菌的菌落直径及菌丝生长速率
2.1.2 连续移植菌株的显微形态 层出镰孢菌不同次移植菌株的显微形态观察结果如表2和图2所示。结果表明:层出镰孢菌第1、10、20次移植菌株在分生孢子和产孢梗的数量和显微形态等方面没有明显的差异。层出镰孢菌不同次移植菌株在PDA培养基培养4 d后,未能发现大孢子、产孢梗和厚垣孢子;在培养7 d后的部分菌株中发现了大小孢子及厚垣孢子;在培养30 d后可大量发现大小孢子、产孢梗、厚垣孢子,分生孢子座也有发现(表2)。从图2中可以看出,层出镰孢菌不同次移植菌株的大小分生孢子、产孢结构、厚垣孢子及分生孢子座的形态、大小等未见明显差异。

a:小孢子;b:大孢子;c:分生孢子座和大孢子;d:产孢梗;e:假头状;1、10、20指移植次数。图2 层出镰孢菌不同代连续移植菌株的显微形态
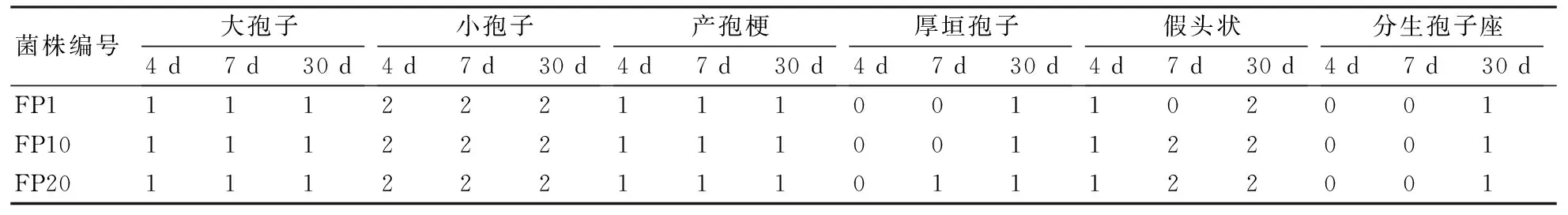
表2 层出镰孢菌不同代连续移植菌株在不同培养时期的显微形态统计结果
2.1.3 连续移植菌株的产孢量 层出镰孢菌不同次移植菌株在绿豆汤培养液中培养4 d后的孢子产量详见表3。从表3中可知,层出镰孢菌连续移植菌株的产孢量随着移植次数的增加呈明显的下降趋势,由第1代的322400000个/mL下降到第20代的198400000个/mL。

表3 层出镰孢菌不同代连续移植菌株的产孢量
2.2 连续移植菌株的致病力
连续移植层出镰孢菌菌株对玉米幼苗的致病力结果详见表4和图3。从表4可以看出,经连续移植的菌株虽然均能导致玉米苗期发病,但不同次移植菌株对幼苗的致病力呈递减趋势,其中第1次移植层出镰孢菌的致病力最强,接菌后幼苗的病情指数达41.0;第20次移植菌株接菌后幼苗的病情指数只有36.6。从图3玉米幼苗的长势可见:接种层出镰孢菌的玉米幼苗在长势和出苗率上略低于空白对照CK,发病较轻;接种第1代层出镰孢菌的玉米幼苗相对于接种其它代菌株的幼苗而言较稀疏和矮小。
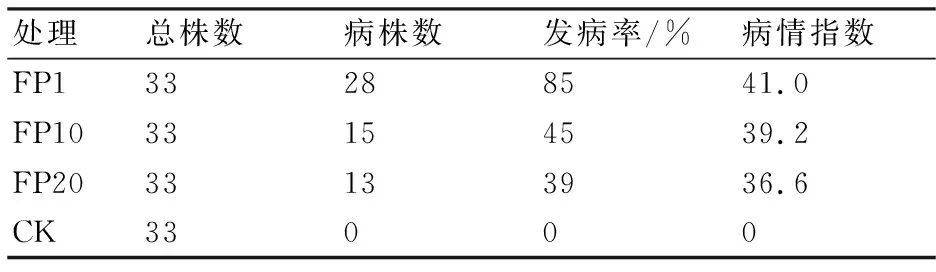
表4 不同代连续移植菌株的致病力

图3 连续移植菌株处理后玉米幼苗的长势
2.3 连续移植菌株的遗传多样性
选取的15个层出镰孢菌不同次移植菌株的遗传相似性系数和聚类图分别见图4和表5。从图4可以看出,在层出镰孢菌连续移植菌株间基因组DNA在简单重复序列间区的遗传分化明显,菌株间存在丰富的遗传多样性。但是结合表5和图4,分别从第1~5、8~12和16~20次连续移植菌株来看,可发现移植次数相邻菌株间的遗传距离相近,例如:表5中4代次菌株与5代次间、10代次与11代次间、16代次与17代次间的遗传相似性系数在各自菌株范围内较高,分别为1、1和0.93。从图4中也可观察到部分移植次数相邻菌株被划归为一个类群,例如,2代次与3代次、4代次与5代次、10代次与11代次、11代次与12代次、16代次与17代次菌株。由此可知不同菌株在遗传分化时移植次数相近菌株间的遗传分化力度较小。在遗传分化过程中,除少数菌株如1代次和9代次菌株外,大多数移植次数相差大的菌株间遗传相似性系数较低(表5)。
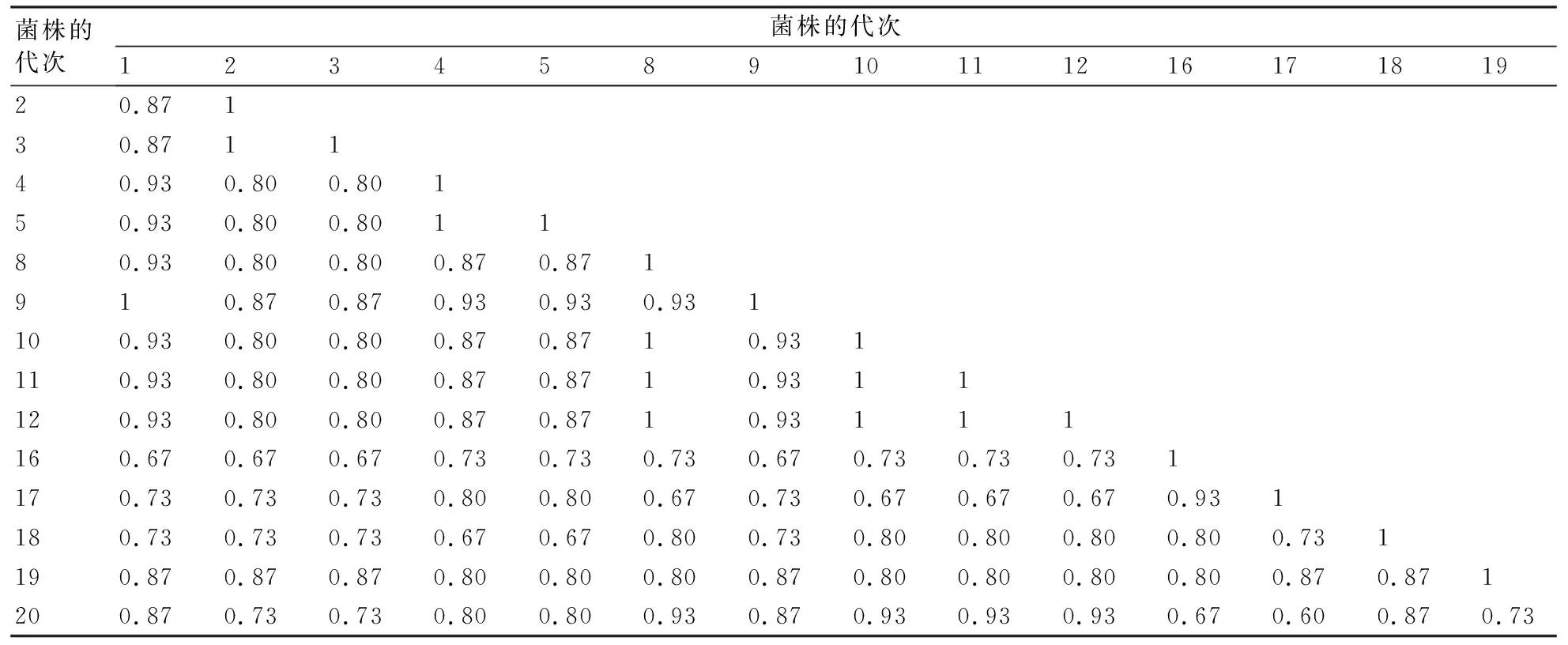
表5 层出镰孢菌继代培养菌株不同代次间的遗传相似性系数
3 结论与讨论
本试验对层出镰孢菌不同移植次数菌株的菌落形态、显微形态和致病性等生物学特性,以及ISSR遗传多样性等方面进行了研究。结果表明:经连续移植的层出镰孢菌菌株的菌落形态无明显差异,培养基基物颜色随着移植次数增多而逐渐变淡,菌株的产孢量、致病力和菌丝生长速率随着培养次数增多而下降;层出镰孢菌不同次移植菌株间遗传分化明显,但在移植次数相近菌株间的遗传分化力度较小;但是ISSR分子标记所反映出的菌株间遗传分化与菌株间表现出的生物学特性无明显的相关性。综合来看,随着连续移植次数的增加,层出镰孢菌的扩繁力和致病力均下降,出现了明显的退化现象。
对菌株菌落形态、显微形态和产孢量的测定可以从宏观上明确菌株的生长情况,从而进一步了解不同代次菌株间的生长变异情况。对菌株致病力的测定可以从另一个方面反映出菌株的生物学性状。刘海英等对玉米大斑病菌继代培养菌株的研究表明,随着转接次数的增加,菌株的菌丝生长速度、产孢量、分生孢子大小及致病性均呈显著下降趋势[5]。诸多研究发现,许多经连续移植或继代培养菌株的产孢量均会出现明显的下降趋势[5,8,19,20]。菌株的这些生物学性状是由基因调控的。那些在形态和致病性上有差异的菌株间,其差异是否由基因上的差异造成的?这需要从分子生物学的角度做多层次的研究。本试验采用ISSR遗传多样性研究方法探索了层出镰孢菌菌株退化的原因,结果表明该病原菌不同次移植菌株间具有明显的遗传分化,但是基于ISSR-PCR结果所反映出的菌株间遗传分化与本试验中所测定的菌株生物学指标无明显的相关性,无法据此对菌株各生物学指标差异与特定基因的关联性做进一步的研究。秦敏等通过RAPD分子标记对不同致病力稻瘟病菌继代培养菌株的遗传稳定性进行了研究,结果发现强致病菌继代培养菌株的致病性变异大,其DNA的遗传变异也较大,而弱致病菌继代培养菌株的致病性和DNA遗传变异均较小[6]。有些研究表明基于ISSR分子标记的镰孢菌遗传分化与菌株致病性有一定的相关性[10,21~23],但在本研究中未能反映出这种相关性,我们在对连续移植禾谷镰孢菌进行ISSR遗传多样性研究时也得到了相似的结果[14]。研究人员对在棉花和水琼脂培养基中连续移植的尖孢镰孢菌萎蔫专化型的致病力和遗传分化进行研究时发现AFLP分子标记所反映出的遗传分化与菌株致病力的增加无明显的相关性[24]。一般来说,病原真菌在经历有性生殖或准性生殖之后,其遗传特性会因生长环境变化而产生变异,而真菌的无性生殖是为了在短期内大量扩繁,其遗传变异较少。由此可见经过连续移植的菌株仅仅是发生退化,其产生变异的可能性较低,而与菌株退化相关的DNA遗传差异还有待于进一步的研究。

