LSCM880 with Airyscan和转盘共聚焦成像特点及应用比较研究
李红娟 宋鑫宏 程建青 冯磊
摘 要:近年来,激光共聚焦显微成像技术发展迅速,新技术在提高分辨率、扫描速度、降低光毒性、活体观察、大视野图像拼接和三维重建等方面提升和扩展了其应用功能。新技术带来更多医学相关领域的应用潜力,本研究梳理了所管理的两台大型精密仪器设备蔡司超高分辨率共聚焦显微镜(Laser Scanning Confocal Microscope with Airyscan, LSCM880 with Airyscan)和安道尔转盘共聚焦显微镜(Andor Spinning-Disk Confocal Microscopy,SDCM)在成像原理、配置參数、成像特点及应用领域等方面的不同,使研究人员熟悉和了解两台共聚焦显微镜的应用特点,获得更多的实验方法及思路,更加直观准确的展示实验结果。
关键词:激光理论;蔡司超高分辨率共聚焦;安道尔转盘共聚焦;显微成像技术
中图分类号:TH742 文献标志码:A 文章编号:2095-2945(2020)32-0008-04
Abstract: The laser confocal microscopy has been developing rapidly over the past few years. The new technology enhances and expands its application functions in the field of improved resolution, scanning speed, reduced phototoxicity, in vivo observation, large-field image stitching and 3D reconstruction, thus bringing more potential in medical-rated fields. This study summarized the differences of imaging principles, configuration parameters, imaging characteristics and application fields between Zeiss Laser Scanning Confocal Microscope with Airyscan (LSCM880 with Airyscan) and Andor Spinning-Disk Confocal Microscopy (SDCM). We aim to provide comprehensive information of the two instruments to researchers, allowing them to acquire more experimental methods and ideas, with more intuitive and accurate display of experimental data.
Keywords: laser theory; Zeiss LSCM880 with Airyscan; spinning-disk confocal microscopy; microscopic imaging technology
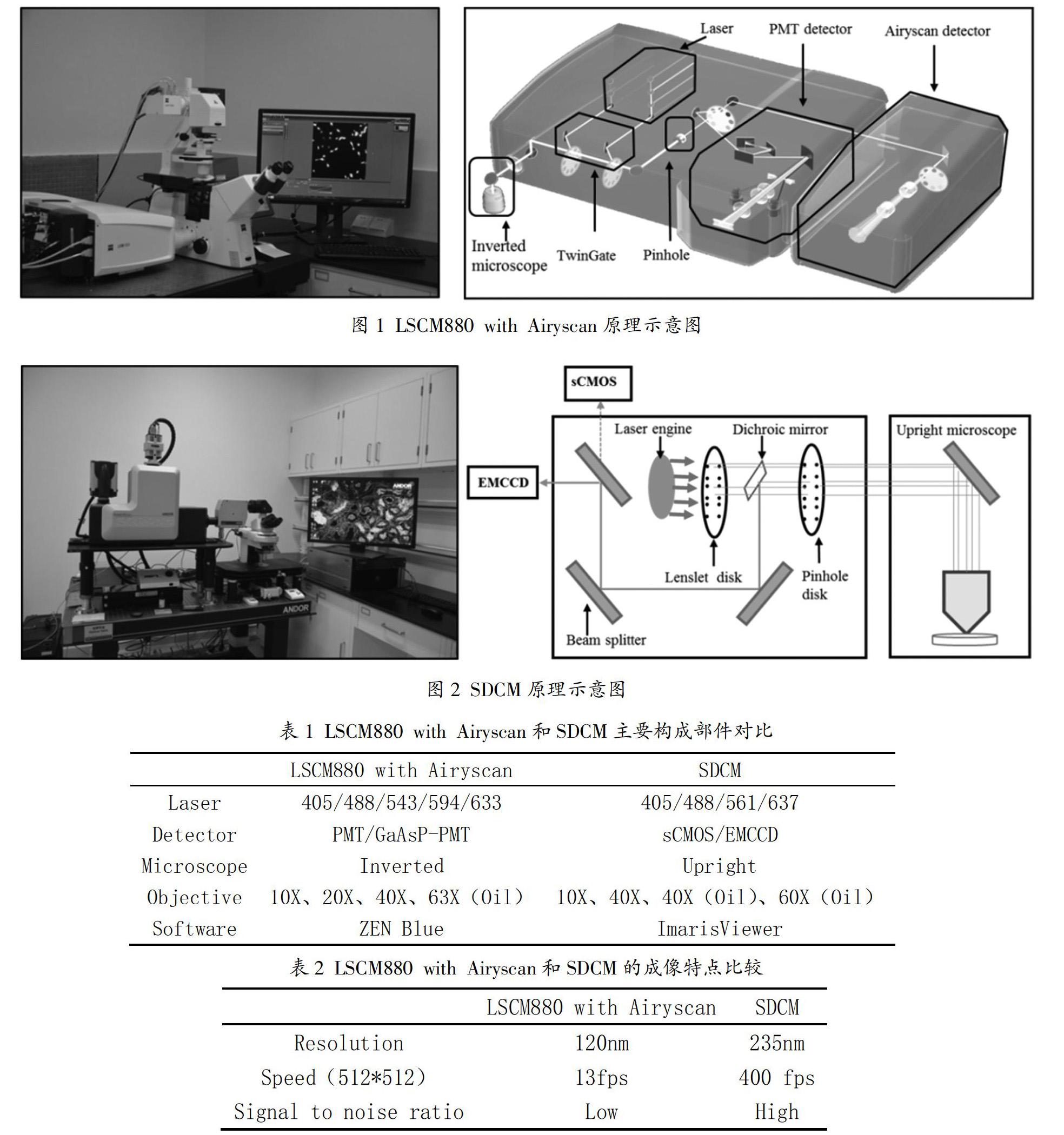
LSCM880 with Airyscan是卡尔蔡司显微镜部研发的一款配备Airyscan超高分辨率检测器模块的激光共聚焦显微镜[1],使常规超分辨率显微镜与共聚焦荧光成像的优势相结合,从而使X、Y和Z的空间分辨率提高,为细胞内蛋白质定位、细胞器动力学和蛋白质功能等方面研究提供了新的解决方法[2-4]。LSCM880 with Airyscan可以广泛应用在植物学[5]、基础医学[6]、生物工程学[7]和细胞生物学[8]等领域,适用于细胞爬片、组织切片、活细胞动态观察[9]等,能够实现多色荧光通道、Tile、Z-stake和Time等功能研究[10,11]。Joseph Huff等[12-14]介绍了LSCM880 with Airyscan的超分辨功能,重点介绍了Airyscan成像原理与优势。王娟娟等[15,16]介绍了LSCM880的Position功能使用技巧以及温度对LSCM880成像效果的影响。SDCM是英国安道尔公司研发的一款利用双转盘系统进行快速成像的共聚焦显微镜,适用于活细胞或组织内相关信号分子如Ca2+动态检测[17,18],本文作者侧重结合自己的管理经验,对两台共聚焦显微镜的成像特点及应用研究进行比较,供科研人员和同行管理人员借鉴。
1 共聚焦成像原理及配置参数
1.1 成像原理
LSCM880 with Airyscan成像原理与蔡司LSCM880等一系列共聚焦成像原理相似,是在传统荧光显微镜的基础上,利用激光束作为光源对荧光样品进行激发,利用针孔来排除非焦平面信号进入探测器,之后经过一系列光电成像部件进行信息采集和信号放大,最后经过信号处理输出到计算机上得到整个图像[19]。LSCM880 with Airyscan的检测器并非传统的物理针孔和单一阵列组成的检测器PMT光电倍增管,而是利用32个通道的高灵敏度磷砷化镓GaAsP-PMT检测器来进行平面图像检测,相当于拥有32个检测器元件,每个小的检测器原件都相当于一个小针孔,从而可以提供具有1 AU针孔的传统共聚焦无法获得的高空间频率信息的对比度[13],与传统共聚焦相比,分辨率可以提高约1.7倍,具体原理示意图如图1。
SDCM是采用双转盘共聚焦系统,包括微透镜转盘和针孔转盘,针孔转盘上有大量螺旋排列同等大小的针孔,当光线穿过微透镜转盘后会形成一定数量的微光束,这些微光束通过针孔转盘照射到样品上会同步激发同等数量的光信号,这些信号会沿着显微镜光路返回,当他们通过管镜再次穿过小孔就会实现共聚焦过滤,所得到的焦平面信号通过两个转盘之间的二向色镜转移到EMCCD或者sCMOS上进行成像[20],具体原理示意图如图2。
1.2 配置参数
LSCM880 with Airyscan和SDCM基本构成部件相似,主要由激光器、扫描头、显微镜、光学系统和计算机系统等构成,两台共聚焦主要构成部件对比如表1。
2 共聚焦成像特点及应用领域
2.1 成像特点
LSCM880 with Airyscan和SDCM的基本应用功能相似,两者都可以进行单色、多色荧光通道拍摄,时间序列观察、三维层扫等功能拍摄。但是根据两台仪器设备的配置参数,成像特点略有差异,本研究主要从分辨率、成像速度和信噪比三个方面进行比较,具体成像特点如表2。
2.1.1 分辨率
LSCM880 with Airyscan的xy分辨率可以达到120nm,其原因在于理论上最大分辨率的图像获得需要调整针孔大小为0.2AU,而针孔的减小使图像的信号减弱,Airyscan检测系统中32个蜂窝式针孔的组合可以使小针孔高分辨率成像与大针孔高信噪比采集效率相结合,而SDCM使用高速高分辨率的sCMOS相机,可以使XY方向分辨率达到235nm,但无法达到与LSCM880 with Airyscan相同的分辨率。
2.1.2 成像速度
SDCM探测器配有高速高分辨率sCMOS相机,转盘的转速可以达到6000rpm,使SDCM具有高速成像的特点,在样本荧光较强,曝光时间为2.5ms时,通过多点同步快速扫描的方式其成像速度最高可达400fps(512*512), 大大提高扫描效率,节省扫描时间,降低光毒性,而LSCM880 with Airyscan通过点扫描的方式,成像速度只能达到13fps(512*512)。
2.1.3 信噪比
SDCM探测器配有高灵敏度EMCCD相机,因其具有信号放大EM功能,且量子效率QE值达到了95%,LSCM880 with Airyscan这种点扫描共聚焦QE值在45%左右,所以在样本荧光较弱时,使用SDCM的EMCCD相机更具有优势,具有更好的信噪比。
2.2 应用领域
除了基本的成像之外,LSCM880 with Airyscan还可以进行Tile大视野拼图,荧光共振能量转移等相关研究。根据两台仪器设备的应用特点,其在不同的科学实验及研究领域中发挥独特的作用,如L. Scipioni等[2]利用Airyscan检测系统的超高分辨率特点对稳定表达EGFP的NIH-3T3细胞隔室进行全面动态分析。Xiu-Tang Cheng等[4]利用Airyscan的超高分辨率特点,探讨了神经系统中细胞溶酶体的标志物-溶酶体相关膜蛋白1(LAMP1),并全面分析了LAMP1在神经元溶酶体细胞器中的分布,解释了在病理和生理条件下LAMP1的运输分布与溶酶体降解的相关性。Jing Shao等[21]利用LSCM880 with Airyscan的Time时间序列模式检测了姜黄素对细胞内Ca2+浓度的影响。相比之下,SDCM的应用范围相对小一些,但是由于它采用灵敏度极高的EMCCD做探测器,在极低的激光照射强度下即可采集到高品质图像,降低了系统的光漂白和光毒性,同时配有高速成像的sCMOS,使其在短暂的电生理过程(如钙火花)、3D细胞内荧光蛋白动力学、活细胞分子相互作用、活体模式生物观察(斑马鱼、小鼠等)相关领域有相对优势。如Swapnil K等[22]利用SDCM检测小鼠血管内皮细胞中的钙火花,验证了通过调节TRPV4参与介导的钙内流可以调节血管舒张等功能特点,Yvonne NTalini等[18]利用SDCM成功验证了GCaMP2小鼠血管內皮细胞中的钙波。
3 共聚焦维护管理
3.1 实验室日常维护
激光共聚焦显微镜属于大型精密仪器设备,正确的维护清洁和保养能有效延长设备使用寿命,也可以使设备处于最佳工作状态。LSCM880 with Airyscan和SDCM分别位于江南大学医学院大楼两个单独避光无窗的实验室,管理员每天早晚各巡查一次,保证室内空调、除湿机等正常运作,保证温度控制在22±2℃,湿度40~60%;检查基本物资如镜油、棉签、擦镜纸、光盘和无水乙醇等耗材的正常供应;检查两台精密仪器的使用登记情况;每周定期打扫实验室卫生,对实验台面和地面等进行清理;由于激光共聚焦显微镜对房间洁净度要求比较高,所以要求实验人员进入前均需要穿戴一次性鞋套,保证实验室的洁净度。
3.2 仪器软硬件日常维护
管理员除了保证洁净的实验室工作环境,还需要对两台显微镜软硬件进行日常维护保养,保养内容包括:每周用无水乙醇逐一对实验物镜、目镜、载物台等进行清洁;每周独自操作一遍设备,检查仪器操作参数的设置是否正常,保证UPS稳压器、防震台和电动载物台等正常工作;检查实验数据按照规定的CZI格式和文件名称存储到指定路径,并要求实验人员用光盘进行数据刻录,严禁使用U盘拷贝数据,定期对实验数据进行备份后清理,保证电脑运行速度。
3.3 仪器日常预约管理
两台仪器设备均属于江南大学固定资产,对医学院、江南大学附属医院、校内其他学院及校外合作单位提供全面开放共享机制。使用人员可以在E江南大仪系统上进行仪器培训申请和使用预约,管理员每月组织一次仪器使用培训考核并开通使用权限,仪器设置了电脑控制端口,使用时需登录账号密码,后台会自动记录仪器使用具体时间并进行相应扣费。
4 结束语
LSCM880 with Airyscan和SDCM能基本满足医学、生物工程学及食品科学等学科涉及到显微成像的科学研究,已参与相关研究课题发表在National Science Review(IF:13.22)等权威杂志期刊上。在实际操作过程中两台仪器设备还存在一些不足,比如两台设备均没有配备活细胞工作站,这就在超长时间观察活细胞动态分析实验时有所局限;由于可见光的穿透能力有限,单光子扫描深度无法满足较厚样本的成像;高强度激光的漂白和毒性导致一些细胞器如活细胞线粒体等产生形态改变、荧光淬灭等情况,无法稳定对活细胞中线粒体、内质网等亚细胞器进行深入动态研究;SDCM仪器操作相对复杂,参数设置较多,实验人员在选择上仍然会优先考虑LSCM880 with Airyscan。虽然两台设备的分辨率已经远超普通的荧光显微镜,但在细胞微观结构研究领域仍然存在局限性,随着成像技术的不断更新完善,已经逐步有一些新的方法或技术如:蔡司新一代激光片层扫描显微系统Lightsheet7,蔡司Elyra 7 with Lattice SIM技术等被应用于共聚焦显微镜,以满足对大体积样品任意深度范围内感兴趣的区域进行高效快速分析的要求,为亚细胞结构、细菌、神经元或活细胞内信号分子动态分析等提供更多研究可能。
[14]Huff J. The Fast mode for ZEISS LSM 880 with Airyscan: high-speed confocal imaging with super-resolution and improved signal-to-noise ratio[J]. Nature Methods, 2016,13(11):1548-7105.
[15]王娟娟,魏學红.激光共聚焦显微镜的Position功能使用技巧[J].中国激光医学杂志,2019,28(3):169-172.
[16]王娟娟,魏学红.温度对激光扫描共聚焦成像效果的影响[J].影像科学与光化学,2018,36(5):443-452.
[17]张彦丽,代亚丽,陈亚兰,等.利用转盘共聚焦显微镜进行快速实验的新方法[J].现代生物医学进展,2019,19(19):3784.
[18]Tallini Y N, Brekke J F, Shui B, et al. Propagated endothelial Ca2+ waves and arteriolar dilation in vivo: measurements in Cx40BAC GCaMP2 transgenic mice [J]. Circulation Research, 2007,101(12):1300-1309.
[19]黄体冉,马兰青,刘续航,等.激光扫描共聚焦显微镜在生物医学中发展与应用[J].科教文汇,2017,7:184-186.
[20]Oreopoulos J, Berman R, Browne M. Spinning-disk confocal microscopy: present technology and future trends [J]. Methods in Cell Biology, 2014,123:153-175.
[21]Shao J, Han J, Zhu Y, et al. Curcumin Induces Endothelium-Dependent Relaxation by Activating Endothelial TRPV4 Channels[J]. Journal Of Cardiovascular Translational Research, 2019,12(6):600-607.
[22]Sonkusare S K, Bonev A D, Ledoux J, et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function [J]. Science, 2012,336(6081):597-601.

