小鼠正畸牙移动中牙周组织自噬相关基因表达的初步研究
尹圆圆 马华钰 李昕怡 徐静晨 柳汀 陈嵩 何姝姝
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院正畸科 成都 610041
正畸力加载至牙齿后,牙周膜与牙槽骨受到机械应力产生应变,通过一系列复杂的分子信号转导通路及其调控网络,将正畸力学信号转换为细胞内以及细胞之间的生物化学信号,从而产生细胞反应引起牙槽骨的沉积与吸收,即牙槽骨塑建,使压力侧牙槽骨吸收而张力侧牙槽骨沉积,最终牙齿得以在牙槽骨中移动[1-2]。正畸牙移动骨塑建的机械力信号转导通路及其调控机制是正畸生物力学和生物学研究的热点。
自噬是一种细胞内基本的降解机制,通过溶酶体功能将细胞内病原体和受损细胞器等进行降解和再循环[3],其参与了细胞对环境或内部刺激的应答,在细胞正常生理活动(如调节细胞新陈代谢、生长、分化等)及许多疾病(如炎症、神经退行性疾病、癌症等)中均有重要作用[3-4]。近期研究[5-6]表明,自噬与骨稳态密切相关,参与调控破骨细胞、成骨细胞、骨细胞等骨相关细胞的代谢,可能预示着骨稳态紊乱相关疾病形成的新机制。然而,目前自噬在正畸牙移动骨塑建中的作用尚未得到充分阐明。本研究旨在通过建立小鼠正畸牙移动模型,观察牙周组织中骨塑建和自噬相关基因水平的变化,为进一步探讨自噬对正畸牙移动骨塑建的影响提供理论及实验基础。
1 材料和方法
1.1 材料
1.1.1 实验动物及分组 11周龄健康雄性C57B/6小鼠30只,体重约30 g,由四川大学实验动物中心提供。实验通过四川大学伦理委员会审查(批号:WCHSIRB-D-2016-165),于口腔疾病研究国家重点实验室完成实验。30只小鼠随机分为3组。
分组及对应处置措施如下:A组加力组,10只小鼠,安放拉簧并施加矫治力;B组无力拉簧组,10只小鼠,安放拉簧但不加载力;C组全空白组,10只小鼠,无任何处置。
1.1.2 主要材料及仪器设备 0.12 mm镍钛螺旋拉簧(成都铭兴弹簧有限公司,中国),0.2 mm结扎丝,Quantum FX μCT仪器(Perkin Elmer公司,美国),抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)试剂盒(Sigma公司,美国),显微摄像系统(Olympus公司,日本),Image-pro plus 6.0图像分析系统软件(Media Cybernetics公司,美国),AQ131-01实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)试剂盒、Trizol、RNA溶解液(北京全式金生物科技有限公司,中国),骨保护因子(osteoprotegerin,OPG)、破骨细胞核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)、自噬相关基因(包括Atg5、Atg7、Beclin-1)PCR引物合成(上海生工生物工程有限公司,中国)。
1.2 方法
1.2.1 建立牙移动动物模型 小鼠经腹腔注射10%水合氯醛麻醉,剂量为3.0 mL·kg-1。注药后将小鼠置于22~25 ℃恒定环境中保持仰卧状态,口内放入自制开口器确保术野清晰。将定制的0.04 N螺旋拉簧拉伸至产生0.04 N力的长度,两端用结扎丝分别结扎于左侧上颌第一磨牙及左侧上颌中切牙处。在切牙结扎丝处用光固化流动树脂固定以增强固位(图1)。加力11 d,每天检查矫治器是否有脱落损坏并及时修复。所有小鼠在初戴装置3 d内辅以软食,之后自由摄食。
1.2.2 标本制备 于加力第12 d采用注射过量水合氯醛的方式处死小鼠。常规解剖获取上颌骨标本,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗后放入包埋框并编号。将标本放入4%多聚甲醛溶液中固定24 h,固定后分别进行微计算机断层扫描技术(microcomputed tomography,MicroCT)和RT-qPCR检测。

图1 建立小鼠牙移动模型Fig 1 Establishment of the tooth movement model
1.2.3 MicroCT检测 每组选取3个样本固定后进行MicroCT扫描,分别获取横截面和纵截面图像。设置仪器相应的扫描参数(XRay kV:90 kV,XRay μA:90 μA,FOV:7.68 mm,Pixel Size:15 μm)。通过文献[7]回顾,将第一磨牙远中外形最凸点和第二磨牙近中外形最凸点之间的距离记录为第一磨牙牙移动距离,计算出每组均值。
1.2.4 石蜡切片制备 标本进行常规固定、脱钙、脱水、浸蜡、包埋处理,将蜡块标本沿磨牙牙体长轴进行近远中向连续切片,每张厚约4 μm,进行常规苏木精-伊红(hematoxylin and eosin,HE)染色和TRAP染色。
1.2.5 HE染色 每个样本随机选取1张切片按照常规步骤进行HE染色,观察左侧上颌第一磨牙牙根近远中侧根中1/3牙周组织形态学变化。
1.2.6 TRAP染色 每个样本随机选取切片2张,按TRAP试剂盒说明进行操作。分别在左侧上颌第一磨牙远中根近远中侧的根中1/3区域随机选取2个视野观察破骨细胞。
1.2.7 RT-qPCR检测 取材后在每1 mL冷Lysis Buffer加入5 μL磷酸酶抑制剂、1 μL蛋白酶抑制剂和5 μL苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)混匀。冰上保存数分钟待用。每100 mg固体组织置于培养皿中,手术剪剪碎成3 mm×3 mm左右的小块,提取总RNA,逆转录合成互补DNA(complementary DNA,cDNA)。再使用试剂盒进行扩增,反应程序为:95 ℃,3 min;95 ℃ 30 s,55 ℃ 20 s,72 ℃ 20 s,40个循环;95 ℃ 15 s,60 ℃ 15 s,20 min升温,95 ℃ 15 s。引物序列如表1。采用2-ΔΔCT法对结果进行分析。

表1 小鼠PCR相关引物序列Tab 1 Primers for PCR analysis of mice
1.3 统计学分析
牙根近远中侧破骨细胞计数和qPCR数据采用软件GraphPad Prism 8.0进行统计分析。组内对比采用配对t检验;组间对比采用单因素方差分析(one-way analysis of variance,ANOVA);两两组间对比采用SNK(Student-Newman-Keuls)法,以P<0.05表示差异具有统计学意义。
2 结果
2.1 动物模型建立结果
建立小鼠牙移动模型后小鼠健康状况良好。上颌左侧第一磨牙加力后,辅软质饲料喂养以确保实验小鼠度过适应期,加力组初戴装置2 d内体重略有降低,随后正常饲养自由进食恢复常规水平。A组实验组小鼠加力过程中死亡1只,B、C组小鼠实验过程中无死亡,最终分别获得9、10、10个动物标本。
2.2 MicroCT结果
MicroCT检测结果如图2所示,磨牙移动距离平均值:A组0.09 mm,B组0 mm,C组0 mm。其中A组与B、C组组间比较差异有统计学意义(P<0.05)。
2.3 HE染色观察结果
各组牙周膜组织HE染色结果(图3)示,B、C两组牙根张力侧与压力侧的牙周膜间隙均等,牙根两侧细胞无明显差异;A组牙根张力侧与压力侧的牙周膜间隙不均等,牙根两侧细胞有差异,压力侧细胞受到挤压,张力侧细胞受到拉伸。

图2 MicroCT检测第一磨牙移动情况 × 400Fig 2 MicroCT images of the first molars × 400
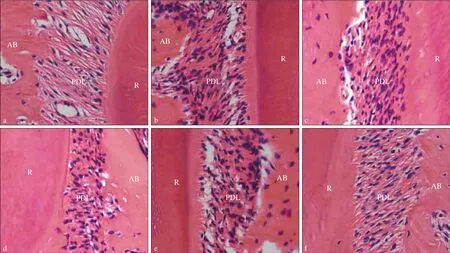
图3 第一磨牙张压力侧牙周膜组织形态观察 HE染色 × 200Fig 3 Morphology of periodontal tissues of the first molars HE staining × 200
2.4 TRAP染色结果
TRAP染色观察结果如图4所示,其中破骨细胞呈酒红色阳性颗粒。B、C组中未见到TRAP染色阳性细胞,A组第一磨牙牙根近中侧见到阳性破骨细胞。如图5所示,A组组内压力侧破骨细胞均数大于张力侧,组内比较差异有统计学意义(P<0.05);B、C组组内近远中侧无明显差异,组内比较差异无统计学意义(P>0.05)。
2.5 PCR结果
如图6所示,A组牙周组织OPG mRNA表达显著降低,RANKL、Atg5、Atg7及Beclin-1 mRNA表达显著增加,差异有统计学意义(P<0.05)。B、C组牙周组织OPG、RANKL、Atg5、Atg7及Beclin-1 mRNA表达无明显差异(P>0.05)。

图4 第一磨牙张压力侧破骨细胞观察 TRAP染色 × 200Fig 4 Osteoclasts observation of the first molars TRAP staining × 200

图5 第一磨牙张压力侧TRAP染色阳性破骨细胞计数Fig 5 TRAP-positive osteoclasts number of the first molars
3 讨论
本研究利用C57B/6近交系小鼠正畸牙移动模型,发现牙移动过程中RANKL及自噬相关基因Atg5、Atg7及Beclin-1 mRNA的表达增加,OPG mRNA的表达降低,这就提示自噬可能是通过影响破骨水平,从而参与了正畸牙移动的骨塑建过程。
正畸牙移动受到牙移动类型、加力力值和加力时间的影响,因此建立科学精确的牙移动模型是进行正畸牙移动研究的基础。

图6 第一磨牙牙周膜OPG、RANKL、Atg5、Atg7和Beclin-1的mRNA相对表达量Fig 6 Relative expression levels of OPG, RANKL, Atg5, Atg7 and Beclin-1 mRNA of the first molars
在以往对正畸牙移动调控机制的动物模型研究中57%的研究是采用大鼠模型[8]。大鼠模型的优点是操作视野较好,但其杂合性质的遗传背景可能导致出现大鼠在相同加力措施下产生不同反应的情况,从而影响实验结果的精确性和可信度[8]。
本研究选用各等位基因位点具有完全相同纯合基因型的C57B/6近交系小鼠建立正畸牙移动模型,尽可能排除个体遗传差异对实验结果可能造成的影响,以提高结论的准确性。此外,适宜的矫治力对产生足够的生物学反应至关重要[9],一些学者[8,10]认为由于大鼠磨牙比人磨牙小50倍,大鼠正畸牙移动模型中合适的力值应控制在0.2 N以内,实验加力周期至少为2周。Gonzales等[11]的研究发现与重力相比,0.098 N轻力、加力14 d可以在大鼠正畸牙移动模型中产生更多的牙齿移动和更少的牙根吸收。在近期小鼠正畸牙移动的研究[12-14]中,选择加载的力值大多为0.098 N,加力时间为12 d。而Chung等[15]发现,加载0.098 N力值时,在牙移动的压力侧有牙根吸收现象;Fujimura等[13]的研究中也出现了类似的现象,并认为可能是力值过大导致牙根吸收。基于以上研究结果,本研究在实验设计时选择加力力值为0.04 N、加力至12 d,以产生生理性、不良反应更小的牙移动。
本研究结果显示,A组加力组第一磨牙较对照组发生了明显的近中移动(P<0.05);加力组张力侧与压力侧的牙周膜间隙不均等,牙根两侧细胞有差异,压力侧细胞受到挤压,张力侧细胞受到拉伸;加力组组内压力侧破骨细胞数量大于张力侧(P<0.05);加力组牙周组织OPG mRNA表达显著降低(P<0.05),RANKL mRNA表达显著增加(P<0.05)。这些结果均提示本实验中小鼠牙受力后发生移动,为进一步研究自噬相关基因在正畸牙移动骨塑建中的作用提供了基础。
自噬作为一种细胞内的基本降解机制,既能维持细胞生存也能介导细胞死亡[5]。研究[16-18]表明自噬可被多种刺激因素如机械力、营养饥饿等作用快速诱发,而正畸牙移动过程中牙周组织正是受到机械力和饥饿的双重刺激。因此,近年来自噬在正畸牙移动过程中牙周软、硬组织改建中的作用逐渐受到学者关注。Memmert等[19]通过体外实验探讨了静态拉伸应变(static tensile strain)对人牙周膜成纤维细胞自噬水平的影响,结果表明人牙周膜成纤维细胞对拉伸应变有渐进性的自噬反应,即高应变可引起自噬潮(autophagic flux)升高、而低应变对自噬体的形成无明显影响,且两种应变强度都对自噬相关mRNA的表达有调节作用,但高应变对其影响更大。此外,周云[20]通过体内实验表明,在正畸矫治力作用下压力侧的牙周膜内血管被压缩、数目减少,局部牙周膜细胞处于缺氧、营养缺乏的状态,即为一种“饥饿环境”,并进一步通过体外饥饿诱导实验发现“饥饿环境”可引起人牙周膜成纤维细胞内自噬水平升高,包括细胞胞浆中自噬体数目增多、微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)表达增高等;并提出自噬水平的升高可能是受压牙周组织改建过程中牙周膜成纤维细胞对矫治力作用的一种适应性表现,也是压力侧细胞减少的机制之一。
自噬相关基因的编码蛋白在自噬的诱导、产生、成熟及再循环中起重要作用,是自噬发生的关键分子[21]。本实验发现正畸移动的牙周组织中自噬相关基因表达增加,包括Atg5、Atg7和Beclin-1,这一结果与Chen等[22]的动物实验研究结果类似。Beclin-1的作用是在自噬体形成早期阶段招募其他复合物进行自噬体成核,而Atg5和Atg7则在自噬体形成最后阶段的自噬体膜延伸和融合中起作用[23],这些基因表达增加表明本实验正畸牙移动过程中出现自噬水平升高。
此外,以往研究表明缺氧条件下自噬参与了破骨细胞的生物学作用表达,可提供破骨细胞分化所需能量并可通过促进炎症因子的释放介导破骨细胞成熟和发挥功能[24-26]。吕佳岭等[27]通过探究SD大鼠正畸牙移动压力区牙周膜的形态学变化、破骨细胞数量,以及不同时间段内牙周膜细胞内Beclin-1与微管相关蛋白2轻链3(microtubuleassociated protein 2 light chain 3,LC3II)的表达情况,提出自噬可能通过介导牙周膜透明样变发生和影响破骨细胞生物学作用而参与牙周膜改建的过程。破骨细胞核因子κB受体活化因子(receptor activator of nuclear factor-κ B,RANK)/RANKL/OPG信号通路是破骨细胞分化及骨吸收活动中的关键通路[28],近期研究[29-30]证实自噬可通过这一信号通路调节骨矿化和骨稳态。RANKL与RANK结合后可引起破骨细胞的增殖分化并促进骨吸收,而OPG可与RANKL竞争结合RANK,抑制骨吸收从而发挥骨保护作用。因此,可以通过OPG、RANKL和RANK的表达水平来判断骨吸收活动的强弱[31]。本研究中加力组骨塑建相关基因RANKL表达显著增加而OPG表达显著降低,提示加力组骨吸收活动增强。
综上所述,本实验通过C57B/6小鼠正畸牙移动模型发现正畸力作用下牙周组织自噬相关基因表达水平提高、破骨活动增强,提示自噬可能通过影响牙周组织中破骨水平参与了正畸牙移动骨塑建过程,提高自噬可能对提高骨塑建及加速牙移动有着重要的基础及临床意义。但本研究仅从基因层面探讨了正畸牙移动过程中自噬水平的改变,存在一定局限性,未来研究需要结合体内外实验,从基因、蛋白、自噬体等多层面来探讨自噬在正畸牙移动骨塑建过程中作用的具体机制。

