穴位中频脉冲电刺激对下颌前伸大鼠咬肌改建的生理与生化研究
陈青青 刘珍巧 王豫蓉
重庆医科大学附属口腔医院正畸科 口腔疾病与生物医学重庆市重点实验室重庆市高校市级口腔生物医学工程重点实验室 重庆 401147
穴位中频脉冲电刺激是通过电刺激相关穴位的治疗方法,可增强运动神经兴奋性,使局部组织血液循环和代谢功能加快[3],促进肌肉功能的恢复,且具有作用深度大、无痛、不易产生适应性、对皮肤无损伤等特点。目前穴位中频脉冲电刺激治疗主要应用于运动员肌肉训练、肌肉损伤后理疗以及神经肌肉系统疾病的康复治疗,还少见应用于口腔临床功能矫治过程中的报道。
脑源性神经营养因子(brain-derived neurotropic factor,BDNF)是重要的神经营养因子之一,在骨骼肌改建中起着重要作用[4-5]。本实验建立了下颌前伸动物模型,给予咬肌颊车穴中频脉冲电刺激,并对实验大鼠的咬肌肌电变化与BDNF表达进行观察,旨在了解穴位中频脉冲电刺激对下颌前伸大鼠咬肌改建的影响,以探讨穴位中频脉冲电刺激应用于功能矫治的可能性。
1 材料和方法
1.1 实验动物与分组
选用4周龄雄性Sprague-Dawley大鼠60只为研究对象,大鼠体质量(70±5.27) g,均购自重庆医科大学实验动物中心。所有大鼠实验前均自由饮水,定时摄食。按完全随机设计原则将60只大鼠分为3个大组(实验组、条件对照组和空白对照组),每个大组根据实验观测天数又随机分为4个小组(3、7、14、21 d组),共12组,每组5只。各组的处理方式如下:1)实验组,戴用前导下颌装置且接受穴位中频脉冲电刺激;2)条件对照组,戴用前导下颌装置,不接受穴位中频脉冲电刺激;3)空白对照组,不戴用前导下颌装置且不接受穴位中频脉冲电刺激。
1.2 主要仪器与试剂
前导下颌装置参照Rabie等[6]使用的矫治器装置制作,由底板、斜面导板两部分组成。斜面导板与上颌咬合平面呈20°~25°,底板和斜面导板均使用甲基丙烯酸甲酯树脂制成。黏固剂采用GC Fuji Ⅸ玻璃离子黏固剂(苏州而至齿科有限公司)。ZM-C-IA型中频治疗仪(廊坊市天月医疗器械有限公司),BL-420F生物信号采集与分析仪(成都泰盟软件有限公司),兔抗鼠BDNF(重庆蒙博生物科技有限公司),SABC试剂盒及DAB显色试剂盒(北京索莱宝科技有限公司),显微病理图文分析系统(奥林巴斯公司,日本),总RNA提取试剂盒(北京康润诚业生物科技有限公司),qRT-PCR Synthesis试剂盒、2×RealStar Green Fast Mixture(北京康润诚业生物科技有限公司),Z223MK-2低温离心机(Hermle公司,德国),C-1000型荧光定量聚合酶链反应仪(Bio-Rad公司,美国)。
1.3 建立下颌前伸动物模型以及明确中频脉冲电刺激方式
使用玻璃离子黏固剂将自制的前导下颌装置黏固于条件对照组和实验组大鼠的上切牙上,戴用自制颈圈防止大鼠前爪干扰矫治器。根据中国针灸学会实验针灸分会制定的《动物针灸穴位图谱》,颊车穴定位于下颌角前上方咬肌最丰隆处的中点(图1)。使用电推刀去除大鼠双侧颊车穴周围的毛发,用75%乙醇棉球清洁待测部位。将大鼠固定于大鼠固定器上,将中频电治疗仪的两个电极片分别置于实验组大鼠双侧颊车穴表面皮肤,医用胶带固定电极片。开启中频电治疗仪,选择刺激模式9(神经肌肉刺激模式),波形选择正弦波,调制频率选择0~150 Hz,中频电频率选择2 000~8 000 Hz,刺激强度选择1档。每天定时对实验组大鼠进行中频脉冲电刺激,刺激时间设定为15 min,实验各组大鼠分别刺激3、7、14、21 d。

图1 颊车穴定位Fig 1 Acupuncture point positioning
1.4 肌电测量与处理
各组大鼠分别于实验3、7、14、21 d时行肌电测量,其中实验组的肌电测量在中频脉冲电刺激结束30 min后进行。测量时将大鼠固定于大鼠固定器上,将BL-420F生物信号采集与分析仪的正极置于大鼠左侧颊车穴皮肤,负极置于大鼠右侧颊车穴皮肤,地极置于大鼠背部皮肤,电极片使用医用胶带固定。记录大鼠静息状态咬肌肌电1 min,肌电记录完成后,涂布甘油以保护测量部位的皮肤。应用BL-420F生物技能实验系统软件对原始肌电信号进行平滑处理,每只大鼠随机截取3个单位时长为2 s的肌电记录,记录积分肌电并取平均值。按以上方法得到各组大鼠在实验各阶段静息状态下的咬肌平均肌电微分值。
1.5 标本制备
分别于实验3、7、14、21 d肌电测量完成后断颈处死各空白对照组、条件对照组和实验组大鼠。取大鼠左侧咬肌置于新鲜配置的4%多聚甲醛溶液中,4 ℃固定12 h,梯度乙醇脱水,二甲苯透明,石蜡包埋。每块咬肌组织作连续切片5张,切片厚度为4 μm,1张用于苏木精-伊红(hematoxylin-eosin,HE)染色,其余4张用于SABC免疫组织化学染色。取大鼠右侧咬肌组织置于冻存管,快速转移至液氮罐中,用于后续实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)检测。
1.6 HE染色
取各组咬肌组织标本切片,常规脱蜡、水化,经苏木精染色、盐酸乙醇分化、伊红染色、梯度乙醇脱水,二甲苯透明,中性树胶封片,置于光学显微镜下观察。
1.7 BDNF免疫组织化学染色
取各组咬肌组织标本切片,常规脱蜡、水化,H2O2孵育以阻断内源性过氧化氢酶的活性,柠檬酸钠缓冲液浸泡,微波修复暴露抗原,滴加BSA封闭液(牛血清白蛋白),加入一抗,4 ℃孵育过夜,加入二抗,37 ℃孵育30 min,再滴加SABC,37 ℃孵育30 min,DAB显色液显色,苏木精复染,脱水封片。切片置于光学显微镜下观察,利用显微病理图文分析系统测定大鼠咬肌BDNF阳性染色部分的光密度值,每张组织切片随机选取4个视野进行积分光密度值(integrated optical density,IOD)测量,结果取其平均值。
1.8 qRT-PCR检测BDNF mRNA表达
取各组右侧咬肌组织适量,经研磨、匀浆,使用RNA快速提取试剂盒提取总RNA,紫外分光光度计检测其纯度,OD260/OD280值为1.9~2.1说明纯度较好。纯度符合要求后逆转录合成cDNA,然后以cDNA为模板,以β-actin为内参照进行qRTPCR反应,反应体系按说明书进行,引物序列见表1,引物的合成与设计均由美国Invitrogen公司完成。

表1 qRT-PCR引物序列Tab 1 The primer sequence for qRT-PCR
本实验反应条件为:解链95 ℃ 1 min,退火95 ℃ 5 s,延伸57 ℃ 10 s,最后延伸60 ℃ 34 s,共计40个循环。结果分析采用2-ΔΔCT法。
1.9 统计学方法
本研究使用Graphpad prism 7.0统计软件进行分析,计量数据以均数±标准差表示,组间比较采用双因素方差分析,检验水准为双侧α=0.05。
2 结果
2.1 肌电检测结果
各组大鼠的咬肌静息肌电的变化图见图2,积分肌电值见表2。

图2 各组大鼠下颌姿势位咬肌静息肌电变化Fig 2 Resting electromyographic changes of the masseter muscle in the mandibular advancement in different groups
表2 各组大鼠下颌姿势位咬肌静息积分肌电值Tab 2 Resting electromyographic of the masseter muscle in the mandibular advancement in different groups μV·ms-1,±s, n=5

表2 各组大鼠下颌姿势位咬肌静息积分肌电值Tab 2 Resting electromyographic of the masseter muscle in the mandibular advancement in different groups μV·ms-1,±s, n=5
注:a与空白对照组比较P<0.05;b与条件对照组比较P<0.05。
戴入时间 空白对照组 条件对照组 实验组戴入前 143.81±5.20 147.71±4.27 150.61±2.41戴入当时 149.40±5.83 214.71±4.79a 241.13±6.85ab戴入3 d 142.43±7.65 202.67±5.89a 228.40±7.58ab戴入7 d 149.99±2.13 188.16±3.92a 204.66±6.89ab戴入14 d 144.44±5.46 178.74±3.65a 166.43±5.03ab戴入21 d 148.59±3.15 175.49±2.65a 155.11±7.44b
由图2和表2可见,不同的观测时间内,空白对照组大鼠下颌姿势位时咬肌静息肌电的波动很小,条件对照组与实验组大鼠下颌姿势位时咬肌的静息肌电在实验各期均先升高后降低。条件对照组和实验组大鼠戴入矫治器当时咬肌肌电活动明显高于戴入前,且实验组高于条件对照组(P<0.05);矫治器戴入3 d,条件对照组与实验组大鼠咬肌肌电均较戴入当时明显降低,但仍高于戴入前水平;戴入14 d,实验组肌电活动较条件对照组明显降低(P<0.05);戴入21 d,实验组与空白对照组的肌电活动水平无明显差异(P>0.05),均低于条件对照组(P<0.05)。
2.2 HE染色结果
各组大鼠咬肌的HE染色见图3,各组标本均未见炎症细胞浸润。在各实验阶段,空白对照组咬肌肌纤维粗细较均匀,排列整齐、紧密,肌核形态较规则,多呈长椭圆形,位置分布较均匀,位于肌纤维边缘。条件对照组在戴入7、14 d时出现咬肌肥大改变,表现为细胞核增多,排列紊乱,出现核内移现象,肌纤维增粗,肌纤维间的间距减小;戴入21 d时,细胞核数量和肌纤维直径较14 d时有所减少,细胞核排列较规则。实验组在戴入7 d时出现咬肌增生肥大的表现,肌纤维增粗,细胞核增多,排列紊乱;戴入14 d时,细胞核数量有所减少;戴入21 d时,细胞核数量进一步减少,细胞核数量与空白对照组基本一致,但排列较空白对照组紊乱,仍有少许核内移现象。与条件对照组比较,实验组戴入3、7 d时的细胞核数量无明显增多;戴入14 d时,实验组细胞核有所减少;戴入21 d时,细胞核数量进一步减少。
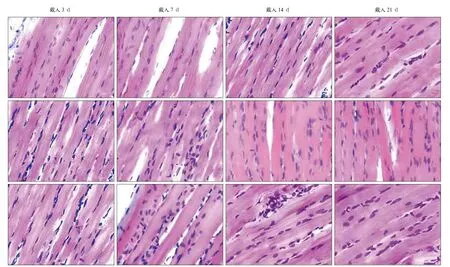
图3 各组大鼠下颌姿势位时咬肌的组织学变化 HE × 400Fig 3 Histological changes of masseter muscle in the mandibular advancement in different groups HE × 400
2.3 BDNF免疫组织化学结果
各组大鼠咬肌纤维BDNF的免疫组织化学染色见图4,BDNF阳性表达呈黄褐色。各组BDNF染色的IOD值结果见表3。条件对照组与实验组大鼠咬肌BDNF表达在实验过程中均呈先升高后降低的趋势。与空白对照组比较,条件对照组在7、14、21 d时咬肌纤维BDNF阳性染色加深,实验组3、7、14 d时咬肌纤维BDNF阳性染色加深,实验组21 d时的IOD值与空白对照组的差异无统计学意义(P>0.05)。与条件对照组比较,实验组3 d时BDNF阳性染色加深,7 d时两组无明显差异,14 d和21 d时BDNF蛋白表达降低(P<0.05)。
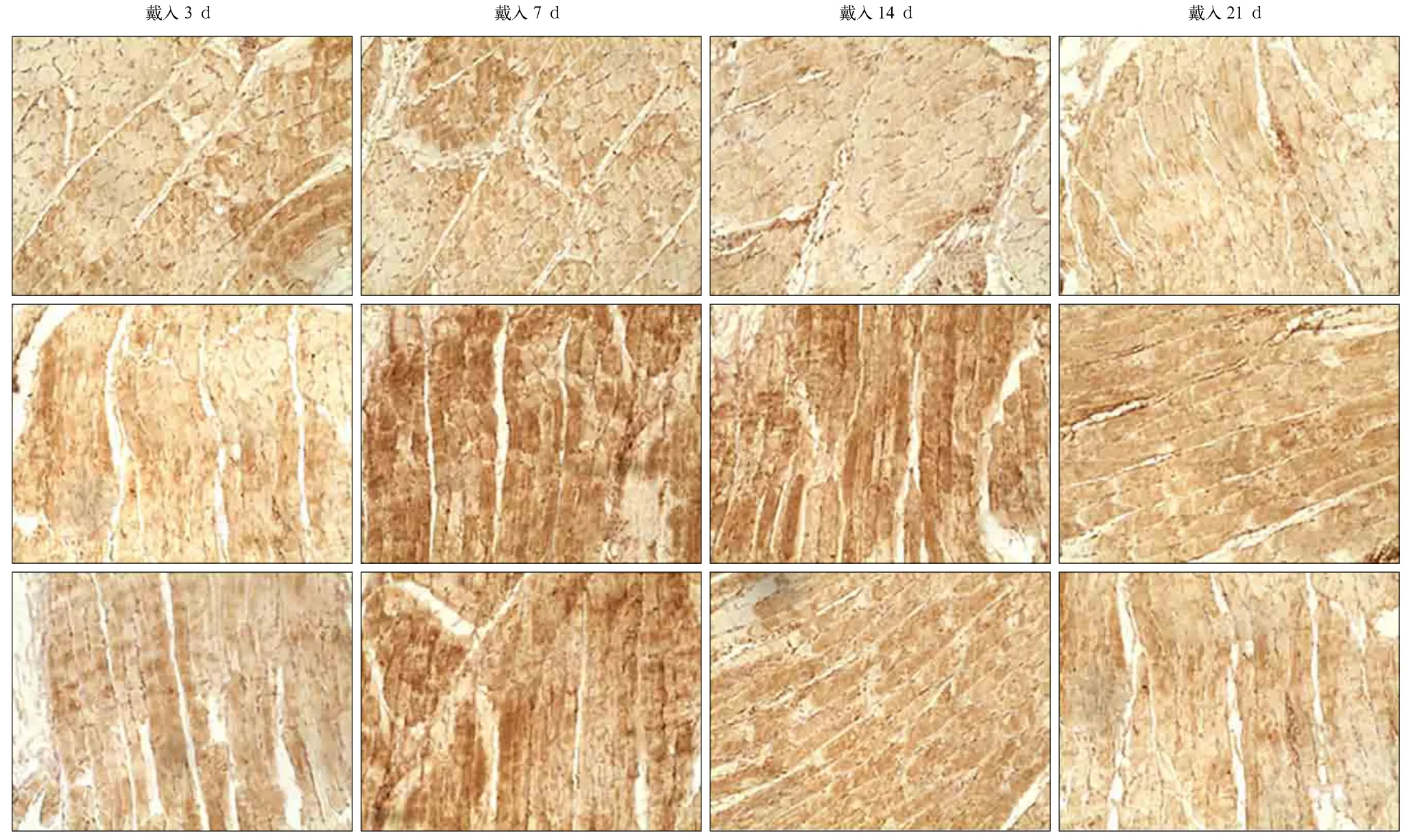
图4 各组大鼠咬肌BDNF蛋白的表达变化 SABC × 400Fig 4 Changes of expression of BDNF protein in masseter muscle in different groups SABC × 400
表3 大鼠咬肌BDNF蛋白的IOD测量值变化Tab 3 Changes of the IOD of BDNF protein in masseter muscle ±s, n=5

表3 大鼠咬肌BDNF蛋白的IOD测量值变化Tab 3 Changes of the IOD of BDNF protein in masseter muscle ±s, n=5
注:a与空白对照组比较P<0.05;b与条件对照组比较P<0.05。
戴入时间/d 空白对照组 条件对照组 实验组3 158.16±15.64 167.50±5.96 183.69±16.88ab 7 156.49±12.22 225.20±10.54a 213.43±9.49a 14 150.53±6.94 229.14±9.68a 196.45±13.11ab 21 149.33±5.64 200.93±20.25a 155.63±10.09b
2.4 qRT-PCR结果
大鼠咬肌组织提取出的RNA经测定,其OD260/OD280值均在1.9~2.1之间,纯度符合要求。BDNF mRNA的qRT-PCR结果见表4。条件对照组与实验组BDNF mRNA的相对表达量在整个实验过程中均呈现先升高后降低的趋势。与空白对照组比较,条件对照组BDNF mRNA的相对表达量在戴入7、14、21 d时明显升高(P<0.05),实验组在戴入3、7、14 d时明显升高(P<0.05),戴入21 d时与空白对照组无明显差异(P>0.05);与条件对照组相比较,实验组在戴入3 d时BDNF mRNA相对表达量明显升高(P<0.05),7、14 d时无明显差异(P>0.05),21 d时相对表达量降低(P<0.05)。
3 讨论
正畸临床上对处在生长发育期的安氏Ⅱ类患者,常使用功能矫治器前导下颌以刺激下颌生长,改善患者面型[7]。采用功能矫治器前伸下颌后,一方面使髁突在关节窝内向前下方向移位,使生长活跃的髁突所受压力减小;另一方面使相关肌肉牵张,肌肉被动牵张产生的力传递到牙齿、牙弓和颌骨上[8],将功能过度或功能不足的肌肉导向正常;同时相关咀嚼肌发生适应性改建,维持下颌骨在新的姿势位的稳定性[9]。Sood等[2]研究发现,神经肌肉完成适应性改建通常需要2年左右时间,而功能矫治的时间通常为1年左右。由于神经肌肉改建速度较慢,导致功能矫治结束后神经肌肉平衡尚未建立,肌肉等软组织可使前伸的下颌骨产生功能性回退,这是造成功能矫治远期效果不稳定的主要因素[10]。Vardimon等[11]提出延长功能矫治器戴用时间,以弥补戴用传统功能矫治器神经肌肉适应差的特点。但延长矫治器戴用时间会降低患者的依从性,导致矫治效果不佳,且过长时间戴用功能矫治器会影响儿童的正常生长发育。电刺激通过引入动作电位以促进失功能神经恢复生物电活动[12],可在肌肉组织中产生电阻性发热,增加二磷酸腺苷、三磷酸腺苷等代谢产物释放,引起血管活性介质增加,有调节肌纤维生理、生化性质,维持肌肉的体积和肌力,促进萎缩肌肉纤维再生,改善肌肉组织代谢,促进血液循环,缓解肌肉疲劳,治疗运动性肌肉损伤,快速消肿等作用[13-14]。在诸多电刺激方式中,调制中频脉冲电刺激兼有低频电与中频电的特点,其疗效较单一的低频电治疗和中频电治疗更好[15]。调制中频脉冲电刺激优点包括:1)幅度、波形不断变化,机体不易产生适应性;2)作用深度大;3)无电解作用,对皮肤无损伤。颌面部肌肉中,咬肌与咀嚼功能密切相关且力量强大,是影响下颌骨位置移动以及移动后复发的主要因素。颊车穴在解剖学上为咬肌覆盖,周围分布有下颌神经、面神经下颌缘支等。该穴位区域的神经、肌肉数量多且复杂,与下颌运动关系非常密切[16]。临床上,颊车穴常用作治疗面瘫、颞下颌关节疼痛的常选穴位,通过针灸或者电刺激等方式作用于颊车穴,有缓解咀嚼肌痉挛,减轻神经肌肉疼痛,促进局部血液循环,改善面部神经肌肉功能等作用[17-18]。
本研究选用处于生长发育高峰期的4周龄雄性大鼠,利用调制中频脉冲电刺激实验组大鼠的颊车穴,分别在戴用功能矫治器前,戴入当时和戴用后3、7、14、21 d时测量其咬肌静息肌电值,观察咬肌组织结构,检测BDNF蛋白表达情况,探讨穴位中频脉冲电刺激是否能促进肌肉改建。
肌电图是临床上检查肌肉功能常用的无创方法[19]。肌电是骨骼肌在兴奋时因肌纤维动作电位传导和扩布发生的电位变化,是肌肉中许多运动神经元动作电位在时间和空间上的叠加。表面肌电信号是通过表面电极引导、记录的肌电变化,能够在非损伤状态下定量反应肌肉功能状态。有研究[20]表明,积分肌电与肌力成正比关系,能很好地反映肌肉的功能状态。本实验结果显示,戴入矫治器前,各组大鼠咬肌在姿势位时存在轻微肌电活动,这是由于姿势位时下颌骨因重力作用有向后下方向旋转的倾向,咬肌通过轻微收缩参与维持大鼠下颌姿势位的稳定。空白对照组咬肌姿势位肌电水平在实验各期无明显变化,说明咬肌功能受自然生长因素很小。条件对照组和实验组大鼠戴入矫治器当时肌电活动增强,可能是由于矫治器前伸下颌,且增加了颌间垂直高度,咬肌受到牵拉,刺激牵张感受器,使其收缩活动增加,同时,肌肉张力性活动增加也有利于下颌前伸位的维持。电刺激与中枢神经发出冲动所引起的肌肉收缩效果是一样的,实验组瞬时肌电高于对照组,可能是由于穴位中频电刺激咬肌后,短时间内调动了更多的肌纤维参与收缩,肌肉收缩活动增加所致。条件对照组与实验组在戴入3、7 d时,咬肌静息肌电逐渐降低,说明咬肌处于功能改建状态,正逐渐适应下颌前伸位;戴入21 d时实验组咬肌肌电与对照组无明显差异,较条件对照组咬肌肌电水平低,提示实验组大鼠较条件对照组大鼠更快适应了新的下颌位置,初步建立了新的功能平衡,并且通过适当的肌电水平,维持下颌在新的前伸姿势位的稳定。
肌肉受到适宜刺激可引起生理性活动增强,肌纤维肥大以及卫星细胞数量增多,卫星细胞加入到肌纤维中增加肌核量,表现为肌核内移,又称中央核现象,常见于代偿性肥大的肌纤维中。本实验过程中,条件对照组与实验组均先发生代偿性肥大,然后组织形态学慢慢恢复至大致正常。条件对照组与实验组大鼠在下颌前伸第7天时肌纤维出现增生肥大表现,表现为肌纤维横截面积增大,肌纤维间的间距减小,细胞核增多,排列紊乱,并出现中央核现象,说明条件对照组和实验组大鼠咬肌功能增强,肌纤维代偿性肥大以适应新的下颌前伸位置。前伸14 d时,条件对照组大鼠肌纤维细胞核数量与前伸7 d时无明显差异,实验组较前伸7 d天时肌纤维细胞核数量有所减少,中央核现象减少,说明实验组大鼠咬肌功能活动开始减弱,开始适应新的下颌前伸位置;实验组21 d时细胞核数量基本与空白对照组一致,但排列仍较紊乱,有少许核内移现象,条件对照组细胞核数量仍较多,排列紊乱,说明实验组大鼠咬肌活动进一步减弱,比条件对照组更好地适应新的下颌前伸位置,但仍处于适应改建过程中,未完全适应,可能仍需一段时间,才能形成稳定的肌肉结构,稳定新的下颌前伸位。
肌肉运动的最小功能单元称为运动单元,由运动神经元与其支配的肌肉纤维组成,二者之间的信息传递依赖神经肌肉接头(neuromuscular junction,NMJ)。NMJ通过将神经元传出的电信号转化为化学信号,引起肌肉收缩,在肌肉的功能运动中起着至关重要的作用。BDNF可由肌纤维产生,是重要的运动神经营养因子之一,有促进运动神经元的存活、增强突触传递效率、维持神NMJ的发育和功能等作用[4-5],在骨骼肌改建中起着重要作用。肌肉收缩可增加骨骼肌内BDNF的表达,BDNF表达升高可作为肌肉改建活跃的指标[21]。本研究显示,空白对照组咬肌纤维BDNF表达逐渐降低,可能与软食喂养有关。由于进食软食,大鼠咀嚼次数与时间减少,咬肌功能活动减弱,从而影响了BDNF表达。条件对照组和实验组大鼠在为期21 d的实验阶段内,BDNF表达都呈先上升后下降的趋势。实验前阶段BDNF表达水平上升提示咬肌为适应骤然改变的下颌位置,NMJ突触活动增强,改建速度逐渐加快;实验后阶段BDNF表达水平下降说明随着大鼠逐渐适应下颌前伸位,NMJ突触活动逐渐减弱,改建速度放缓;当BDNF表达水平恢复至与空白对照组大鼠基本一致时,说明NMJ突触活动水平已恢复至正常,咬肌改建基本完成。与空白对照组比较,实验组大鼠咬肌BDNF表达在下颌前伸3 d时明显升高,条件对照组大鼠无明显差异,说明与单独下颌前伸比较,穴位中频电刺激组在戴用功能矫治器的早期即可进入活跃的改建期。在实验7、14 d时,实验组大鼠咬肌BDNF表达水平较条件对照组大鼠低,提示实验组大鼠通过前期的高速改建,已逐渐适应新的下颌位置,改建速度由之放缓,而条件对照组大鼠尚未很好适应新的下颌位置,仍处于高速改建过程中。此外,也可能由于条件对照组大鼠改建上升期更长,导致BDNF表达水平在实验后阶段较实验组大鼠更高。在实验21 d时,与空白对照组比较,条件对照组BDNF表达水平仍较高,而实验组BDNF表达水平则无明显差异,说明实验组咬肌肌肉改建已近完成,而条件对照组肌肉改建仍在进行,改建尚未完成。在实验后阶段,虽然条件对照组大鼠BDNF长时间处于高水平表达,但其完成改建的时间却较实验组更长。这也说明在不加干预的情况下,下颌前伸后,咬肌完成改建过程需要较长的时间,影响临床功能矫治的疗效和保持;穴位中频脉冲电刺激缩短了咬肌完成改建的时间,可能对缩短患者矫治疗程,更好保持矫治效果有积极作用。
本研究结果表明,中频脉冲电刺激作用于下颌前伸大鼠颊车穴可早期加强咬肌的肌电活动,上调BDNF的表达,缩短咬肌肌电和BDNF水平恢复至正常的时间,促进肌肉组织完成改建,且其操作简单,安全舒适,有望成为功能矫治的辅助疗法,但其原理及具体作用机制还有待进一步研究。

