套索肽替代抗生素应用的研究进展
陈鹏,李守勇
(北京英惠尔生物技术有限公司,北京100081)
肽类抗生素根据来源分为两类。非核糖体肽抗生素,如短杆菌肽、多粘菌素,杆菌肽和糖肽等,主要由细菌产生,需经过修饰,经过肽-合成酶的多酶复合体修饰。但由核糖体合成翻译后修饰的肽(RiPPs)了解较少[1]。所有生命体(包括细菌)都可以产生RiPPs,如哺乳动物源肽、两栖动物肽、昆虫源肽、植物源肽和微生物源肽等。RiPPs是宿主天然防御分子的主要组成部分,化学结构和功能多样化,既可抗菌又可镇痛。目前商业应用包括乳食品防腐剂链菌肽(Nisin),兽药抗菌剂硫代链霉菌素(Thiostrepton),ω-芋螺毒素MVIIA(Omega-conotoxin MVIIA,一种合成镇痛药)[2-5]。本文重点综述微生物RiPPs中具有套索结构的套索肽,在天然宿主防御系统(作为天然抗生素)中的作用以及临床应用潜力。
1 结构和分类
1.1 套索肽结构
套索肽是RiPPs中的一个大家族,化学结构多样。1991年,首次发现该家族中的第一个肽anantin[6]。2008年之前,所有套索肽都是在分离活性化合物过程中发现。因此,很大程度上具有偶然性[7]。2008年基因组挖掘技术开始兴起,通过该技术发现的套索肽数量稳步增加,capistruin成为第1个通过基因组挖掘技术分离的套索肽[8]。
套索肽通常有14~24个氨基酸残基,在N末端胺与7、8或9位置的谷氨酸或天冬氨酸残基的羧基之间具有特征性的异肽键,形成一个N末端大环(大内酰胺环)[9]。C末端尾部通过N端大环,产生类似套索的拓扑结构。在某些套索肽中,C末端尾巴大分子量的氨基酸充当“立体塞”,被困在环中,以防止C末端肽脱线。这种套索拓扑结构稳定性高,对蛋白酶水解和化学降解具有抗性。套索肽对95~120℃高温也具有抗性[10-11]。热稳定性取决于C末端尾巴的灵活性,大内酰胺环大小以及“立体塞”氨基酸大小和位置[12-13]。
1.2 套索肽分类
套索肽根据分子内二硫键的数量和位置,分为四类。Ⅰ类套索肽包含两个二硫键,将大环与穿环而过的尾部相连,Ⅱ类没有二硫键,Ⅲ类和Ⅳ类在不同的结构位置含有一个二硫键。Ⅲ类肽中,二硫键连接N端环和C端尾巴,而Ⅳ类肽,二硫键连接C端尾上。截至2017年,根据现有基因组序列,预计96%的套索肽属于Ⅱ类[14]。套索肽(尤其是Ⅱ类)可以在异源宿主大肠杆菌中表达。目前还不清楚大肠杆菌异源系统为何有效产生Ⅱ类套索肽。关于套索肽生产菌株的调控也了解较少。
1.3 套索肽结构和功能关系
近年来,通过套索肽的氨基酸组成研究抗菌机理和其他活性成为热点[15],研究capistruin[16]、MccJ25[17-18]、astexins[19],caulosegnins[20]和xanthomonins[21]几种套索肽结构与活性间的关系。发现几乎所有套索肽大环的氨基酸残基数量都是8或9个。因此有人认为,带螺纹的内酰胺环不能由其他数量构成。10个残基的环太大而难以维持空间稳定,而7个残基的环太小无法穿环。然而xanthomonins I-III在Gly1和Glu7之间形成环[21]。huascopeptin也是7个氨基酸残基环。
MccJ25是套索肽的典型结构研究模型[22],不仅是最早发现的套索肽之一,且是最早鉴定出其生物合成基因簇的肽[23]。MccJ25有21个氨基酸残基,残基Gly1和Glu8形成内酰胺键,构成一个小圆环,第9-21个氨基酸构成线性C末端尾巴。β-发夹环结构的C末端尾部穿过环,形成交错的拓扑结构。替换MccJ25的一些氨基酸可以改变其结构,结构的变化直接影响活性。理论上,只有3个氨基酸,Gly1,Gly2和Glu8不能被取代[24]。MccJ25最强大的活性是抗菌[25]。一种抗菌机制是MccJ25的Ala3和His5与负责细菌吸收铁的外膜铁载体受体FhuA结合,MccJ25进入细胞内,随后通过Gly4,Pro7,Tyr9,Phe10,Phe19和Gly21抑制RNA聚合酶[26]。另一个抗菌机制是MccJ25参与抑制微生物的膜呼吸链[27],Tyr9被认为是关键的功能残基[28-29]。MccJ25尾部G12,I13或T15的取代将增强其抗菌活性[30]。
套索肽capistruin具有由Gly1和Asp9连接形成的典型内酰胺环[16]。双重位置突变的变体R15A/F16A和F16A/F18A仍可以形成具有套索结构的成熟captrustrin。用Leu替代Val12和Ile13后,capistruin生成不会受到影响[16]。但是,用Ala替换Val12和Ile13中任何一个将不能生成capistruin。这表明形成套索肽可能与氨基酸之间的空间结构和分子间力(氢键和范德华力)有关。当Propeptin-2缺少尾巴的最后2个氨基酸时,其抗菌活性降低甚至完全丧失[31]。天然套索肽的结构具有很高的特异性和稳定性,尽管修饰的套索肽比天然肽具有更脆弱的结构,但提供多功能骨架,可用于许多领域。
套索结构赋予肽对蛋白酶的耐受性[16]。有研究发现,尽管MccJ25的大环区域通常可被蛋白酶(如嗜热菌蛋白酶)接触,但其环和尾紧密结合。即使不再共价连接,仍保持互锁,可在液相和气相中观察到[32]。还有研究表明,高压灭菌后,MccJ25仍具有抗菌活性[10]。由于套索肽都具有共同的拓扑结构,因此可预期套索肽都具有这种特性。但LCMS分析表明,对花椰菜素Ⅰ和Ⅲ(caulosegnins)热处理后,在不同的保留时间出现新的峰,但质量不变[20]。这表明一定发生非化学转化,从套索到分支环的解链。几种新的套索肽热敏感性研究也表明,即使某些肽具有抗高温变性的能力,但并非适用于每个套索肽[19,33]。革兰氏阳性细菌红球菌(Rhodococcus jostii)K01-B0171产生的套索肽lariatins,只能依靠Lys17和Pro18之间的盐桥结构与靶分子结合来防御分枝杆菌[34]。核磁共振和分子动力学模拟表明,lariatin A的Lys17与MccJ25的His5位于相似的位置,这对于抑制细菌的生长也是必不可少。
2 套索肽的生物活性
套索肽具有多种生物学活性,可以作为受体颉颃剂,酶抑制剂,抗肿瘤转移酶和抗菌剂[6,14]。所有已知的套索肽均来源于变形杆菌或放线菌[35],当营养缺乏时产生,套索肽作为抗菌分子,让宿主具有对抗竞争者的优势。至少14种套索肽对革兰氏阳性和革兰氏阴性病原体有抗菌活性。通常放线菌(Actinobacteria)和变形杆菌(Proteobacteria)产生的套索肽可以分别抵抗革兰氏阳性菌及其同源菌株[36]。特别是Microbispora sp产生的套索肽propeptin对革兰氏阳性分枝杆菌(Mycobacterium phlei),革兰氏阳性分枝杆菌(Xan thomonas oryzae)米克氏黄单胞菌和铜绿假单胞菌(Pseudomonas aeruginosa)均具有抗菌活性。前肽素(propeptin)和阿波霉素(aborycin)对革兰氏阳性菌和革兰氏阴性菌均表现出抑制作用[37]。在这些抗菌剂中,其生物活性范围很广,因为某些套索肽(如lassomycin和lariatin A/B)仅具有针对分枝杆菌属的生物活性,而其他诸如siamycin-I和LP2006则对革兰氏阳性菌起作用。在质粒上发现MccJ25的基因簇(mcjABCD),通过异源表达可以生产,但是MccJ25的抗菌功能仅对其原产菌株的相关菌属(肠杆菌科,例如埃希氏菌,沙门氏菌和志贺氏菌)有效[38]。从伯克霍尔德菌(Burkholderia)共分离出3种套索肽,capistruin[8]来自B.thailandensis,burhizin来自B.rhizoxinica,ubonodin[39]来自B.ubonensis。capistruin对包括大肠杆菌的一些革兰氏阴性菌有弱到中等的抑菌活性,ubonodin对多种致病伯克霍尔德菌有强效的抑菌作用。大多数套索肽没有表现出任何抑菌能力[11,20,40],套索肽活性总结见附表。
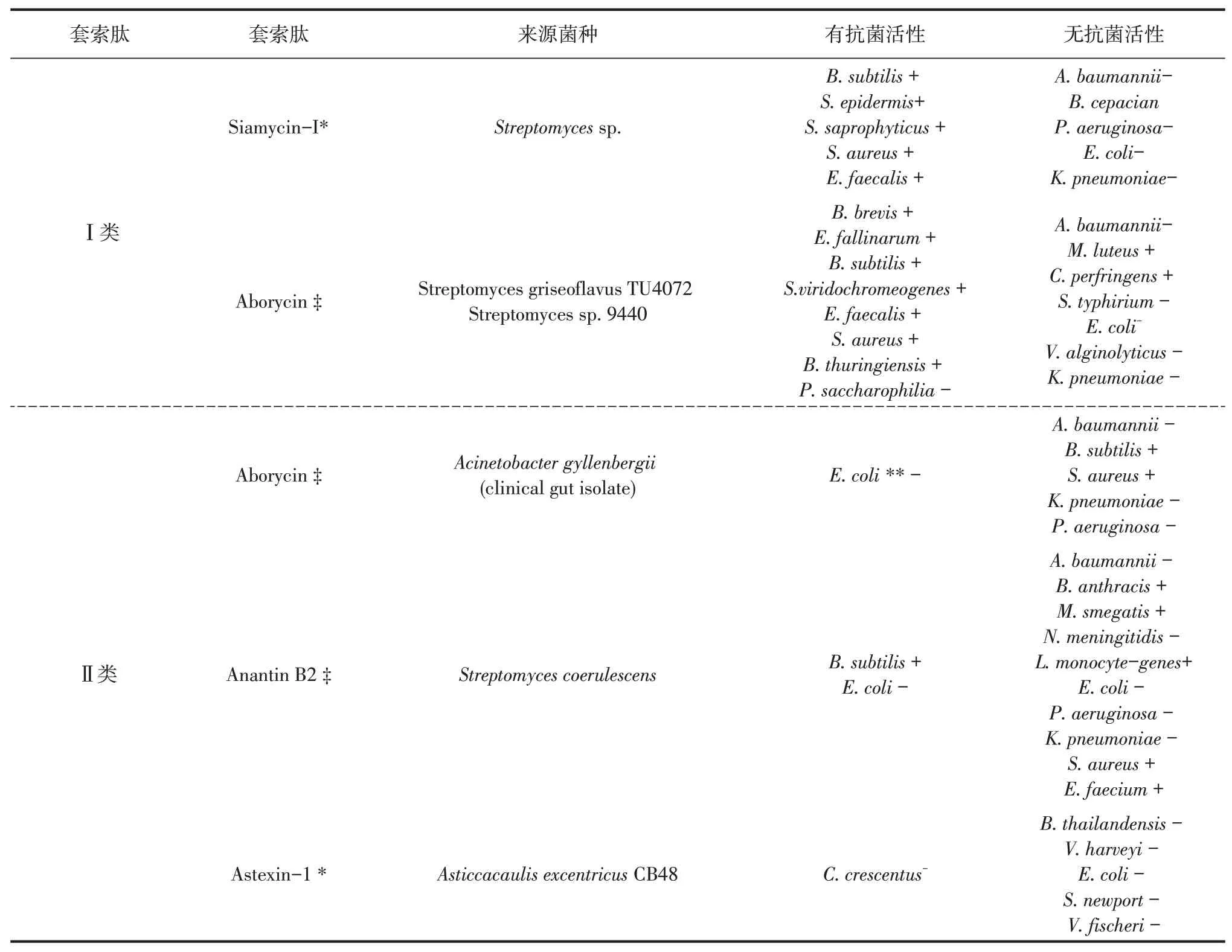
附表套索肽的抗菌活性

续表
3 抗菌肽的靶点
部分套索肽的分子靶标已经确定[41]。MccJ25和capistruin的分子靶点是革兰氏阴性RNA聚合酶(RNAP)[42],lassomycin的靶点是结核分枝杆菌的hsp100家族伴侣ClpC1[43]。其他靶点包括与多种癌症(如乳腺癌、胃癌、结肠癌和前列腺癌)相关的内皮素B受体和与糖尿病相关的胰高血糖素受体。另外,套索肽可抑制癌细胞侵袭人肺细胞。
3.1 抑制肽聚糖合成
抗生素在细菌中主要的靶点是其细胞膜,尤其是肽聚糖。肽聚糖是高度交联的聚合物,对于维持细胞形状,细胞大小和调节渗透压至关重要。到目前为止,有两种套索肽抑制肽聚糖的合成:siamycin-I和streptomonomicin。
3.2 抑制RNA合成
目前,已知的套索肽中有50%以上可以抑制细菌RNA聚合酶(RNAP)。研究最深入的模型套索肽是MccJ25,它是首次发现的大肠杆菌RNAP的肽型抑制剂。后来发现capistruin、acinetodin、klebsidin和citrocin[44]也可以抑制细菌RNAP。
3.3 抑制ClpC1P1P2蛋白酶
套索肽的最后一个靶点是结核分枝杆菌(M.tuberculosis)的ATP依赖性蛋白酶复合物ClpC1P1P2。Lassomycin是一个16氨基酸残基的多肽,对各种结核分枝杆菌菌株,MIC测定范围为0.8~3μg·mL-1。
4 替抗应用
关于套索肽在动物上应用的报道不多,很重要的一个原因是工业化表达量都比较低,在动物上的应用成本高。在所有套索肽中,MccJ25的应用研究相对比较系统。日粮添加MccJ25可提高断奶仔猪和肉鸡的生长性能,减缓腹泻和系统性炎症的发生,提高肠道屏障功能,改善粪便微生态组成[45-46]。通过小鼠模型在MccJ25添加量的研究中,发现中剂量添加有正向的效果,高剂量添加有毒性风险[47]。重组MccJ25可能作为农业,动物生产和食品业消减和预防大肠杆菌和沙门氏菌的有效办法。
5 展望
套索肽由于其独特的拓扑结构和新颖的抑菌机制而成为一类有前景的抗菌物质。各类细菌都可以产生套索肽,即使研究多年的细菌中也还有很多未被识别的套索肽生物合成基因。尽管仅确认了部分少量的套索肽,但拓宽了抑菌靶点的多样性。对套索肽种类的进一步的探索必将增加抑菌靶点的多样性,为规避抗菌素耐药性提供新的方法。最后,套索肽的蛋白原性让套索肽比其他任何抗生素适合生物工程改造。当前,重新设计套索肽及其核心序列的生物合成工作有助于理解残基在生物活性和生物合成中的重要性。对这些化合物的进一步研究有可能解决产量问题,并增加多样性。

