热风干燥温度对冰菜干燥动力学、多酚含量及抗氧化活性的影响
忻晓庭 刘大群 郑美瑜 李小琼 李 乔 张程程
(浙江省农业科学院食品科学研究所 浙江省果蔬保鲜与加工技术研究重点实验室 杭州310021)
冰菜(Mesembryanthemum crystallinum Linn.),别名冰叶日中花、冰草,属番杏科,分布在非洲、欧洲、亚洲西部等地,在日本、韩国、英国等国家作为一种新兴的绿色健康蔬菜被食用,近年来也逐渐传入我国[1]。冰菜叶面底部和茎上附着大量包含着盐类的泡状细胞,自身带微咸味,口感清脆,风味独特,可生食或炒食,具有很高的营养价值[2]。研究表明:冰菜中多酚(包含黄酮)含量丰富,其具有良好的抗氧化活性,能有效清除体内自由基,抑制脂质过氧化及保护机体生物大分子[3]。
干燥是通过物理方式将水分除去,以延长果蔬贮藏时间的一种方法。通过干燥加工可改变果蔬风味,提高食用价值和经济效益[4-5]。冰菜水分含量高,极不耐贮藏,除鲜食外,可通过干燥等方式延长其贮藏期以提高其经济价值。陈玮琦等[6]研究表明,食品干燥目前已从传统的阴干晒干方式等转变为现代多元化干燥,例如微波干燥,真空冷冻干燥、冷冻干燥等。热风干燥由于成本较低,处理量大,易于操作等优点,是目前应用较普遍的干燥技术,然而此方法也存在营养成分损失较大,热效率低等缺点[7]。研究表明,不同的热风干燥温度对果蔬的多酚含量及抗氧化活性等功能性品质影响很大[8-9]。干燥是冰菜初加工最为重要的环节,其工艺参数对干燥冰菜的功能性品质有重要的影响。本试验中通过比较冷冻干燥和不同温度下热风干燥对冰菜中多酚物质含量和抗氧化活性的影响,筛选冰菜干燥的最适条件,为冰菜的初加工提供理论依据。
1 材料与方法
1.1 材料与试剂
冰菜,购于市场。
Folin-Ciocalteu 试剂、DPPH、TPTZ,美国sigma 公司;芦丁标准品,中国药品生物制品检定所;没食子酸、原儿茶酸、香豆酸、绿原酸、阿魏酸、咖啡酸、槲皮素、山奈酚标准品,阿拉丁试剂(上海)有限公司。
1.2 主要仪器与设备
UV-2600 型紫外分光光度计,尤尼柯(上海)仪器有限公司;TP-214 电子天平,美国Denver 公司;SCIENTZ-18N 冷冻干燥机,宁波新芝生物科技股份有限公司;Waters 2695 液相色谱仪;HD-5型水分活度测量仪;CR-400 色差计,柯尼卡美能达有限公司;DHG-9070A 电热鼓风干燥箱,上海精宏实验设备有限公司;SHA-C 恒温振荡器,常州澳华仪器有限公司。
1.3 干燥方法
1)热风干燥 称取均匀切分的500 g 冰菜样品,均匀地平铺在托盘内,置电热鼓风干燥箱中热风干燥(40,60,80,100,120 ℃)。设置不同的干燥时间间隔,绘制不同温度下冰菜水分比(MR)与干燥时间的关系曲线。

式中,Mt——在干燥时间t 时的湿基含水量(g水/g 干基);M0——初始含水量(g 水/g 干 基);Me——平衡含水量(g 水/g 干基),可忽略不计[10]。
2)冷冻干燥 挑选一定量新鲜且不腐烂、无损伤的冰菜,切分成均匀的小份,放入-80 ℃超低温冰箱冷冻12 h,之后用真空冷冻干燥机干燥至水分含量小于10%。干燥粉碎后的冰菜用密封袋避光保存,备用。
1.4 理化指标的测定
1.4.1 水分含量的测定 采用GB 5009.3-2010方法中的直接干燥法(105 ℃干燥法)测定水分含量。
1.4.2 水分活度的测定 称取约1 g 冰菜试样,迅速放入样品皿中,封闭测量仓,在温度20~25 ℃,相对湿度50%~80%条件下测定,每隔5 min 记录水分活度仪响应值,相邻两次响应值之差小于0.005 Aw 时,即测定值。仪器平衡充分平衡后,同一样品重复测定3 次。
1.4.3 色差的测定 色差的测定采用色差仪,将不同干燥温度处理后的冰菜样品超微粉碎。将色差仪校准后测定样品颜色参数。L*代表黑白偏差量,正数表示偏白,负数表示偏黑;a*代表红绿偏差量,正数表示偏红,负数表示偏绿;b*代表黄蓝偏差量,正数表示偏黄,负数表示偏蓝;ΔE 代表色差综合偏差量,它表示所测样品的L*、a*、b*值与标准白板之间的色差值,以此反映样品色泽的变化。ΔE 按下式计算:
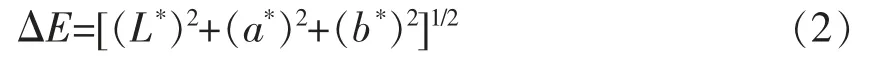
1.4.4 多酚含量的测定 样品提取:取1.0 g 样品于离心管中,加入10 mL 提取剂(80%甲醇),振荡摇匀,40 ℃避光超声提取30 min,取出后8 000 r/min 离心30 min,取上清液,4 ℃冰箱保存,用于多酚、总酚酸、总黄酮及抗氧化活性的测定。
采用高效液相色谱法测定多酚含量,色谱条件:色谱柱:ZORBAX SB-C18 分析柱 (4.6 mm×250 mm,5 μm);流动相:0.1%甲酸水溶液(A)和乙腈(B),梯度洗脱程序:0~15 min,10%~15% B;15~35 min,15%~30%B;35~36 min,30%~35% B;36~44 min,35%~50%B;44~45 min,50%~10% B。流速:1 mL/min,柱温:35 ℃;进样体积:10 μL;没食子酸、丁香酸、原儿茶酸的检测波长为280 nm,香豆酸、绿原酸、阿魏酸、咖啡酸、槲皮素、山奈酚的检测波长为320 nm。多酚物质采用外标法定量,其含量以mg/g 干重(mg/g dw)计。
1.4.5 总酚含量 采用Folin-Ciocalteu 法测定[11],以没食子酸作为标准样,试验结果以干重计。分别吸取0.5 mL 冰菜提取液,加入1 mL 福林酚试剂,充分振荡后静置3~4 min,加入5 mL 7.5%碳酸钠溶液,用蒸馏水定容25 mL,摇匀,40 ℃水浴30 min,以空白试剂调零,于765 nm 处测吸光值。以吸光值为纵坐标,没食子酸浓度为横坐标,绘制标准曲线。总酚含量计算:
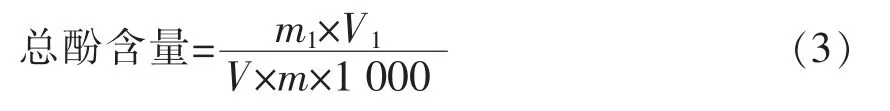
式中:m1——从标曲中查得的没食子酸的含量(mg);V1——提取液总体积(mL);V——测量时所取样品体积(mL);M——样品质量(g)。
1.4.6 总黄酮含量的测定 测定方法参考郭兴峰等[12]方法并稍作修改。取2.5 mL 提取液于25 mL刻度试管中,加入1 mL 5%亚硝酸钠,摇匀放置6 min,加1 mL10%硝酸铝,摇匀放置6 min,加入2.5 mL 4%氢氧化钠,用水定容25 mL,震荡摇匀后,室温放置15 min,使其络合完全。以空白管调零,在波长512 nm 处测吸光值。以芦丁为标准品,计算样品中总黄酮含量。
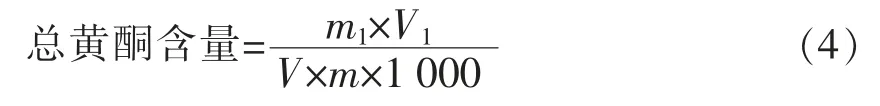
式中:m1——从标曲中查得的芦丁含量(mg);V1——提取液总体积(mL);V——测量时所取样品体积(mL);M——样品质量(g)。
1.4.7 抗氧化能力的测定 DPPH 测定方法参照尚红梅等[13]的方法并略作修改。以水溶性维生素E(Trolox)为标准品,样品DPPH 清除能力达到同样清除率所需Trolox 的质量 (mg TE/g dw) 表示(TE:Trolox equivalent)。取0.1 mL 冰菜提取液于10 mL 试管中,加入3.9 mL DPPH(0.1 mmol/L,用乙醇溶解,现配现用) 反应液,在暗处反应30 min,用乙醇调零,在波长517 nm 处测定吸光度,结果表示为mg TE/g dw。
FRAP 测定方法参照杨小兰等[14]的方法并略作修改。以水溶性维生素E (Trolox)为标准品,样品DPPH 清除能力达到同样清除率所需Trolox 的质量(mg TE/g dw)表示(TE:Trolox equivalent)。取0.1 mL 冰菜提取液于10 mL 试管中,加入3.9 mL FRAP 试剂工作液 (0.1 mol/L 醋酸缓冲试剂,10 mmol/L TPTZ 以及20 mmol/L 氯化铁按体积比10∶1∶1 混合),混匀后,37 ℃恒温水浴锅反应10 min,用乙醇调零,在波长593 nm 处测定吸光度,结果表示为mg TE/g DW。
1.5 数据统计与分析
冰菜干燥动力学模型拟合采用Origin 8.0 软件,用决定系数R2和均方根误差RMSE 来评价模型拟合效果。数据统计分析采用t-test 和SAS 8.0软件,绘图采用GraphPad Prism 6 软件,数值表示为平均值±SD。
2 结果与分析
2.1 干燥温度对冰菜的干燥特性及干燥后水分活度的影响
2.1.1 不同干燥温度下冰菜的干燥动力学模型图1是冰菜的水分变化比率随时间的干燥曲线,热风干燥温度分别为40,60,80,100,120 ℃。干燥温度越高,水分下降速度越快。在温度40,60,80,100,120 ℃下干燥,冰菜达到安全含水率(低于0.1 g 水/g 干基)的时间分别为35,9,5,4,3 h。在冰菜干燥中期,水分含量下降幅度较大,这可能是因冰菜肉质厚,水分含量高,干燥初期表面的自由水急剧扩散至烘箱内部空气中所致。随着干燥的进行,烘箱内温度逐渐向冰菜内部传递,使内部温度上升,加快了冰菜的干燥速率,且干燥温度越高,平均干燥速率越快,干燥时间越短。在热风干燥后期,高温烘干的冰菜大部分水分己散失,水分含量越来越接近其平衡含水率,因此水分扩散速度显著降低。
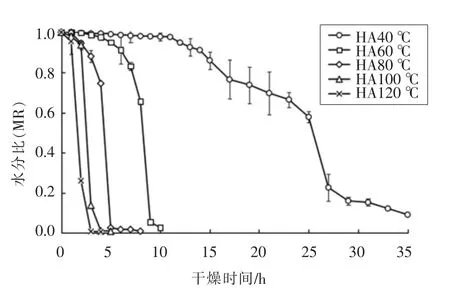
图1 不同温度下冰菜的热风干燥特性曲线Fig.1 Hot air drying characteristic curves of ice plant at different temperature
干燥过程是一个极为复杂的质量热量传递过程,与不同物料、不同外界干燥条件有着密切关系。前人通过对不同物料的多种干燥试验研究,得出多个干燥模型,用来描述干燥过程中物料水分含量随时间的变化规律[15-16]。本文采用7 个通用性较好的干燥模型,对5 组热风干燥试验进行拟合,用决定系数R2和均方根误差RMSE 对模型的拟合程度进行综合评价。通常认为R2决定着干燥模型拟合程度的优、劣,R2值在0.900~1.000 范围表示模型拟合效果较好。RMSE 表示试验数据和模型预测值的平均偏差程度,RMSE 值越小,模型的拟合效果越好。表1显示各拟合模型对应的参数值和拟合结果。在热风干燥过程中,SLogistic1 方程拟合的R2值均在0.970 以上,拟合度较高。Modified Page、Gauss Amp 和三次多项式模型能很好地拟合40,60,80 ℃的干燥曲线,不能很好地拟合100,120 ℃的干燥曲线,R2值低于0.90。虽然Modified Page 模型被广泛用于描述果蔬干燥特性[17],但是本研究发现在100,120 ℃干燥工艺中,Modified Page 模型的R2值分别为0.4033 和0.4703。综合考虑,SLogistic1 模型方程能很好地反映各温度下热风干燥冰菜的干燥规律,可较好地预测其干燥过程。
2.1.2 干燥温度对冰菜水分活度的影响 水分活度主要反映平衡状态下自由水的多少,常用于衡量微生物忍受干燥程度的能力,反映食品的稳定性,影响食品品质变化、酶活及其它生理生化的变化[18]。降低水分活度能延缓酶促和非酶褐变,有利
于食品的安全储存。不同温度干燥处理的冰菜,其水分活度有所差异(图2)。40 ℃和60 ℃烘干的冰菜水分活度分别为0.420 和0.421,80,100,120 ℃烘干冰菜的水分活度均显著低于40 ℃和60 ℃时的(P<0.05),与冻干的冰菜水分活度无显著差异(P>0.05)。

表1 冰菜的干燥数学模型表达式以及相关参数与评价指标Table 1 Expression of drying mathematical model,related parameters and evaluation index of ice plant
2.2 干燥温度对冰菜色度的影响
色泽是评价干制果蔬品质的一个重要指标。在干燥过程中,食品原料因发生物理和化学变化,故颜色也发生变化,这与干燥方式、干燥温度、物料种类等有关。由表2可知,不同温度对干燥后冰菜色度的影响差异显著(P<0.05),温度越高,红值a*,黄值b*越大。冰菜中多酚含量丰富,高温下易发生酶促褐变和非酶褐变[19]。此外,冰菜呈现的绿色来源于冰菜中的叶绿素,在干燥过程中易褪色或变色,导致冰菜由鲜绿色变为黄褐色。本研究发现,亮度L*随着干燥温度的升高呈先增大后减小的趋势,干燥温度80~100 ℃时,冰菜的亮度值最大,与冷冻干燥样品接近,存在显著显著(P<0.05)。总色差值ΔE*也呈现相同的变化趋势。冷冻干燥过程中,低温与真空的条件能有效防止物质的分解,保护了易氧化成分[19]。随着干燥温度的升高与干燥时间的延长,冰菜中的色素在高温下发生氧化,部分糖类物质发生美拉德反应,使冰菜色泽发生变化[20-21]。

图2 干燥温度对冰菜水分活度的影响Fig.2 Effect of drying temperature on water activity of ice plant
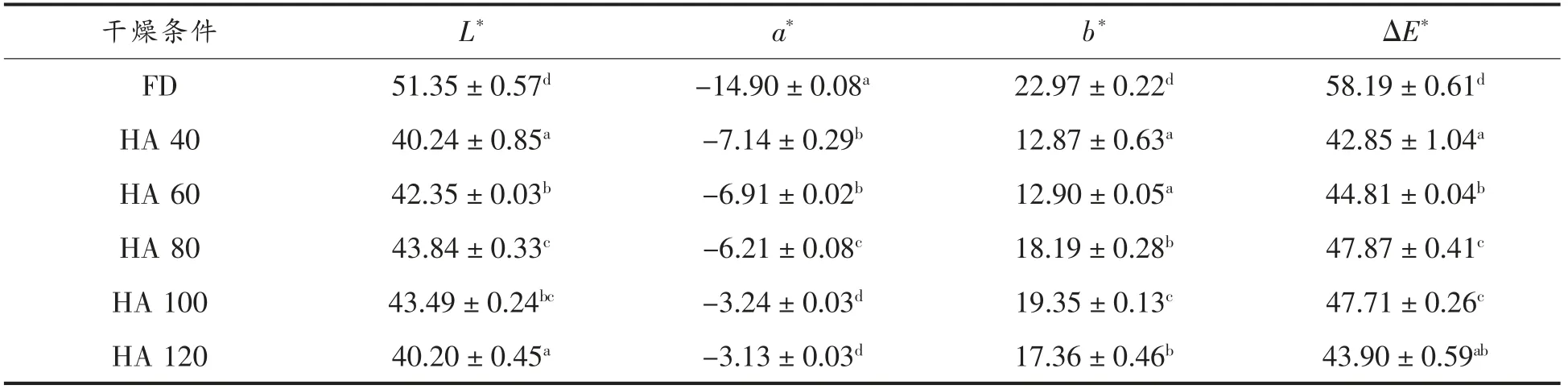
表2 干燥温度对冰菜色度的影响Table 2 Effect of drying temperature on coloring degree of ice plant
2.3 干燥温度对冰菜多酚物质的影响
采用HPLC 分析几种常见多酚类物质在冰菜中的含量。图3a,3b 为多酚混合标准品在283 nm与330 nm 处的高效液相色谱图。从冰菜样品中共检出6 种酚类物质,分别是没食子酸、原儿茶酸、绿原酸、咖啡酸、香豆酸,未检出槲皮素和山奈酚。
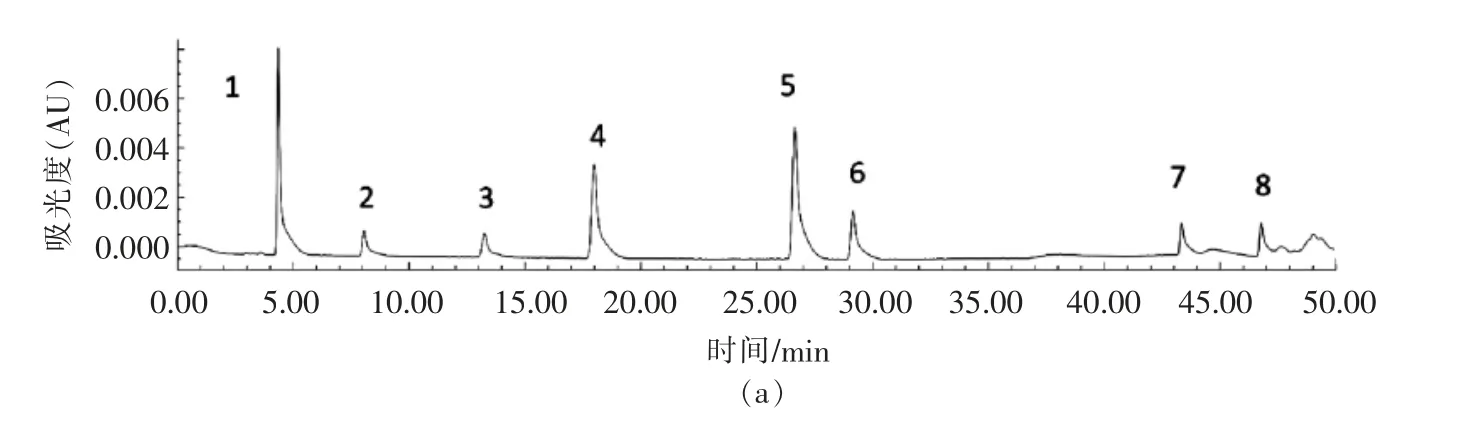
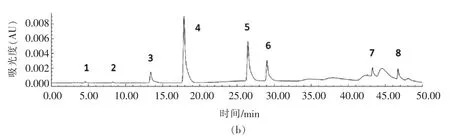
图3 多酚混合标准品色谱图Fig.3 HPLC chromatograms of phenolic acids standards
由表3可知,不同干燥方法干制冰菜中的酚酸存在差异,与冷冻干燥相比,热风干燥处理后,没食子酸、原儿茶酸、阿魏酸含量均显著增加(P<0.05)。热风处理导致冰菜中绿原酸、咖啡酸、香豆酸含量显著降低(P<0.05)。高温导致冰菜中没食子酸、原儿茶酸、阿魏酸含量发生显著增加,其可能原因是冰菜中的结合态酚酸在高温作用下转变为游离态的酚酸[22]。绿原酸、咖啡酸、香豆酸含量的下降可能是由于高温长时间处理导致其发生氧化降解。此外,不同干燥温度热风处理也导致冰菜中酚酸组成差异显著。随着热风干燥温度的上升,没食子酸含量增加,120 ℃处理时其含量为(76.96±4.95)μg/g dw。对于阿魏酸、绿原酸、咖啡酸、香豆酸,40~60 ℃热风干燥处理冰菜,其含量明显低于冷冻干燥(P<0.05),当温度升至80 ℃时,这4 类酚酸物质含量增加,而100 ℃和120 ℃处理导致其含量又降低,其中120 ℃处理后咖啡酸含量降低了97.25%。不同干燥温度样品的酚酸含量呈现较大差异,与干燥过程中的作用温度及作用时,间有关。据文献报道,当温度升到70 ℃以上时酚类物质会受热降解[13,23]。由图1干燥曲线可知,40~60 ℃处理不利于样品水分的散失,所需干燥时间较长,而长时间的热处理增大了酚酸损失。

表3 不同热风干燥温度对冰菜中酚酸的影响Table 3 Effects of different air drying temperature on the phenolic acids of ice plant
2.4 干燥温度对冰菜总酚与总黄酮的影响
黄酮类化合物广泛存在于植物中,是一类具有多种功效的功能活性物质。黄酮对温度较敏感,高温处理会影响冰菜中总黄酮的含量。如图4a 所示,冷冻干燥的冰菜总黄酮含量为2.0 mg/g dw,显著高于热风干燥处理后的各组样品(P<0.05)。随着热风干燥温度的升高,冰菜中总黄酮含量呈先下降后上升的趋势,其中40 ℃烘干冰菜的总黄酮含量为0.7 mg/g dw。随着温度的升高,总黄酮含量下降,60 ℃时降至0.5 mg/g dw,可能是因温度升高使总黄酮有所损失。当干燥温度在80 ℃以上时,黄酮含量升高,与40 ℃干燥样品无显著差异(P>0.05)。由此可见,高温使黄酮大量损失,然而温度升高,缩短了冰菜干燥的时间,短时间的高温处理减小了黄酮的损失。此结果与陈玮琦等[6]的研究结果一致。
冰菜中的多酚具有抗氧化、抑菌等多种生理活性。干燥温度对冰菜总酚含量的影响如图4b 所示,冷冻干燥的冰菜总酚含量为6.2 mg/g,显著高于热风干燥的冰菜(P<0.05)。在热风干燥条件下,冰菜总酚含量随着温度的升高呈缓慢增加后下降趋势。80 ℃干燥的冰菜总酚含量最高。研究表明酚类物质的变化与多酚氧化酶相关[24]。低温烘干时间较长,烘干过程中冰菜总酚随着时间的增加损失较多,而随着干燥温度的升高,多酚氧化酶活性降低,且烘干时间缩短。当干燥温度超过80 ℃时,总酚含量又逐渐降低,这可能与酚类物质的热敏性有关。此结果与尚红梅等[13]的研究结果相符。

图4 干燥温度对冰菜多酚与抗氧化活性的影响Fig.4 Effect of drying temperature on polyphenols and antioxidant activity of ice plant
DPPH 自由基清除能力和FRAP 铁离子抗氧化能力是最常见的抗氧化活性的评价方法。由图4c,4d 可知,冷冻干燥冰菜的DPPH 自由基清除能力和FRAP 铁离子抗氧化能力分别为24.3 mg TE/g dw 和105.0 mg TE/g dw,均显著高于热风干燥冰菜的(P<0.05)。热风干燥处理中,80 ℃干燥冰菜的抗氧化(DPPH、FRAP)能力最强,分别为16.1 mg TE/g dw 和52.8 mg TE/g dw,显著高于其它干燥温度的冰菜(P<0.05)。随着干燥温度的升高(40~80 ℃之间),冰菜清除DPPH 自由基清除能力和FRAP 铁离子抗氧化能力逐渐升高,当干燥温度高于80 ℃时,冰菜抗氧化能力开始下降。由此可见,不同热风干燥温度下,冰菜的抗氧化(DPPH、FRAP)能力与总酚、总黄酮含量变化趋势相同,说明冰菜的抗氧化活性与其中的总酚、总黄酮含量相关。
3 结论
1)热风干燥温度对冰菜的干燥时间影响显著,温度越高,达到安全含水率所需的干燥时间越短,干燥速率越大。
2)冰菜热风干燥的最优模型为SLogistic1 模型,各温度下的决定系数R2均在0.970 以上,可较好地预测其干燥过程。
3)冷冻干燥的冰菜酚类物质含量最高,抗氧化能力也最强,成本较高。80 ℃热风干燥冰菜的水分活度和色泽与冷冻干燥的最为接近,且多酚含量与抗氧化能力也显著高于其它温度处理组(P<0.05)。建议冰菜干燥采用80 ℃的热风干燥。

