黄瓜种子胎萌生理特性及相关基因表达分析
莫雨杏 王磊 周祎 孙倩楠 贺为毅 陈惠明 萧浪涛 王若仲

摘要:【目的】探明黃瓜种子胎萌发生的生理生化特性及相关基因的表达模式,为揭示双子叶蔬菜类作物的胎萌发生机制提供理论依据。【方法】以黄瓜高代自交系Cs10A(易胎萌)和M-1(不胎萌)为试验材料,分别在授粉后30、35、40、45和50 d进行取样,统计黄瓜种子胎萌率,测定并分析种子中可溶性糖、脂肪酸、主要植物激素[脱落酸(ABA)和赤霉素(GA3)]含量及胎萌相关基因的表达模式。【结果】Cs10A种子在授粉后40 d发生胎萌,胎萌率为4.2%;在授粉后45和50 d Cs10A种子胎萌率极显著高于M-1(P<0.01,下同),分别为28.4%和71.1%。M-1授粉后30~50 d均未出现胎萌现象。授粉后30~50 d,Cs10A种子内可溶性糖含量呈先增加后降低的变化趋势,尤其在授粉后35~45 d显著(P<0.05,下同)或极显著高于M-1种子,而M-1种子可溶性糖含量呈增加─降低─增加的变化趋势。授粉后30~50 d,Cs10A种子脂肪酸含量呈先降低后增加的变化趋势,而M-1种子脂肪酸含量变化不明显,仅后期稍有增加,且在授粉后40 d时二者的脂肪酸含量非常接近,其他时间均存在极显著差异。授粉后50 d,Cs10A种子和囊衣中的ABA含量均极显著低于M-1;Cs10A种子和囊衣中的GA3含量均低于M-1,其中Cs10A囊衣中的GA3含量极显著低于M-1,但其种子中的GA3含量与M-1无显著差异(P>0.05);Cs10A种子中的GA3含量高于囊衣。Cs10A种子中ABA/GA3比值低于M-1种子。授粉后30~50 d,Cs10A种子中CsVp1、CsVp5和CsVp10基因的表达量均极显著低于M-1,其中,对于CsVp1和CsVp5基因表达模式而言,Cs10A与M-1恰好相反,但CsVp10基因在二者中的表达模式相同。【结论】种子发育成熟至发生胎萌前,种子中可溶性糖含量较高、ABA含量和ABA/GA3比值较低易导致种子发生胎萌,且种子中脂肪酸可转化成可溶性糖为种子胎萌的发生提供能源物质;囊衣中高含量ABA可有效抑制黄瓜种子胎萌的发生。此外,易胎萌黄瓜品种通过抑制与ABA合成及其敏感性相关的胎萌基因表达,从而降低ABA含量及对ABA的敏感性,最终导致胎萌发生。
关键词: 黄瓜;种子胎萌;可溶性糖;脂肪酸;ABA;生理特性;胎萌相关基因
中图分类号: S642.203.8 文献标志码: A 文章编号:2095-1191(2020)09-2090-07
Physiological characteristics and related gene expression of vivipary in cucumber seeds
MO Yu-xing1, WANG Lei1, ZHOU Yi1, SUN Qian-nan1, HE Wei-yi1,
CHEN Hui-ming2, XIAO Lang-tao1, WANG Ruo-zhong1*
(1Hunan Provincial Key Laboratory of Phytohormones and Growth Development,Hunan Agricultural University,Changsha 410128, China; 2Hunan Vegetable Research Institute, Hunan Academy of Agricultural Sciences,
Changsha 410125, China)
Abstract:【Objective】This paper found out the physiological and biochemical characteristics and related gene expression patterns of vivipary in cucumber(Cucumis sativus L.),with a view to provide reference for revealing the mechanism of the occurrence of vivipary of dicotyledonous vegetable crops. 【Method】Taking cucumber high generation inbred lines Cs10A(easy vivipary) and M-1(uneasy vivipary) as materials,samples were taken at 30,35,40,45 and 50 d after pollination,and the viviparous germination rate of cucumber seeds was counted. This paper compared and analyzed the content of soluble sugar,fatty acid,main plant hormones[abscisic acid (ABA) and gibberellin(GA3)] and related gene expressions of cucumber after different pollination days. 【Result】Vivipary of Cs10A seeds occurred around 40 d after pollination,with a viviparous germination rate of 4.2%. The viviparous germination rates of Cs10A seeds were extremely higher than those of M-1 seeds at 45 and 50 d after pollination(P<0.01, the same below), which were 28.4% and 71.1%, respectively. M-1 had no vivipary phenomenonat 30 and 50 d after pollination. The soluble sugars content of Cs10A seeds genera-lly showed a trend of rising first and then decreasing in 30-50 d after pollination. The soluble sugars of Cs10A seeds in 35-45 d after pollination were significantly(P<0.05, the same below) or extremely higher than seeds of M-1. The soluble sugar content in M-1 seeds showed an increasing-decreasing-increasing trend. The fatty acid content of Cs10A seeds showed a trend of falling first and then rising in 30-50 dafter pollination,while M-1 did not change much in the whole process,and showed a slow upward trend in the later period. At 40 d after pollination, the fatty acid content of seeds in both species were very close,and there were extremely significant differences at other times. At 50 d after pollination,the content of ABA of seeds and capsules in Cs10A were extremely lower than M-1. The GA3 content in seeds and capsules of Cs10A were lower than M-1, and the GA3 content in capsules of Cs10A was extremely lower than M-1, but the GA3 content in its seeds was not significantly different from M-1(P>0.05). The GA3 content in seeds of Cs10A was higher than that in the capsule. The ratio of ABA/GA3 in seeds of Cs10A was lower than M-1. The expression levels of the vivipary-related genes CsVp1,CsVp5 and CsVp10 of seeds in Cs10A were extremely lower than those in M-1 in 30-50 d after pollination. Among them,the gene expression patterns of CsVp1 and CsVp5 in Cs10A and M-1 were exactly the opposite, but the gene expression patterns of CsVp10 in both were the same. 【Conclusion】This study shows that the higher content of soluble sugar,lower content of ABA and lower ABA/GA3 value in seeds during seed mature and before viviparyare closely related to the occurrence of seed vivipary. And the fatty acids in seeds can be converted into soluble sugars to provide energy for the occurrence of vivipary. The high content of ABA in the capsule can effectively suppress the occurrence of vivipary. Moreover,the cucumber with easy vivipary can reduce the content and sensitivity of ABA by inhibiting the expression of viviparous germination genes related to the synthesis and sensitivity of ABA,which leads to the occurrence of vivipary eventually.
Key words: cucumber; seed vivipary; soluble sugars; fatty acids; ABA; physiological characteristics; vivipary related gene
Foundation item: National Natural Science Foundation of China(31871714,31671777); Key Scientific Research Project of Hunan Provincial Department of Education(19A221); Changsha Science and Technology Planning Project(kq1907041)
0 引言
【研究意义】黄瓜(Cucumis sativus L.)为葫芦科一年生蔓生或攀援草本植物,其优质种子是高效生产栽培的重要保证。但在黄瓜制种过程中,种子发育成熟后不经脱水干燥直接在母体植株上萌发(采前发芽或胎萌)而导致制种产量及质量降低,极大影响黄瓜优质品种的推广(曹明明等,2016)。因此,研究影响黄瓜胎萌发生的生理生化特性及相关基因的表达变化,对揭示双子叶蔬菜类作物胎萌的发生机制具有重要意义。【前人研究进展】禾本科谷类作物如玉米(Zea mays L.)(Maluf et al.,1997)、小麦(Triticum aestivum L.)(杨燕等,2007)和水稻(Oryza sativa L.)(高永峰等,2010)等存在采前发芽现象,又称为穗萌;葫芦科、茄科等瓜果类作物如黄瓜(曹明明等,2016)、番茄(Solanum lycopersicum)(王旭,2016)和甜瓜(C. melo L.)(刘文君等,2017)等则存在胎萌现象。高温、高湿及化学物质是导致胎萌或穗萌发生的主要因素,发生期间遗传物质和植物激素发挥着重要作用(张会杰等,2018)。大量研究表明,大部分作物胎萌或穗萌突变体均与脱落酸(ABA)敏感性或生物合成有关(Fang and Chu,2008),如玉米Viviparous(Vp)基因的突变体vp1(Mccarty et al.,1991)、vp14(Schwartz et al.,1997b)、vp5(Hable et al.,1998)、vp7(Singh et al.,2003)、vp10/vp13(Porch et al.,2006)和vp15(Suzuki et al.,2006),拟南芥(Arabidopsis thaliana)的aba1、aba2和aba3突变体(Schwartz et al.,1997a),水稻的phs1~phs4突变体(Fang et al.,2008;Fang and Chu,2008)。胎萌现象在黄瓜制种过程中普遍存在,且不同品种的胎萌性状差异明显,如授粉后34 d,品种S6腔内种子发生胎萌,但品种P1未出现胎萌;授粉45 d后,品种S6胎萌率仅为30%,而品种P1胎萌率高达80%以上(庞金安等,2002;曹明明等,2016)。经研究证实,黄瓜胎萌发生受环境因素影响较小,主要受遗传基因的影响,且其遗传模式符合D-1模型(庞金安等,2002;曹明明等,2018)。【本研究切入点】目前,关于黄瓜胎萌发生机制的相关研究主要是简单分析影响黄瓜胎萌发生的因素及其遗传模式,而针对胎萌生理生化特性、分子机制等方面研究鲜有报道。【拟解决的关键问题】以易胎萌黄瓜品种Cs10A和不胎萌品种M-1为研究对象,比较种子中可溶性糖和脂肪酸含量的动态变化及种子和囊衣(包裹种子的胶原物质)中ABA、赤霉素(GA)等主要植物激素水平,并结合同源胎萌相关基因Vp1、Vp5和Vp10的差异表达分析,揭示黄瓜胎萌发生的生理生化及分子机制,为深入探究双子叶蔬菜类作物的胎萌发生机制提供理论依据。
1 材料与方法
1. 1 试验材料
供试黄瓜品种包括高代自交系Cs10A(易胎萌)和M-1(不胎萌),由湖南省蔬菜研究所陈惠明老师惠赠提供。主要试剂:正己烷和甲醇均为高效液相色谱(HPLC)级,购自德国默克公司;DNA Marker、2×Easy Taq? PCR SuperMix、TransZol Up Plus RNA试剂盒和反转录试剂盒购自北京全式金生物技术有限公司;2×SYBR Green qPCR Master Mix试剂盒购自南京诺唯赞生物科技有限公司;其他生化试剂均购自生工生物工程(上海)股份有限公司。主要设备仪器:G6400系列超高效液相色谱串联三重四极杆质谱仪(Agilent,美国)、GCMS-TQ8040气相色谱质谱联用仪(Shimadzu,日本)、凝胶成像系统(ProteinSimple,美国)、CFX96/CFX Connect/384定量PCR仪(Bio-Rad,美国)和多功能酶标仪(Tecan,瑞士)。
1. 2 试验方法
1. 2. 1 种植及样品采集 黄瓜种植于湖南农业大学温室大棚,按常规栽培进行田间管理。每个品种均在授粉后第30 d开始取样,每隔5 d采集9个大小一致的种瓜,共5次。每次采集的样品随机分成3份,将种子和囊衣用液氮处理后,-80 ℃保存备用。
1. 2. 2 胎萌率测定 待种子成熟后(约开花授粉后30 d)连续进行剖瓜观察,每隔5 d统计1次胎萌率,计算公式:
胎萌率(%)=胎萌种子数/種子总数×100
1. 2. 3 可溶性糖和脂肪酸含量测定 取开花授粉后30、35、40、45和50 d的种子,每组重复3次,其可溶性糖含量通过蒽酮比色法进行测定;采用植物激素与生长发育湖南省重点实验室建立的气相色谱法检测脂肪酸含量:将研磨的种子用浸提液(甲醇∶浓硫酸=95∶1,v/v)进行63 ℃过夜处理,加入正己烷溶液,充分摇匀,离心后取上清液备用,利用GCMS-TQ8040气相色谱质谱联用仪进行测定,进样量为1 μL,分流进样,进样口温度为240 ℃。
1. 2. 4 ABA和GA3含量测定 采用植物激素与生长发育湖南省重点实验室建立的液相色谱—质谱联用法(LC-MS/MS)测定ABA和GA3含量:取开花授粉后50 d的种子和囊衣,每组重复3次,加入液氮迅速研磨至粉末状,用80%甲醇于4 ℃下浸提过夜,重复浸提1次后合并上清液,真空浓缩干燥后备用,利用G6400系列超高效液相色谱串联三重四极杆质谱仪进行测定,流动相成分为甲酸和乙腈溶液,进样量为10 μL,柱温40 ℃,走样时间26 min。
1. 2. 5 实时荧光定量PCR 从NCBI数据库下载玉米胎萌基因Vp1、Vp5和Vp10序列,并进行同源搜索,最终获得黄瓜同源基因CsVp1(LOC101214226)、CsVp5(LOC101210522)和CsVp10(LOC101214811),利用Primer 5.0设计实时荧光定量PCR扩增引物,如表1所示。取开花授粉后30、35、40、45和50 d的种子,利用RNA提取试剂盒提取其总RNA。经多功能酶标仪检测RNA浓度后,使用反转录试剂盒反转录合成cDNA,以其为模板,采用实时荧光定量PCR检测CsVp1、CsVp5和CsVp10基因的表达情况,以黄瓜Actin为内参基因(AB010922.1)。反应体系10.0 ?L:2×ChamQ Universal SYBR qPCR Master Mix 5.0 ?L,10 ?mol/L上、下游引物各0.2 ?L,cDNA模板0.4 ?L,用ddH2O补足至10.0 ?L。每个基因重复3次。扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,进行45个循环。采用2-ΔΔCt方法计算各目的基因的相对表达量。
1. 3 统计分析
试验数据采用Excel 2010进行整理统计,以GraphPad Prism 6制图,采用SPSS 18.0进行显著性分析。
2 结果与分析
2. 1 不同黄瓜种子胎萌表型的差异比较结果
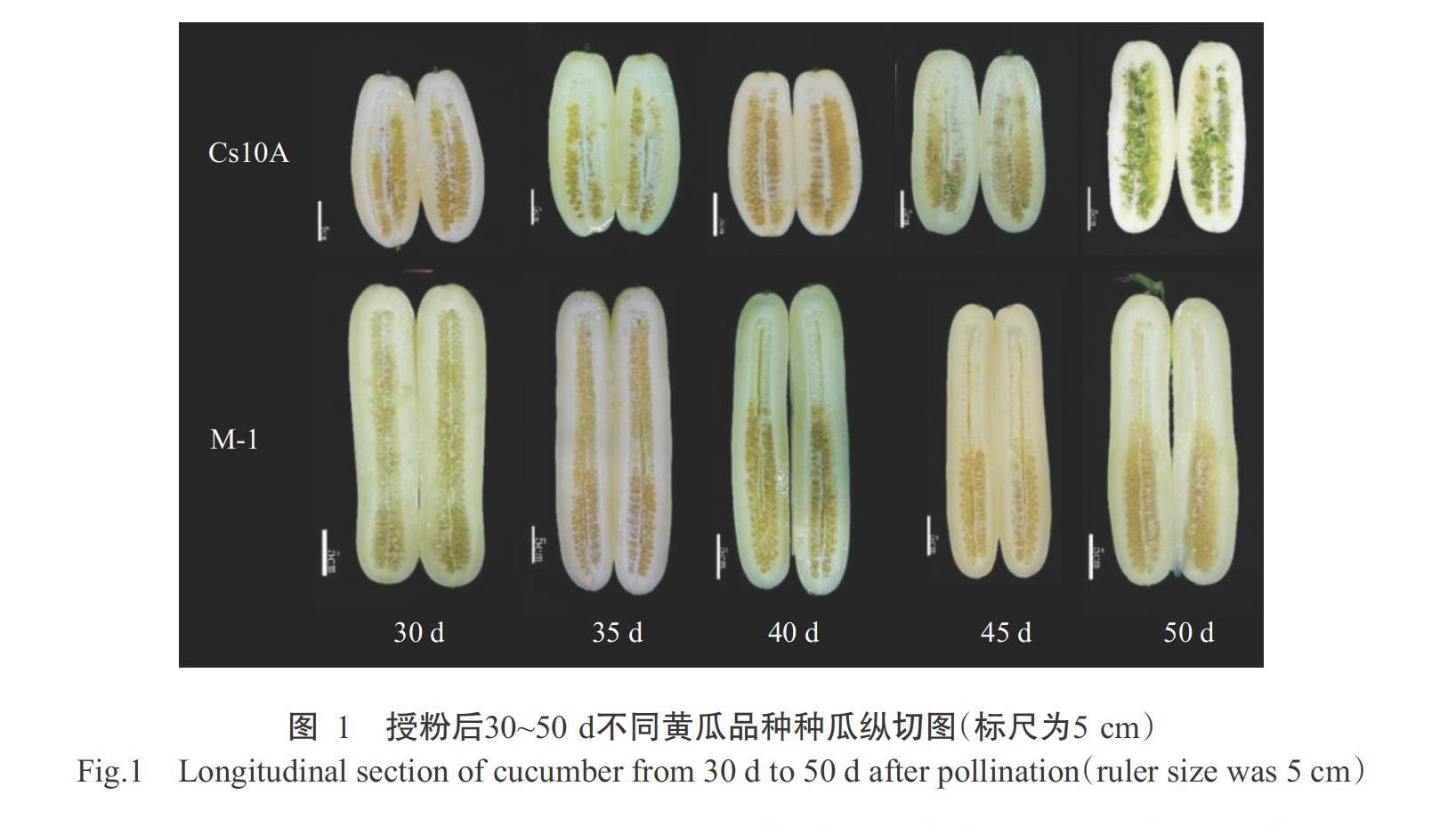
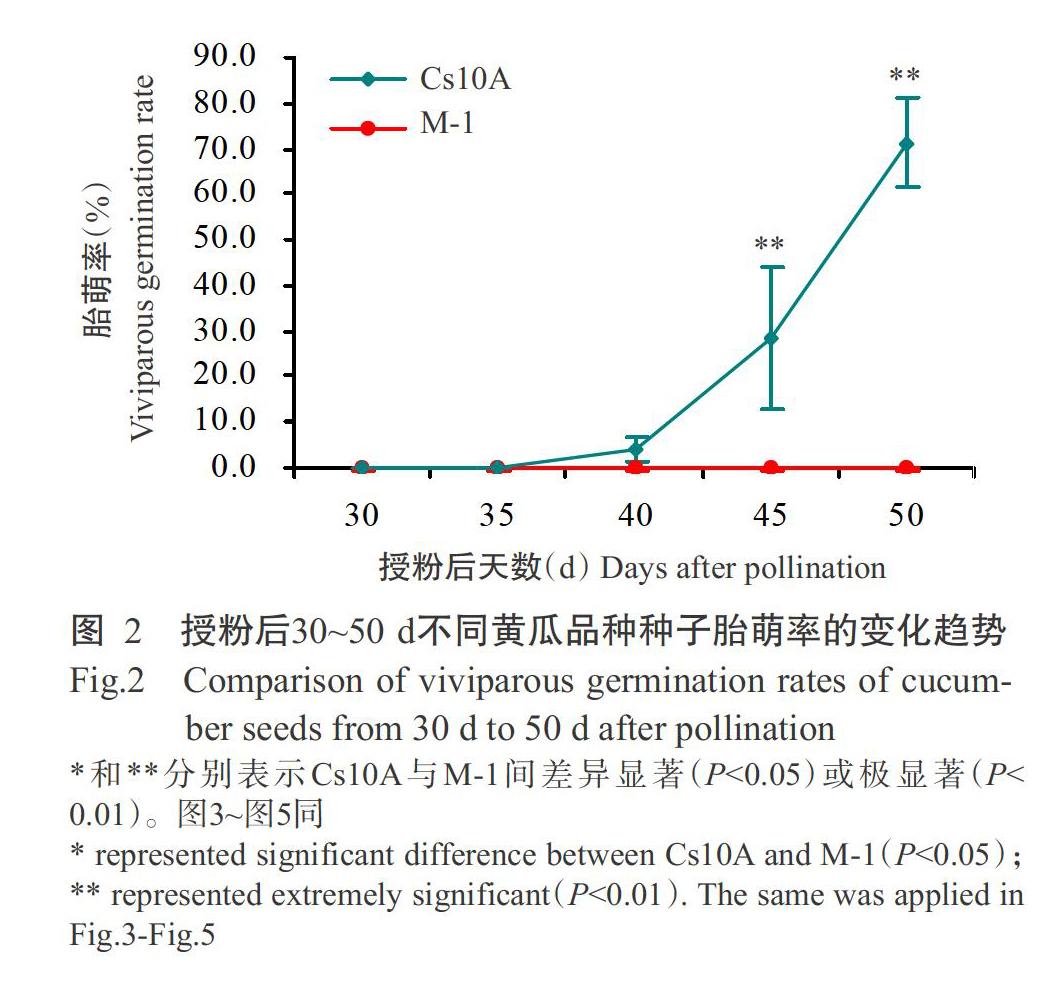
由图1可知,授粉后30~50 d,Cs10A种子在果实内明显萌发,M-1种子在果实内则未萌发。由图2可知,Cs10A种子在授粉后40 d发生胎萌,胎萌率为4.2%;随着授粉后天数的增加,Cs10A种子胎萌现象逐渐明显,在授粉后45和50 d其胎萌率极显著高于M-1(P<0.01,下同),在授粉后45 d发生胎萌的种子胚根明显伸长,胎萌率达28.4%;授粉后50 d胎萌率急剧升高,达71.1%,此时大部分种子长出须根,且子叶转绿。M-1授粉后30~50 d均未出现胎萌现象。
2. 2 黄瓜种子可溶性糖和脂肪酸含量的动态变化
由图3-A可知,授粉后30~50 d,Cs10A种子可溶性糖含量呈先增加后降低的变化趋势,尤其在授粉后35~45 d其显著(P<0.05,下同)或极显著高于M-1种子,分别是M-1种子的1.07、1.14和1.19倍,但授粉后50 d低于M-1种子,未达显著水平(P>0.05,下同)。M-1种子可溶性糖含量呈增加─降低─增加的变化趋势,授粉后50 d明显增加。由图3-B可知,授粉后30~50 d,Cs10A种子脂肪酸含量呈先降低后增加的变化趋势,而M-1种子脂肪酸含量变化不明显,仅后期稍有增加,且在授粉后40 d时Cs10A与M-1的种子脂肪酸含量非常接近,其他时间均存在极显著差异。由此可见,易胎萌种子脂肪酸含量与可溶性糖含量的变化趋势相反;易胎萌种子可溶性糖含量较不胎萌种子高,且种子发育成熟至发生胎萌前易胎萌种子的脂肪酸含量较不胎萌种子高,但发生胎萌后易胎萌种子中的脂肪酸转化为可溶性糖从而导致其含量下降。
2. 3 黄瓜种子和囊衣中ABA及GA3含量的动态变化
由图4-A可知,授粉后50 d,Cs10A種子和囊衣中的ABA含量均极显著低于M-1,Cs10A和M-1囊衣中的ABA含量分别是其种子的1.46和3.17倍。由图4-B可知,Cs10A种子和囊衣中的GA3含量均低于M-1,其中Cs10A囊衣中的GA3含量极显著低于M-1,但其种子中的GA3含量与M-1无显著差异;Cs10A种子中的GA3含量是囊衣中GA3含量的1.44倍。对授粉后50 d黄瓜种子中的ABA/GA3比值进行比较,结果(图4-C)发现Cs10A种子中的ABA/GA3比值明显低于M-1。由此推测,黄瓜种子和囊衣中ABA含量及种子中ABA/GA3比值越低则越易发生胎萌。
2. 4 黄瓜种子胎萌相关基因表达分析结果
为了从分子层面解析黄瓜种子胎萌的生理特性,对Cs10A和M-1种子胎萌相关基因CsVp1、CsVp5和CsVp10进行表达分析,结果如图5所示。在授粉后种子发育成熟至发生胎萌的整个过程(授粉后30~50 d)中,Cs10A种子中CsVp1、CsVp5和CsVp10基因的相对表达量均极显著低于M-1。不同的是,Cs10A种子CsVp1基因相对表达量随授粉后天数的增加呈逐渐降低趋势,而M-1种子CsVp1基因相对表达量整体上呈升高趋势(除授粉后30 d外)。随着授粉后天数的增加,Cs10A种子中CsVp5基因相对表达量呈先升高后降低的变化趋势,而M-1种子中CsVp5基因相对表达量呈先降低后升高的变化趋势。CsVp10基因作为Cs10A和M-1种子的同源胎萌基因,在二者中的相对表达量均随授粉后天数的增加而升高。由此推测,易胎萌黄瓜种子通过抑制与ABA合成及其敏感性有关的胎萌基因表达,从而降低ABA含量及对ABA的敏感性,最终导致胎萌发生。
3 讨论
3. 1 黄瓜内源生理生化指标变化与胎萌发生的关系
可溶性糖是参与种子萌发代谢的主要物质,为种子萌发和胚生长提供能量(孙建等,2020)。杨浚等(1991)研究发现,在水稻种子发育过程中可溶性糖含量越高,且维持时间越长,越易出现穗萌现象。倪万潮等(2020)研究表明,籽粒内可溶性糖含量较高时可促进种子萌发。本研究以黄瓜易胎萌品种Cs10A和不胎萌品种M-1为试验材料,结果发现授粉后30~45 d易胎萌品种Cs10A种子的可溶性糖含量较不胎萌品种M-1高,说明可溶性糖作为能源物质,其含量越高越易发生胎萌,而在授粉后50 d,Cs10A种子中的可溶性糖含量明显下降,其原因可能是胎萌消耗大量可溶性糖,种子的子叶舒展,叶片转绿,腔内种子已由种子萌发阶段进入到营养生长阶段。脂肪在植物种子中具有储存能量、提高抗逆性及增加膜流动性等功能。在种子萌发过程,脂肪先转化形成脂肪酸,再转化成可溶性糖为种子萌发提供能量(赵明等,2018)。本研究发现,易胎萌品种Cs10A种子在发生胎萌前,其脂肪酸含量维持在较高水平,且含量变化趋势与可溶性糖相反,说明胎萌黄瓜种子脂肪酸被转化为可溶性糖,进而为胎萌提供充足的营养物质和能量。因此,种子内高含量的可溶性糖和脂肪酸是导致黄瓜种子胎萌的生理原因之一,说明在筛选抗胎萌黄瓜品种过程中,种子内可溶性糖和脂肪酸含量可作为选育指标之一。
3. 2 黄瓜种子、囊衣中ABA和GA3含量与胎萌发生的关系
植物激素对植物的生长发育起着重要调节作用。在众多植物激素中,ABA和GA3被认为是调节种子休眠和萌发的主要植物激素(徐恒恒等,2014)。本研究发现,易胎萌品种Cs10A种子中的ABA含量及ABA/GA3比值均低于不胎萌品种M-1种子,与李聪聪(2017)研究发现西葫芦出现胎萌现象与种子内较低的ABA含量及ABA/GA3比值等密切相关的结果相符。与单子叶谷类作物相比,双子叶瓠果、浆果类作物果实肥厚多汁,种子处于湿润环境,如黄瓜和番茄等种子被一层胶质黏膜(囊衣)所包裹,由于囊衣中含有内源的发芽抑制物质,不易导致胎萌的发生。王旭(2016)研究发现,番茄种子表面胶原物质含有的ABA能抑制种子萌发。本研究中易胎萌品种Cs10A囊衣中的ABA含量显著低于M-1,不胎萌品种M-1囊衣中的ABA含量较高,从而抑制种子胎萌的发生,与在番茄中的研究结果(王旭,2016)相似。本研究还发现,Cs10A囊衣中的GA3含量低于M-1,推测GA3含量不能促进种子胎萌,或低含量的GA3不能抵消ABA的抑制作用而导致种子胎萌,具体原因有待进一步探究。
3. 3 黄瓜种子胎萌相关基因表达与胎萌发生的关系
玉米vp1突变体是典型的ABA不敏感型突变体,由于ABA信号不能往下游传递,因此该突变体几乎不会发生休眠,而在脱离母体前就发生胎萌(Mccarty et al.,1991)。韦飞严等(2015)研究发现,易穗萌水稻品种的OsVp1基因表达量较不穗萌水稻品种高。在本研究中,随授粉后天数的增加,易胎萌品种Cs10A种子中CsVp1基因相对表达量不断下调,但不胎萌品种M-1种子中CsVp1基因相对表达量不断上调,与韦飞严等(2015)的研究结果相似。玉米vp5突变体则通过抑制八氢番茄红素脱氢酶合成来抑制ABA合成,从而导致种子在母体植株上提前萌发(Hable et al.,1998);在玉米vp10突变体中ABA醛无法氧化成ABA,而出现明显的胎萌现象(Porch et al.,2006)。本研究还发现,随着授粉后天数的增加,Cs10A种子中CsVp5和CsVp10基因相对表达量显著低于M-1,说明易胎萌黄瓜通过抑制与ABA合成及其敏感性有关的胎萌基因表达量,从而降低ABA含量及对ABA的敏感性,最终导致胎萌发生。
目前,关于瓜果蔬菜类作物的胎萌现象研究较少,开展黄瓜胎萌研究可为揭示双子叶蔬菜类作物的胎萌发生机制提供理论依据。但本研究仅从生理生化及相关基因的表达模式等方面对黄瓜胎萌进行分析,今后应利用测序技术定位黄瓜胎萌基因,从而分析黄瓜胎萌的分子遗传机制。此外,囊衣中是否含有其他内源抑制胎萌物质尚待进一步研究。
4 结论
种子发育成熟至发生胎萌前,种子中可溶性糖含量较高、ABA含量和ABA/GA3比值较低易导致种子发生胎萌,且种子中脂肪酸可转化成可溶性糖为种子胎萌的发生提供能源物质;囊衣中高含量的ABA可有效抑制黄瓜种子胎萌的发生。此外,易胎萌黄瓜品种通过抑制与ABA合成及其敏感性相关的胎萌基因表达,从而降低ABA含量及对ABA的敏感性,最终导致胎萌发生。
参考文献:
曹明明,管炜,王惠哲,邓强,李淑菊,杨瑞环. 2016. 黄瓜种子采前发芽的研究进展[J]. 天津农业科学,22(2):127-130. [Cao M M,Guan W,Wang H Z,Deng Q,Li S J,Yang R H. 2016. Research progress of cucumber seeds pre-harvest sprouting[J]. Tianjin Agricultural Sciences,22(2):127-130.]
曹明明,王惠哲,邓强,杨瑞环,李淑菊. 2018. 黄瓜种子采前发芽性状的数量遗传分析[J]. 中国蔬菜,(1):34-38. [Cao M M,Wang H Z,Deng Q,Yang R H,Li S J. 2018. Quantitative genetic analysis of pre-harvest sprouting in cucumber[J]. China Vegetables,(1):34-38.]
高永峰,刘继恺,范晶,彭奕,黃科,张敦房,刘永胜. 2010. 水稻穗发芽调控基因OsVP1的RNA干涉载体构建及遗传转化研究[J]. 中国农业科学,43(7):1321-1327. [Gao Y F,Liu J K,Fan J,Peng Y,Huang K,Zhang D F,Liu Y S. 2010. Construction and transformation of RNAi vector of OsVP1 for a regulatory gene of pre-harvest sprouting in Oryza sativa[J]. Scientia Agricultura Sinica,43(7):1321-1327.]
李聪聪. 2017. 西葫芦种子胎萌特性研究[D]. 泰安:山东农业大学. [Li C C. 2017. Study on the vivipary characteri-stics of summer squash seed[D]. Taian:Shandong Agricultural University.]
刘文君,周建辉,黄凤婵,张曼,范爱丽,高忠奎,陈宝玲. 2017. 厚皮甜瓜腔内种子的生长发育规律[J]. 南方农业学报,48(8):1448-1451. [Liu W J,Zhou J H,Huang F C,Zhang M,Fan A L,Gao Z K,Chen B L. 2017. Growth and development regulation of intracavity seeds in muskmelon[J]. Journal of Southern Agriculture,48(8):1448-1451.]
倪万潮,束红梅,郭书巧,蒋璐,何晓兰,崔晓霞,巩元勇. 2020. 不同水稻品种种子萌发生理特性差异研究[J]. 中国农学通报,36(2):1-5. [Ni W C,Shu H M,Guo S Q,Jiang L,He X L,Cui X X,Gong Y Y. 2020. Seed germination of rice cultivars:Differences in physiological cha-racteristics[J]. Chinese Agricultural Science Bulletin,36(2):1-5.]
庞金安,李怀智,马德华. 2002. 蔬菜作物种子采前发芽研究进展[J]. 天津农业科学,8(3):42-46. [Pang J A,Li H Z,Ma D H. 2002. Progress on preharvest sproution of vegetable crops[J]. Tianjin Agricultural Sciences,8(3):42-46.]
孙建,周红英,乐美旺,颜廷献,饶月亮,颜小文,梁俊超,叶艳英. 2020. 芝麻种子萌发动态及其代谢生理变化研究[J]. 中国农业科技导报,22(4):76-83. [Sun J,Zhou H Y,Le M W,Yan T X,Rao Y L,Yan X W,Liang J C,Ye Y Y. 2020. Germination dynamics and physiological changes of metabolism in sesame seed[J]. Journal of Agricultural Science and Technology,22(4):76-83.]
王旭. 2016. 番茄rin突变体胎萌的生理机制及rin基因在胎萌中的作用[D]. 哈尔滨:东北农业大学. [Wang X. 2016. Physiological mechanism of vivipary in rin mutant tomato and role of rin in vivipary[D]. Harbin:Northeast Agricultural University.]
韋飞严,田继微,孟祥伦,武小金. 2015. 水稻穗萌抗性与OsVP1基因启动子序列及其表达水平的关系[J]. 杂交水稻,30(6):59-63. [Wei F Y,Tian J W,Meng X L,Wu X J. 2015. Relation of pre-harvest sprouting resistance in rice to the promoter sequence and expression of gene[J]. Hybrid Rice,30(6):59-63.]
徐恒恒,黎妮,刘树君,王伟青,王伟平,张红,程红焱,宋松泉. 2014. 种子萌发及其调控的研究进展[J]. 作物学报,40(7):1141-1156. [Xu H H,Li N,Liu S J,Wang W Q,Wang W P,Zhang H,Cheng H Y,Song S Q. 2014. Research progress in seed germination and its control[J],Acta Agronomica Sinica,40(7):1141-1156.]
杨浚,陆建飞,俞炳杲,张传贤,王国忠. 1991. 水稻穗发芽与籽粒内可溶性糖和α-淀粉酶活性的品种差异[J]. 南京农业大学学报,14(1):17-21. [Yang J,Lu J F,Yu B G,Zhong C X,Wang G Z. 1991. Soluble sugar level and alpha-amylase activity in grains of some rice varieties with distinguishable viviparity during grain developing[J]. Journal of Nanjing Agricultural University,14(1):17-21.]
杨燕,张春利,何中虎,夏兰芹. 2007. 小麦抗穗发芽研究进展[J]. 植物遗传资源学报,8(4):503-509. [Yang Y,Zhang C L,He Z H,Xia L Q. 2007. Advances on resistance to pre-harvest sprouting in wheat[J]. Journal of Plant Genetic Resources,8(4):503-509.]
赵明,张红香,颜宏,邱璐. 2018. 种子贮藏物质与萌发的关系[J]. 土壤与作物,7(2):189-200. [Zhao M,Zhang H X,Yan H,Qiu L. 2018. Relationship between seed storage reserve and seed germination[J]. Soils and Crops,7(2):189-200.]
张会杰,翟荣荣,叶胜海,朱国富,王俊梅,朱英,张小明. 2018. 水稻穗发芽及其调控机制研究进展[J]. 分子植物育种,16(12):4106-4111. [Zhang H J,Zhai R R,Ye S H,Zhu G F, Wang J M, Zhu Y, Zhang X M. 2018. Research advance on pre-harvest sprouting and its regulation mechanism in rice[J]. Molecular Plant Breeding,16(12):4106-4111.]
Fang J,Chai C,Qian Q,Li C L,Tang J Y,Sun L,Huang Z J,Guo X L,Sun C H,Liu M,Zhang Y,Lu Q T,Wang Y Q,Lu C M,Han B,Chen F,Cheng Z K,Chu C C. 2008. Mutations of genes in synthesis of the carotenoid precursors of ABA lead to pre-harvest sprouting and photo-oxidation in rice[J]. The Plant Journal,54(2):177-189.
Fang J,Chu C C. 2008. Abscisic acid and the pre-harvest sprouting in cereals[J]. Plant Signaling Behavior,3(12):1046-1048.
Hable W E,Oishi K K,Schumaker K S. 1998. Viviparous-5 encodes phytoene desaturase,an enzyme essential for abscisic acid(ABA) accumulation and seed development in maize[J]. Molecular & General Genetics MGG,257(2):167-176.
Maluf M P,Saab I N,Wurtzel E T,Sachs M M. 1997. The viviparous12 maize mutant is deficient in abscisic acid,carotenoids,and chlorophyll synthesis[J]. Journal of Experi-mental Botany,48(311):1259-1268.
Mccarty D R,Hattori T,Carson C B,Vasil V,Lazar M,Vasil I K. 1991. The Viviparous-1 developmental gene of maize encodes a novel transcriptional activator[J]. Cell,66(5):895-905.
Porch T G,Tseung C W,Schmelz E A,Settles A M. 2006. The maize Viviparous10/Viviparous13 locus encodes the Cnx1 gene required for molybdenum cofactor biosynthesis[J]. Plant Journal for Cell & Molecular Biology,45(2):250-263.
Schwartz S H,Léon-Kloosterziel K M,Koornneef M,Zee-vaart J A. 1997a. Biochemical characterization of the aba2 and aba3 mutants in Arabidopsis thaliana[J]. Plant Physiology,114(1):161-166.
Schwartz S H,Tan B C,Gage D A,Zeevaart J A,Mccarty D R. 1997b. Specific oxidative cleavage of carotenoids by VP14 of maize[J]. Science,276(5320):1872-1874.
Singh M,Lewis P E,Hardeman K,Bai L,Rose J K C,Mazourek M,Chomet P,Brutnell T P. 2003. Activator mutagene-sis of the pink scutellum1/viviparous7 locus of maize[J]. The Plant Cell,15(4):874-884.
Suzuki M,Settles A M,Tseung C W,Li Q B,Latshaw S,Wu S,Porch T G,Schmelz E A,James M G,Mccarty D R. 2006. The maize viviparous15 locus encodes the molybdopterin synthase small subunit[J]. The Plant Journal,45(2):264-274.
(責任编辑 陈 燕)

