西班牙河碳酸盐岩对茶园土壤状况和土壤细菌群落的影响
赵 茜,施龙清,黄世勇,丁鲁平,Liette Vasseur,杨 广*
(1. 闽台作物有害生物生态防控国家重点实验室/福建农林大学应用生态研究所,福建 福州 350002;2. 福建农林大学教育部害虫生态防控国际合作联合实验室,福建 福州 350002;3. 农业农村部闽台作物有害生物综合治理重点实验室,福建 福州350002;4. 害虫绿色防控福建省高等学校重点实验室,福建 福州 350002;5. 福建省农业科学院水稻研究所,福建 福州 350019;6. 武夷山市种子站,福建 武夷山 354300;7. 博莱生态农业科技有限公司,北京 100000;8. 加拿大布鲁克大学生物科学系,安大略 圣凯瑟琳斯 L2S3A1)
0 引言
【研究意义】福建省是中国乌龙茶之乡,是名茶铁观音、武夷岩茶的发源地,位居中国重点产茶省份之首。土壤作为茶树生长赖以生存的营养来源,其酸化程度对茶树的生长及茶叶的品质有重要影响。然而,目前福建省土壤pH 值适宜茶树生长的茶园比例还不足15%,pH 值在4.5 以下的茶园占比87%[1],茶园土壤酸化成为影响茶树生长、茶叶品质的关键因素。土壤酸化不仅造成钙离子、锰离子、钾离子等大量流失,大大降低土壤磷、钼和硼的有效性,致使土壤肥力显著下降[1−2],而且可导致重金属元素的活化[3],重金属在土壤中的不断积累,最终可通过茶叶危害人类健康,成为茶叶质量安全的主要限制因素[4−6]。除此之外,土壤酸化还会减少土壤中有益微生物的活性和数量,进而影响土壤中碳、氮、硫、磷等的循环[3],导致茶树根的发育受阻,阻止养分的吸收[7],最终影响茶树生长和茶叶品质。因此,有效缓解茶园土壤酸化进程,对提高茶叶品质和发展茶叶质量安全生产等具有重要的意义。【前人研究进展】茶树属于喜酸植物,但是由于长期施肥不合理以及茶树特性[2],导致我国茶园土壤酸化程度日益严重。土壤酸化可带来一系列问题,首先是土壤重金属的活化[8];茶园土壤酸度降低会导致土壤吸附重金属离子的能力降低,从而活化重金属,使重金属溶解性、移动性和有效性增加[9]。目前,我国农田重金属污染主要分为5 种健康风险元素,包括Cd、As、Hg、Pb 和Cr;以及3 种生态风险元素,包括Ni、Cu 和Zn[10]。鉴于茶园重金属污染主要暴露途径是通过茶叶对人体健康造成损害,因此茶园重金属污染主要检测上述5 种健康风险元素,其中更以Cd 为主[10]。钟晓兰等[11]的研究发现,土壤酸性增加能增强土壤活性态Cd 的含量,且随着pH 的降低,Cd 活化能力增高,土壤Cd 含量越高。其次,茶园土壤酸化可导致土壤有益微生物的活性降低和菌落组成减少[8,12]。茶园微生物具有固氮、解磷、释钾、分解有机物和保持土壤保湿性等作用,可以有效调节茶园生态,促进茶的芽萌发,影响茶树次生代谢。除此之外,还可以帮助合成茶叶特殊的芳香物质,对茶树生长、茶叶品质提高具有积极的影响[12−13]。然而,随着近年来茶园集约化的高强度生产,福建省茶园土壤酸化呈加重趋势。因此,为了有效遏制土壤酸化、确保农产品的食品安全生产,需要找到快速、有效遏制的防治策略。西班牙河碳酸盐岩(Spanish river carbonatite, SRC)作为酸性土壤调理剂、草碳堆肥和矿物肥料,具有碱性强,微量元素高、有害元素低等优势,已在加拿大、俄罗斯等国家应用[14−15]。在我国,SRC 已证明可以显著改良蔬菜种植土壤的酸性,例如,陈云峰等[15]采用大田和室内试验证明SRC 对种植小白菜的土壤酸性具有明显的改良效果。【本研究切入点】然而,SRC 对于茶园土壤酸化的改良效果还未可知,其在茶园的相关应用调查还未见报道。【拟解决的关键问题】为验证SRC 在茶园土壤改良方面的应用潜力,采用盆栽和大田试验分别验证SRC 对土壤酸性、土壤重金属及土壤微生物的影响,测定土壤pH 值、重金属含量、并利用高通量测序技术检测微生物群落结构,评估SRC 对茶园土壤理化性质改良和修复的情况,以有效减缓茶园土壤酸化进程,保障茶园可持续发展。
1 材料与方法
1.1 室内试验设计
室内试验所用土壤为红壤,取自福建农林大学南区茶园温室土壤,pH 6.13。本研究在不施化肥条件下进行。新鲜土壤粉碎,去除枯枝落叶等杂质后,过3 cm 筛子备用。取7 份土壤,其中3 份土壤(每份土壤重量不少于200 g)进行微生物多样性检测,并测定pH 值及8 种重金属(Cd、Pb、Cr、Cu 和Zn、Ni、Hg、As)的含量[CK(2017)]。本研究所用的碳酸盐岩由博莱生态农业科技有限公司提供,主要成分 SiO224.6%、CaO 28.3%、N 0.30%、P2O53.13%、K2O 1.07%、pH 8.92,容重 1.52 g·cm−3,为颗粒状固体。剩余4 份土壤分别按体积比土壤∶SRC=80∶20、90∶10、95∶5 和99∶1 进行混合(即分别对应为处理组20%SRC、10%SRC、5%SRC 和1%SRC),同时留一组土壤不掺入SRC,作为对照。每个处理组或对照土壤分别装入3 个花盆(45 cm×20 cm×15 cm,长×宽×高),每个花盆种植2 年生毛蟹品种茶树苗10 株。茶苗在室外恢复半月后移至室内条件,LED 灯光照,光周期12 h∶12 h,温度(28±1)℃,相对湿度(70±5)%,生长至2018 年6 月12 日[CK(2018)],每个花盆内取土约50 g 进行微生物多样性检测分析以及pH 值测定,并检测Cd、Pb、Cr、Cu 和Zn、Ni、Hg、As 等8 种重金属的含量。
1.2 大田试验设计
试验地位于福建省泉州市安溪县西坪镇红星茶场内茶园(简称红星茶园,25°0′15.76″N,117°52′0.04″E;海拔700~750 m)。茶园面积约40 000 m2,该茶园试验地为有机试验茶园,不施用化肥、农药等。该地区属于亚热带湿润季风气候,气温在16~19 ℃,年降水量在1 700~2 100 mm。茶园种植茶树品种为毛蟹,种植年限在50 年以上,茶园土壤为红壤。2018 年7 月14 日,在茶园内选择6 块茶树地块,每块地面积约300 m2。在6 块试验地利用5 点取样法采取土样,采样部位选自茶树与施肥沟的中央位置,去除表面枯枝落叶层后0~20 cm 的土层。利用工兵铲和锄头挖掘采样断面,用竹铲去除与工具接触的部分后,在整个断面层均衡取样,土壤样本混合均匀后分为3 份,用于土壤微生物多样性检测、pH 值测定,以及Cd、Pb、Cr、Cu、Zn、Ni、Hg 和As 等8 种重金属的含量检测。随后,在6 块试验地中随机选择3 块,按1 120 kg·hm−2在茶树主干土壤附近撒施SRC。2019 年10 月14 日,在6 块试验地按上述方法取土壤进行微生物、pH 值及重金属检测。
1.3 土壤pH、重金属含量分析
取土样10 g 放入50 mL 烧杯中,加入25 mL 水,用玻璃棒剧烈搅动2 min,静置30 min,用台式pH计[型号:FF28,梅特勒-托利多仪器(上海)有限公司,METTLER TOLEDO]进行检测。
土样中Hg 和As 的含量使用原子荧光法进行测定,详细方法参照国家标准《土壤质量 总汞、总砷、总铅的测定 原子荧光法GB/T 22105.1—2008》;其他6 种重金属采用原子吸收分光光度法进行检测,参考标准为《土壤质量 铅、镉的测定 石墨炉原子吸收分光光度法GB/T 17141—1997》、《土壤总铬的测定火焰原子吸收分光光度法HJ 491—2009》、《土壤质量锌、铜的测定 火焰原子吸收分光光度法GB/T 17138—1997》、《土壤质量镍的测定 火焰原子吸收分光光度法GB/T 17139—1997》。
1.4 土壤细菌DNA 的提取和纯化
用 DNeasy Power Soil Kit (QIAGEN, Inc.,Netherlands)试剂盒进行微生物总DNA 的提取,并将提取的DNA 保存于−20 ℃冰箱内。分别用NanoDrop ND-1000 核酸检测仪(Thermo Fisher Scientific,Waltham,MA,USA)和0.8%琼脂糖凝胶电泳对提取的DNA进行品质检测;同时采用紫外分光光度计对提取的DNA 进行定量。
以细菌核糖体RNA 等能够反映菌群组成和多样性的目标序列为靶点,以稀释后的DNA 作为模板,应用带Barcode 的特异引物515F(5′-GTGCCAGCM GCCGCGGTAA-3′)和907R (5′-CCGTCAATTCMT TTRAGTTT-3′)对细菌16S V4 区进行PCR 扩增,PCR采用25 μL 反应体系:2×Phanta Max Buffer 12.5 μL,上 下 游 引 物 各1 μL,DNA 模 板1 μL,Phanta Max Super-Fidelity DNA Polymerase 0.5 μL,dNTP Mix 0.5 μL, ddH2O 8.5 μL,使用PCR 仪 器是Bio-rad T100 梯度PCR 仪。程序设定为:98 ℃预变性2 min;25 个循环(98 ℃变性15 s;55 ℃退火30 s;72 ℃延伸30 s);然后72 ℃延伸5 min。PCR 产物使用1.2%的琼脂糖凝胶电泳检测。将PCR 扩增产物用磁珠纯化回收。将纯化回收的PCR 产物进行荧光定量,荧光试剂为Quant-iT PicoGreen dsDNA Assay Kit,定量仪器为Microplate reader(BioTek,FLx800)。根据荧光定量结果,按照每个样本的测序量需求,对各样本按相应比例进行混合。
1.5 土壤细菌DNA 多样性分析
依照Illumina 公司的TruSeq Nano DNA LT Library Prep Kit 制备测序文库流程进行文库制备;通过2%琼脂糖凝胶电泳,对文库做最终的片段选择与纯化。上机测序前,需要先对文库在Agilent Bioanalyzer上进行质检,采用Agilent High Sensitivity DNA Kit。合格的文库有且只有单一的峰,且无接头,之后,采用Quant-iT PicoGreen dsDNA Assay Kit 在Promega QuantiFluor 荧光定量系统上对文库进行定量,合格的文库浓度应在2 nmol·L−1以上;将合格的各上机测序文库(Index 序列不可重复)梯度稀释后,根据所需测序量按相应比例混合,并经NaOH 变性为单链进行上机测序;使用MiSeq 测序仪进行双端测序。
通过质量初筛的原始序列按照index 和barcode信息,进行文库和样本划分,并去除barcode 序列。利用FLASH(v 1.2.7)对每个样本的reads 进行拼接。本研究主要利用QIIME 和R(v3.2.0)包对数据进行分析。利用QIIME 对细菌进行OUT 聚类,并计算细菌的多样性指数,包括丰富度指数(CHAO1、ACE)、辛普森多样性指数(Simpson index)、香农多样性指数(Shannon diversity index)。利用R 包进行细菌群落间差异性 分析(ttest 以及Monte Carlo permutation test)。同时,为了降低噪音,利用R 包(v3.2.0),选取了丰度前5%的菌落进行属水平的主成分分析(PCA)。并对所选取的丰度前5%的菌落,利用聚类分析(Hierarchical clustering)的方法,基于非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)评价不同土壤样本之间的相似度。
2 结果与分析
2.1 SRC 对室内盆栽茶树土壤pH 及重金属的改良
与2017 年处理前土样相比,2018 年对照组土样pH 值有降低,但是降低的并不显著(表1),说明较短时间(如一年内)种植茶树不能显著改变土壤pH。然而,种植茶树可显著影响土壤重金属的含量。如室内盆栽种植茶苗一年后,土壤中的重金属Cr、Pb、Ni、As、Zn 的含量发生显著富集(表1)。为了探索SRC 对土壤酸碱度、重金属的调节作用,分析了4 种SRC 浓度对土壤的改良效果,结果显示:与2018 年对照组相比(5.93 ± 0.09),4 组SRC处理对土壤的酸化均有调节作用,其中施入10%SRC 对土壤酸碱度改良效果最为显著(6.60 ± 0.54)。从重金属上看,SRC 效果显著,1% SRC 的施入量就可显著降低土壤中Cd 的含量。低浓度的SRC(1%~5%)施入对一些重金属含量的降低效果并不理想,甚至使有些重金属含量升高;说明必须要较高浓度的SRC 施入量才可改良土壤的重金属含量,然而,高浓度的SRC 施入(20%SRC)并不能有效降低Hg含量。同时,发现土壤的pH 值并不能随着SRC 浓度的升高而升高,例如,20% SRC 施入量的土壤pH值低于10% SRC 施入量的土壤pH 值。这一结果与前人的研究相似,陈云峰等[15]在研究SRC 对蔬菜种植土壤酸性改良中,发现土壤pH 值提升效果与施用量并不存在正相关关系。因此,认为高浓度的SRC施入(>10%)对茶园土壤有一定的改良作用。
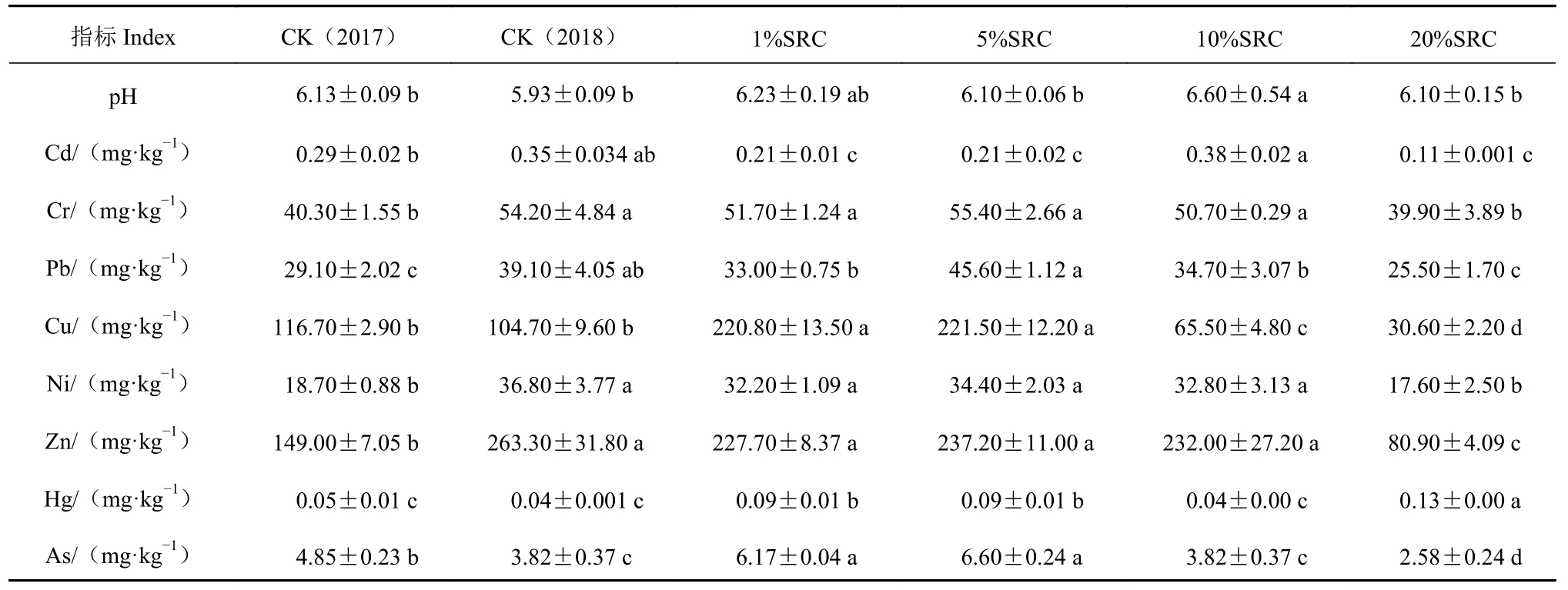
表 1 室内SRC 处理对土壤pH 值及重金属含量的影响Table 1 Effects of SRC on pH and heavy metals in pot soil
2.2 SRC 对室内盆栽茶树土壤细菌多样性的影响
通过高通量测序数据,共得到802 020 条有效序列,其中2017 年室内种植茶树的土壤的平均有效数据为42 289,2018 年室内种植茶树土壤的平均有效 数 据 为44 959,4 个 处 理 组20%SRC、10%SRC、5%SRC 和1%SRC 的土壤样本平均有效数据分别是41 032、46 179、49 355 以及43 525。经过数据库比对分析及注释后,基于QIIME 软件,对物种进行了OUT 聚类。结果显示,20%SRC 处理组OTU 数最大
(1033.7),CK2017 对照组最小(911.7),且两组OTU数目差异显著,表明SRC 对于土壤细菌的物种数目具有显著影响。进一步对土壤细菌群落丰度指数(Chao1、ACE)以及多样性指数(Shannon、Simpson)进行调查,结果显示,施用SRC 可一定程度上增加土壤细菌的种群丰度,但差异不显著(表2)。

表 2 室内SRC 处理对土壤细菌多样性的影响Table 2 Effects of SRC on microbial diversity in pot soil
2.3 SRC 对室内茶树种植土壤细菌群落组成与结构的影响
在门水平上,对照组与SRC 处理组中的优势菌群 均 为 变 形 菌 门(Proteobacteria)、 绿 弯 菌 门(Choroflexi)以及放线菌门(Actinobacteria)。然而,结果显示,茶树的种植可影响土壤细菌群落组成和结构。相较于2017 年,种植一年茶树后,其土壤变形菌门和绿弯菌门的比例升高,但是放线菌门的比例却明显降低(图1-A)。SRC 处理后,这些优势菌群的结构也发生了明显的改变。土壤中的变形菌门比例降低,绿弯菌门的比例升高,且放线菌门的比例也发生了波动(图1-A);此外,各SRC 处理组土壤中蓝藻菌(Cyanobacteria)比例下降明显,5%SRC、10%SRC 和20%SRC 处理组尤为显著,比例均在1%以下(对照为3.3%)。对丰度前5%的细菌群落,在属水平对群落组成结构进行PCA 分析(图1-B),结果表明,SRC 处理组土壤细菌的群落组成与对照组的差异较大。
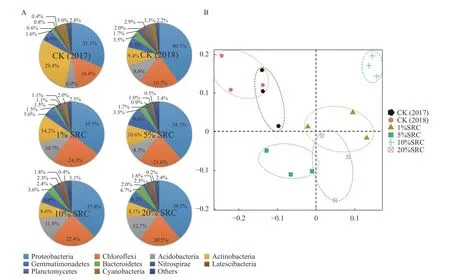
图 1 室内SRC 处理土壤细菌群落种类分布及主成分分析Fig. 1 PCA on species distribution of microbial community in pot soils
基于非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)评价不同土壤样本之间的相似度。发现10%SRC 处理组土壤细菌群落组成聚为一类(图2)。同时,聚类分析也发现了1%SRC 处理的土壤重复之间差异较大,这一结果与上述PCA 结果相同,说明1%SRC 处理所取土壤样本细菌不均一,后续研究可通过增加重复数目来进行改良。

图 2 基于UPGMA 算法的土壤细菌聚类分析Fig. 2 UPGMA-based cluster analysis on soil microbes
2.4 SRC 对茶园土壤pH 及重金属的改良
结果显示,一年内茶树种植对茶园土壤的影响并不显著,土壤酸化或者重金属的含量变化不明显(表3)。然而,SRC 却可以在短时间内影响茶园土壤,例如,SRC 可以在一年内明显改良土壤酸化,使土壤pH 值显著上升(表3);对重金属的改良也作用明显,结果显示,施用SRC 后,8 种土壤重金属含量均显著下降(表3),显示了SRC 对茶园土壤改良的潜力。
2.5 SRC 对茶园土壤细菌群落组成与结构的影响
SRC 处理后的茶园土壤细菌丰富度上升显著(表4)。从土壤细菌种类在门水平的分布上看(图3),土壤细菌分布比例最高为变形菌(Proteobacteria),两组对照(2018 和2019)土壤中变形菌比例均高于55%,分别为57.8%和55.5%,但在SRC 处理组中,这一比例降为45.1%(图3-A)。相比两个不同时间段的对照土样CK2018 和CK2019,SRC 处理组中酸杆菌(Acidobacteria)和厚壁菌(Firmicutes)比例同样下降明显。相反,拟杆菌(Bacteroidetes)和绿弯菌(Chloroflexi)比例上升显著,分别达到9.6%和11.3%。属水平的PCA 主成分分析结果表明,SRC处理组土壤细菌群落结果与对照组差异显著(图3-B)。
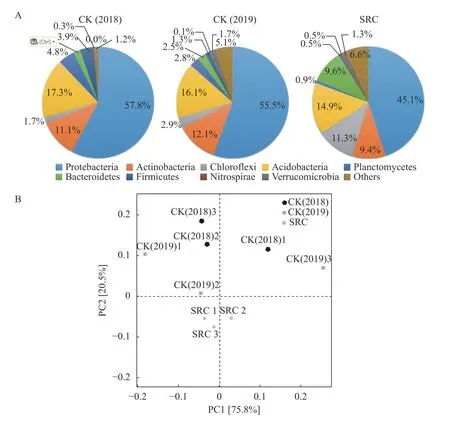
图 3 茶园SRC 处理土壤细菌群落种类分布及主成分分析(PCA)Fig. 3 PCA on species distribution of microbial community in soils at tea plantations
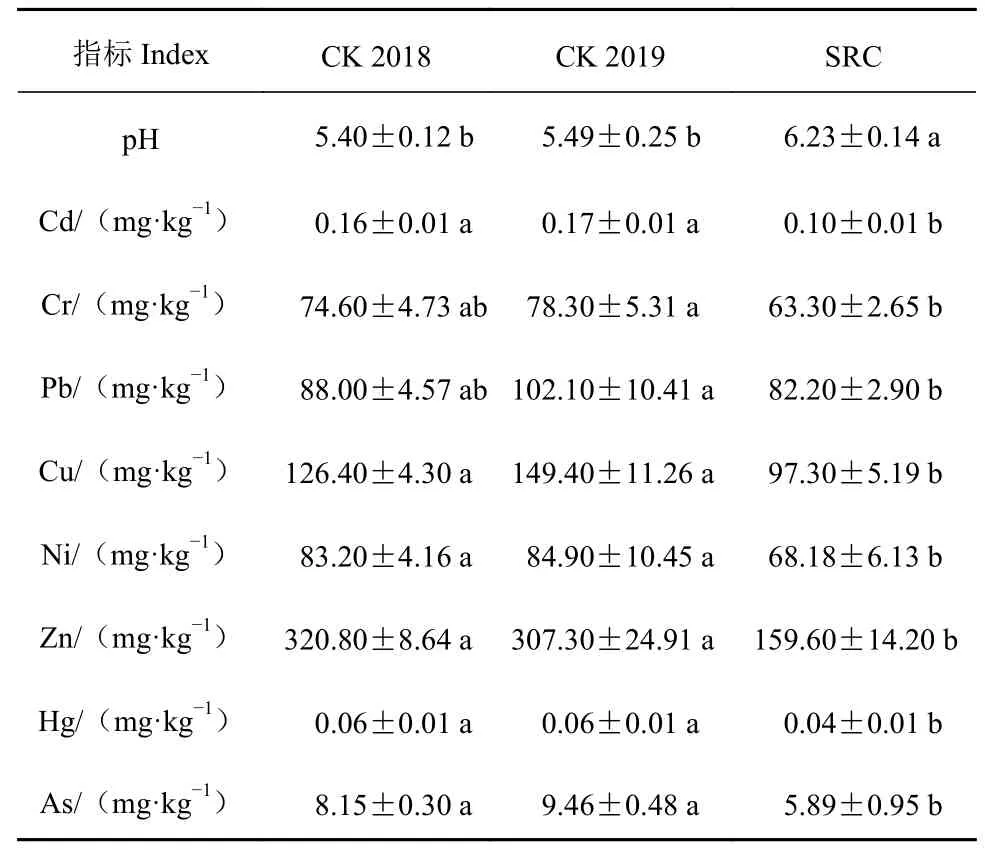
表 3 SRC 处理对茶园土壤pH 值和重金属含量的影响Table 3 Effects of SRC on pH and heavy metals in soils at tea plantations

表 4 SRC 处理对茶园土壤细菌多样性的影响Table 4 Effects of SRC on microbial diversity in soils at tea plantations
3 讨论与结论
在不施肥的前提下,大田和盆栽试验均表明SRC 能明显提升土壤pH,说明SRC 对于提升茶树种植土壤pH 的效果较稳定,对土壤pH 的提升效果不随施用方式不同而波动。SRC 是一种火成岩,有害元素较低、碱性较强,磷、硅、钙、钾及微量元素较高,能对土壤酸度起到一定的中和作用[14−16]。盆栽试验中的SRC 与土壤混合均匀,而大田试验中,本研究采取的是常用的条施方法,施用深度在20 cm左右。此外,盆栽试验说明,SRC 对土壤pH 的提升效果不与SRC 施用浓度呈正比,10%SRC 对土壤pH 提升效果最好,这与陈云峰等[15]、James 等[17]的研究结果一致。且SRC 对于土壤酸化的改良效果已在其他多种经济作物上被验证,如在芦笋、大麦等[15]。综上所述,对于茶园土壤逐年酸化严重的问题,可以通过补施SRC 来快速缓解土壤酸化问题。
本研究结果表明,茶园土壤中富集最多的重金属为锌和铜。根据颜明娟等[18]的调查显示,福建地区锌含量有超标现象。此外,叶琛等[19]发现,土壤中的铜、铬、镉含量与茶叶重金属含量具有较强的相关性。盆栽与大田试验发现,添加SRC 对重金属污染的改良有一定的效果,盆栽试验表明低浓度SRC 的施入量就可显著降低土壤中Cd 含量,然而,低浓度的SRC(<10%)对于其他重金属含量的降低效果并不显著。因此,可通过增加碳酸盐岩施用量来解决这一问题。因此,本研究用大剂量的SRC 施用量来进行大田试验(1 120 kg·hm−2左右),结果表明大剂量SRC 的施用可显著降低8 大重金属的含量。
微生物生物群落数量和活性是影响土壤肥力的重要因素[20],而土壤酸化可严重影响土壤微生物群落、结构,导致有益微生物种群大量减少,不利于茶园土壤中养分的转化[21]。部分研究学者提出细菌可分为富营养菌和寡营养菌[22−23],例如,酸杆菌门多生长于营养贫瘠的土壤环境中,因此属于寡营养细菌[23]。本研究发现,相较于未施用SRC 的茶园,施用SRC 的处理土壤中的酸杆菌门的相对丰度显著下降,这也说明施用SRC 可提高土壤养分。
综上所述,在茶园内施用碳酸盐岩(SRC)可以降低土壤酸性、改良土壤重金属污染,提高茶园土壤养分。

