Twist 及 E-cadherin 在人骨肉瘤组织中的表达及临床意义
蒋栋 康鹏程 肖炯哲 李腾飞 李洵 任炼 成世高 赵会
作者单位:417000 湖南,南华大学附属娄底医院、湖南省娄底市中心医院骨科 (蒋栋、康鹏程、肖炯哲、李腾飞、李洵、任炼、成世高);100020 北京,首都医科大学附属北京朝阳医院骨科 (赵会)
骨肉瘤 (osteosarcoma,OS) 是一种间叶源性的恶性肿瘤,其发病率占原发性恶性骨肿瘤的首位[1]。骨肉瘤恶性程度高,预后差,肿瘤切除联合肢体修复重建术后患者的 5年生存率为 65%~75%[2],有转移患者的 5年生存率仅为 20% 左右[3]。目前,对骨肉瘤发病机制及病因学的研究尚不明确。研究表明,骨肉瘤的发生发展与某些原癌基因的异常激活和抑癌基因的异常失活以及相关调控因子的失常密切相关。
Twist 是一种癌基因[4],其基因异常表达与肿瘤的发生、发展关系密切,影响肿瘤细胞的凋亡,而且还是上皮-间质转变 (epithelial mesenchymal transition,EMT) 过程中的关键因子,对肿瘤的侵袭转移有着重要影响[5]。Twist 的表达水平与肿瘤各亚型的恶性程度密切相关,浸润性越强表达越高,恶性程度也越高,增加 Twist 表达会提高肿瘤 EMT 能力[6]。目前,仅少量报道 Twist 在骨肉瘤中存在高表达,但对 Twist 与骨肉瘤关系更深入的研究尚未见报道,仍有较大的研究空间和研究意义。
E-cadherin 介导的细胞间黏附作用的丧失是肿瘤细胞侵袭和转移过程中的重要起始步骤,故被认为是一种抑癌基因[7]。E-cadherin 表达下调、紊乱或缺失都将导致细胞-细胞间黏附解体,肿瘤细胞脱落,侵袭力增强。Twist 可下调 E-cadherin 的表达诱导 EMT 的发生。
在许多上皮来源性恶性肿瘤中 Twist 与 E-cadherin表达呈负相关,Twist 高表达可下调 E-cadherin 表达,从而促使肿瘤侵袭转移,患者预后差。相反,在 Twist 低表达肿瘤组织内 E-cadherin 相对高表达,肿瘤细胞间粘连相对稳定,肿瘤细胞不易移动,患者预后相对较好[8-10]。而对来源性于间叶组织的骨肉瘤中是否 Twist 的表达水平与各恶性程度亚型密切相关;是否 Twist 与 E-cadherin 的表达在骨肉瘤中呈负相关。目前尚未见报道,需进一步研究。
本研究用免疫组化检测 Twist 及 E-cadherin 在人骨肉瘤、骨软骨瘤组织中的表达情况,研究以上两种基因在不同病理分级与分型骨肉瘤组织的表达情况、在转移与非转移骨肉瘤组织的表达情况,并研究 Twist 与 E-cadherin 的相关性。共同探讨 Twist与 E-cadherin 在骨肉瘤发生发展过程中的生物学意义,为进一步阐明骨肉瘤的发病机制、早期诊断、判断预后和基因治疗提供理论和实验基础。
材料与方法
一、纳入标准与排除标准
1. 纳入标准:(1) 2012年6月至 2018年11月,娄底市中心医院等 4 家三甲医院 (娄底市中心医院 10例,湘雅二院 13例,岳阳市二院 16例,解放军第 169 中心医院 11例) 经治的骨肉瘤标本;(2) 有明确的病理诊断者;(3)年龄在 5~80 岁之间;(4) 男女均可;(5) 所有患者均接受同一骨肉瘤标准治疗方案。
2. 排除标准:(1) 取标本前已经大剂量化疗等抗肿瘤药物治疗者;(2) 已发生肺转移等远处转移者;(3) 合并其它恶性肿瘤者;(4) 治疗前合并严重心肝肾等功能衰竭者;(5) 围术期死亡者。
二、研究对象资料
1. 骨肉瘤组:本研究共纳入 4 家医院截肢、肿瘤切除或手术切取活检的人骨肉瘤标本 50例。其中男 36例,女 14例,年龄 6~76 岁,平均 26.14岁;其中股骨 19例,胫骨 12例,肱骨 7例,腓骨6例,上 (下) 颌骨 5例,跟骨 1例。所有标本均经2 位资深病理科医师确认 (图 1~6)。
对所有骨肉瘤标本在 HE 染色下按病理组织学分型为:骨母细胞型骨肉瘤、软骨母细胞型骨肉瘤、纤维母细胞型骨肉瘤和混合型骨肉瘤四种[11]。其中含骨母细胞型骨肉瘤 12例:异型性骨母细胞为其主要成分,一般伴有丰富的瘤骨形成;软骨母细胞型骨肉瘤 13例:瘤组织中有一半以上呈软骨肉瘤样结构,并有化生骨质形成,而且有直接形成类骨或瘤骨的梭形瘤细胞;纤维母细胞型骨肉瘤 18例:瘤组织中一半以上呈纤维肉瘤样结构,由束状及紧密编织状排列的梭形瘤细胞组成,但瘤细胞间可见少量肿瘤性骨质或骨样组织形成;混合型骨肉瘤7例:是指由以上两种或三种类型等量混合组成,其它特殊类型骨肉瘤也归为此类。
图1 骨母细胞型骨肉瘤 (I 级) (HE × 400) Fig.1 Osteoblastic osteosarcoma (grade I) (HE × 400)
图2 软骨母细胞型骨肉瘤 (II 级) (HE × 400) Fig.2 Chondroblast osteosarcoma (grade II) (HE × 400)
图3 纤维母细胞型骨肉瘤 (III 级) (HE × 400) Fig.3 Fibroblast osteosarcoma (grade III) (HE × 400)
图4 混合型骨肉瘤 (II 级) (× 100) Fig.4 Mixed osteosarcoma (grade II) (× 100)
图5 混合型骨肉瘤 (II 级) (× 400) Fig.5 Mixed osteosarcoma (grade II) (× 400)
图6 骨软骨瘤 (HE × 100) Fig.6 Osteochondroma (HE × 100)
将 50例骨肉瘤根据瘤细胞的病理组织学特征,将其恶性程度分为 I、II、III 级[12],其中 I 级13例:视野中瘤巨细胞较少,富含骨样组织,瘤细胞略呈异型性改变,核分裂相少见,每个高倍镜视野仅见 0~1 个;II 级 20例:瘤巨细胞多,中等量骨样组织,瘤细胞分化较差,具有一定的异型性,核分裂相较多,每个高倍镜视野见 2~3 个;III 级17例:瘤巨细胞较多,仅含少量骨样组织,瘤细胞分化差,具有明显的异型性改变,核分裂相多见,每个高倍镜视野见 3 个以上。
所有骨肉瘤患者术后经电话联系和搜索复查病历资料随访,术后发生肺转移等远处转移或术后2年内非其它病因死亡者均归为转移组,共 29例;术后未发生转移且生存期限超过 2年者另归非转移组,共 13例;失访 8例。
2. 骨软骨瘤组:收集 2012年6月至 2018年11月间娄底市中心医院骨科手术切除的 12例人骨软骨瘤新鲜标本。其中男 6例,女 6例,年龄 3~53 岁,平均 22.08 岁;股骨 6例,胫骨 4例,手指、足趾各 1例。所有标本经两位资深病理科医师对 HE 切片进行复诊确认。
三、实验主要试剂及仪器
兔抗人 Twist (浓缩型) 多克隆抗体 (北京博奥森公司编号:bs-2441R-AF680)、鼠抗人 E-cadherin(即用型) 单克隆抗体 (福州迈新公司编号:MAB-0589)、链霉菌抗生物素蛋白-过氧化物酶法 (streptavidin-peroxidase,SP) 超敏免疫组化试剂盒 (福州迈新公司编号:KIT-9720)、石蜡包埋机 (孝感市泰康医疗设备有限公司型号:BM450B)、病理组织切片机 (英国 SHANDON 公司型号:AS325)、光学显微镜 (日本 Olympus 公司型号:BX41)、超清晰度病理图文分析系统 (日本 Olympus 公司型号:PIPS-2020)。
四、实验方法
本实验研究中对 Twist 和 E-cadherin 蛋白的表达均采用 SP 法检测。
免疫组织化学染色 (SP 法) 步骤:(1) 烤片:将烤箱调至 60 ℃ 烤片 3 h;(2) 脱蜡:二甲苯 I、二甲苯 II 每缸浸泡脱蜡 20 min;(3) 水化:依次经过无水乙醇 I、II、95%、90%、80%、70% 乙醇各5 min,蒸馏水洗 5 min;(4) PBS 漂洗 5 min×3 次;(5) 微波修复:pH6.0 柠檬盐酸缓冲液 (>500 ml) 置微波盒煮沸,放入切片后中高档微波修复 15 min,切片和缓冲液一起自然凉至室温。PBS 洗 5 min×3 次;(6) 灭活内源性过氧化物酶:3% 甲醇-H2O2(SP 试剂盒中试剂 A) 室温 20 min,PBS 洗 5 min×3 次;(7) 非免疫血清封闭:正常山羊血清 (SP 试剂盒中试剂 B) 封闭,37 ℃ 20 min,甩去余液,不洗;(8) 滴加一抗:滴加一抗 (E-Cad / Twist,预实验摸索 Twist 兔抗人多克隆抗体最适浓度为 1∶200)孵育,湿盒置 4 ℃ 冰箱过夜;(9) 复温 20 min,PBS洗 5 min×3 次;(10) 滴加二抗:滴加二抗 (SP 试剂盒中试剂 C) 孵育,37 ℃ 20 min (二抗为生物素标记的羊抗兔 / 鼠 IgG),PBS 洗 5 min×3 次;(11) 滴加三抗:滴加三抗 (SP 试剂盒中试剂 D) 孵育,37 ℃20 min (三抗为辣根酶标记的链酶亲和素),PBS 洗5 min×3 次;(12) DAB 显色:按标准说明书配置DAB 显色液,滴加于切片上,镜下观察结果,控制染色结果,适时用蒸馏水冲洗终止;(13) 复染:置苏木素中 5 min,自来水冲洗片刻,75% 的盐酸酒精溶液分化 30 s,自来水冲洗 5 min 蓝化;(14) 脱水和透明:依次经过 70%、80%、90%、95%、无水乙醇,各 5 min,二甲苯 I、II 各透明 10 min;(15) 封片、镜检:滴中性树脂盖片,镜下观察、记录并摄片。
五、主要观察指标
Twist 和 E-cadherin 在每个切片组织中的表达情况和强度。每张切片均由 2 名资深病理诊断医师在双盲下独立观察。瘤细胞呈黄色、棕黄色或棕褐色均为阳性表达。
Twist 阳性结果判定标准:染色颗粒主要位于细胞质中,少数细胞核中亦有表达。在显微镜 10×40倍视野下,每张切片随机选取 10 个非重叠视野按阳性细胞所占比例分为:0%~25% 为弱阳性 (+),25%~50% 阳性 (++),>50% 为强阳性 (+++)。视细胞未着色或背景均匀一致淡黄色为阴性 (-)。
E-Cad 染色结果判定标准:阳性染色颗粒主要位于胞膜和胞质中且以胞质中为主。在显微镜10×40 倍视野下,每张切片随机选取 10 个非重叠视野按阳性细胞表达部位和所占比例分为:阳性:定位于包膜或胞浆者,其中 0%~25% 为弱阳性 (+),25%~50% 阳性 (++),>50% 为强阳性 (+++);阴性 (-):细胞无着色或背景一致性淡棕色者。
六、统计学处理
采用统计学软件 SPSS 23.0 对实验数据进行分析,运用 Chi-square 和 Fisher’s 确切法进行χ2检验比较两组间的阳性率;运用成组设计两个样本比较的秩和检验 (Mann-WhitneyU法) 比较各抗体在骨肉瘤、骨软骨瘤组织的表达强度;运用多个独立样本非参数检验 (Kruskal-WallisH法) 比较各抗体在骨肉瘤 4 种不同病理组织分型中的阳性率;运用 Spearman 等级相关非参数检验,分析 Twist 和E-cadherin 两者在骨肉瘤中表达的相关关系。以上均以 α=0.05 作为检验水准。
结 果
一、Twist 在骨肉瘤和骨软骨瘤中的表达
Twist 在骨肿瘤细胞中阳性染色部位主要位于细胞质内,少数胞核中有表达,为棕黄色,显色过强时为棕褐色,可见细小颗粒 (图 7~12)。
50例骨肉瘤组织和 12例骨软骨瘤组织中 Twist表达的阳性率和表达强度比较,差异均有统计学意义 (P<0.05) (表 1,图 19)。
二、骨肉瘤中 Twist 表达与其病理分型和分级的关系
1. Twist 表达与病理分型的关系:在骨肉瘤 4 种不同病理分型中 Twist 表达的阳性率比较,差异无统计学意义 (P>0.05) (表 2,图 20)。
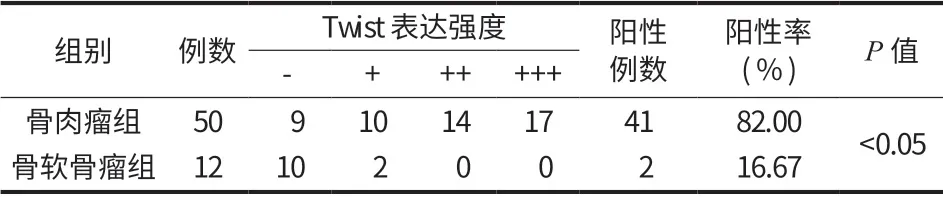
表1 Twist 在骨肉瘤和骨软骨瘤组中的表达情况Tab.1 Expressions of Twist in osteosarcoma and osteochondroma
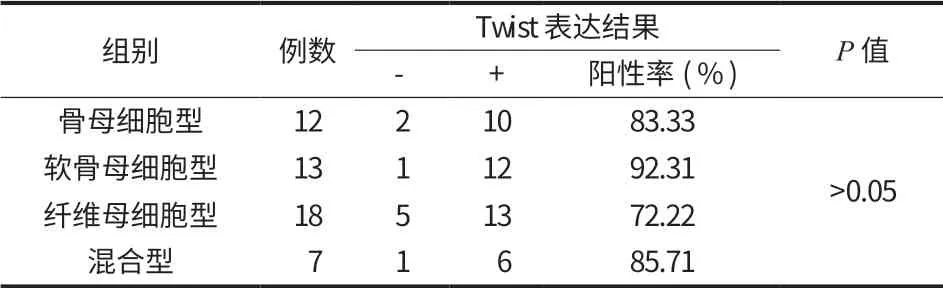
表2 Twist 在骨肉瘤不同病理组织类型的表达情况Tab.2 Twist expressions in different osteosarcoma pathological tissues
2. Twist 表达与病理分级的关系:本研究中,将根据骨肉瘤的恶性程度分为 3 级,其中把 I 级列为低级别骨肉瘤组,把 II、III 级列为高级别骨肉瘤组。低级别与高级别两组中 Twist 表达的阳性率和表达强度比较,差异有统计学意义 (P<0.05) (表 3,图 21)。
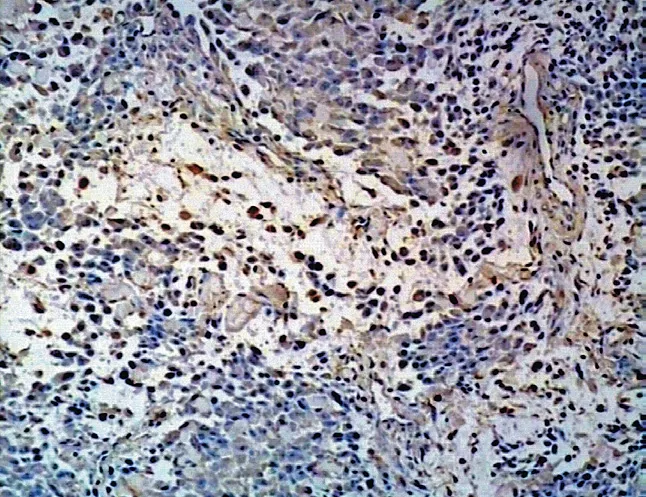
图7 Twist 在骨肉瘤中阳性表达 (×100) Fig.7 Positive expressions of Twist in osteosarcoma (× 100)
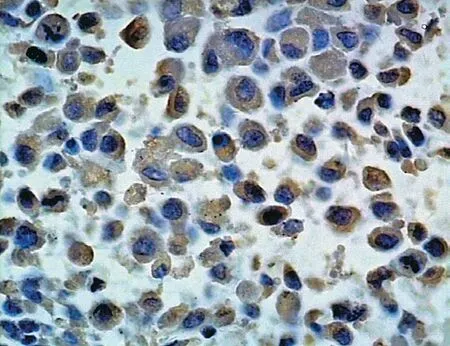
图8 Twist 在骨肉瘤中阳性表达 (× 400) Fig.8 Positive expressions of Twist in osteosarcoma (× 400)
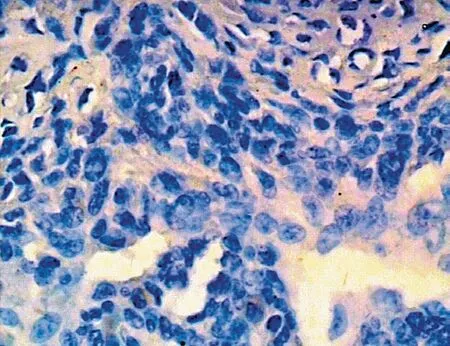
图9 Twist 在骨肉瘤中阴性表达 (× 400) Fig.9 Negative expressions of Twist in osteosarcoma (× 400)
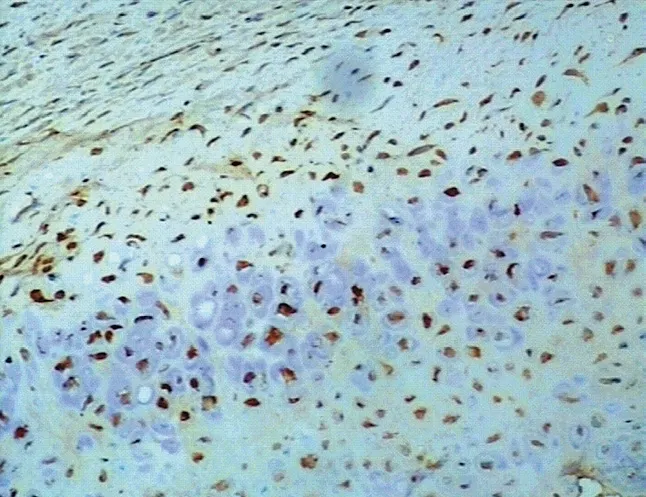
图10 Twist 在骨软骨瘤中阳性表达 (× 100) Fig.10 Positive expressions of Twist in osteochondroma (× 100)
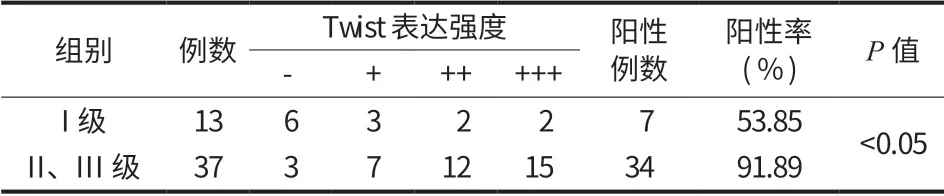
表3 Twist 在骨肉瘤低级 (I 级) 与高级 (II、III 级) 组的表达情况Tab.3 Twist expressions of osteosarcoma (grade I; grade II, III)
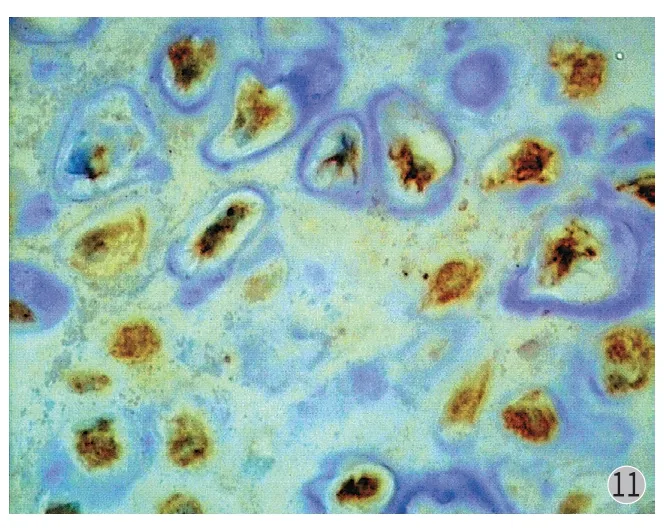
图11 Twist 在骨软骨瘤中阳性表达 (× 400) Fig.11 Positive expressions of Twist in osteochondroma (× 400)
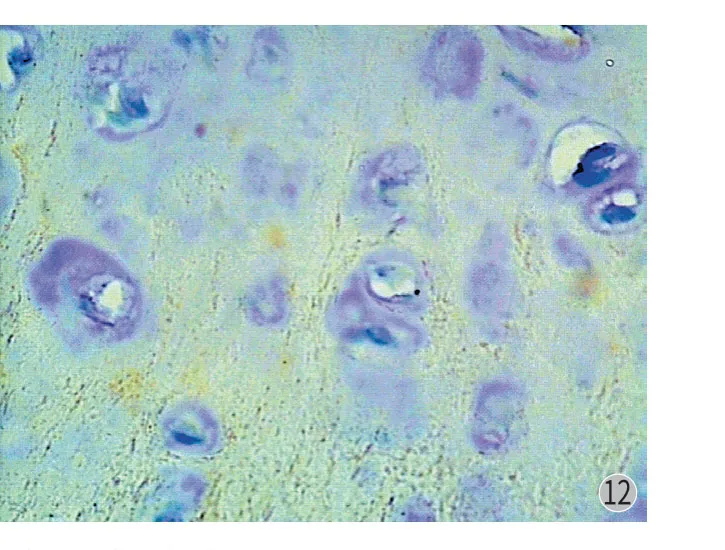
图12 Twist 在骨软骨瘤中阴性表达 (× 400) Fig.12 Negative expressions of Twist in osteochondroma (× 400)
三、Twist 在骨肉瘤转移组与非转移组中的表达情况
对本实验中所有骨肉瘤患者均经术后随访,失访 8例,全为 Twist 表达阳性。其中转移组与非转移组两组 Twist 表达的阳性率比较,差异有统计学意义(P<0.05) (表 4,图 22)。
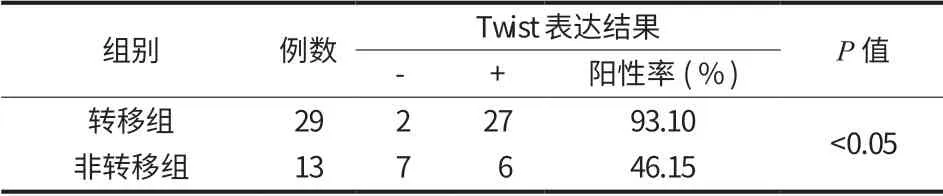
表4 Twist 在骨肉瘤转移组与非转移组中的表达情况Tab.4 Twist expressions of osteosarcoma metastatic group and nonmetastatic group
四、骨软骨瘤、骨肉瘤中 E-cadherin 的表达
E-cadherin 在骨肿瘤细胞中阳性染色部位主要位于细胞质内,胞膜仅少量有表达,为棕黄色,显色过强时为棕褐色,可见细小颗粒 (图 13~18)。
50例骨肉瘤组织与 12例骨软骨瘤组织两组E-cadherin 表达的阳性率和表达强度比较,差异均有统计学意义 (P<0.05) (表 5,图 19)。
五、骨肉瘤中 E-cadherin 表达与其病理分型和分级的关系
1. E-cadherin 表达与病理分型的关系:四组不同病理分型中 E-cadherin 表达阳性率比较,差异无统计学意义 (P>0.05) (表 6,图 20)。
2. E-cadherin 表达与病理分级的关系:低级别(I 级) 组与高级别 (II、III 级) 组中 E-cadherin 表达的阳性率和表达强度比较,差异均无统计学意义(P>0.05) (表 7,图 21)。
六、E-cadherin 在骨肉瘤转移组与非转移组中的表达情况
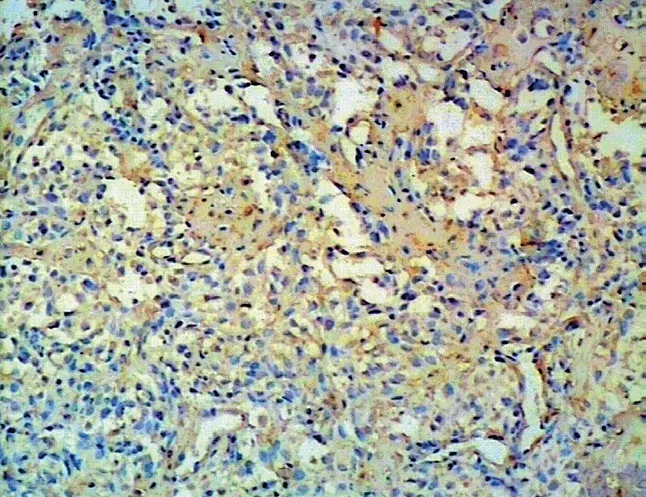
图13 E-cadherin 在骨肉瘤中阳性表达 (× 100) Fig.13 Positive expressions of E-cadherin in osteosarcoma (× 100)
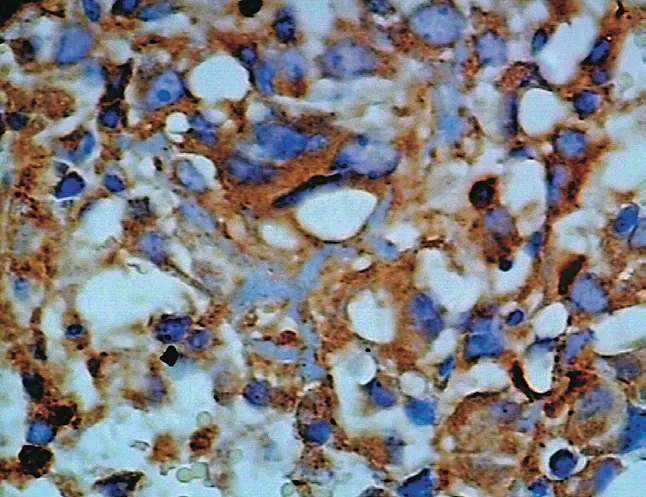
图14 E-cadherin 在骨肉瘤中阳性表达 (× 400) Fig.14 Positive expressions of E-cadherin in osteosarcoma (× 400)
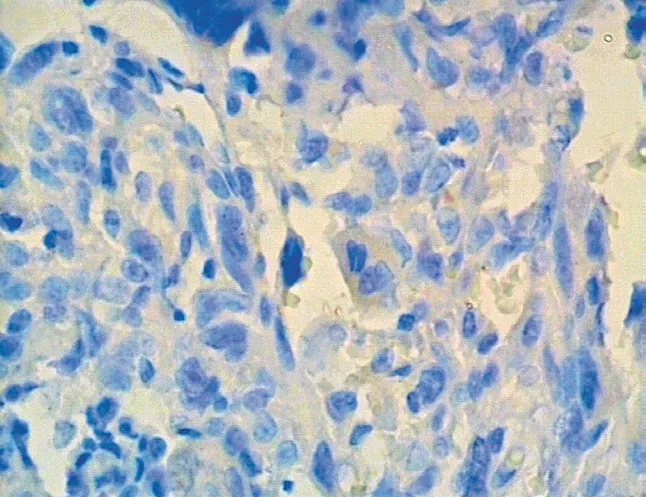
图15 E-cadherin 在骨肉瘤中阴性表达 (× 400) Fig.15 Negative expressions of E-cadherin in osteosarcoma (× 400)
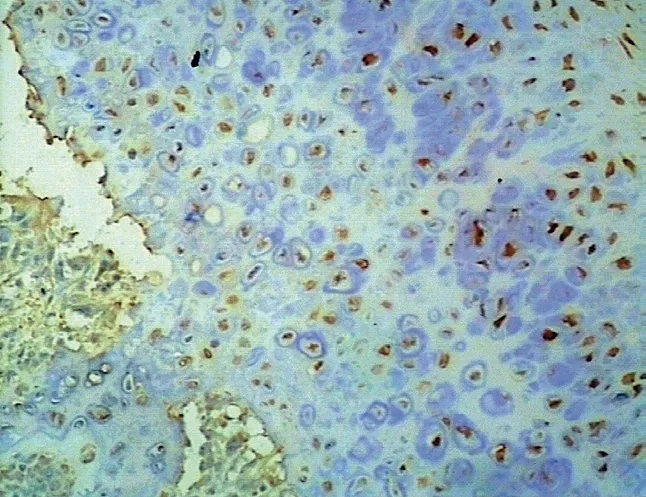
图16 E-cadherin 在骨软骨瘤中阳性表达 (× 100) Fig.16 Positive expressions of E-cadherin in osteochondroma (× 100)
图17 E-cadherin 在骨软骨瘤中阳性表达 (× 400) Fig.17 Positive expressions of E-cadherin in osteochondroma (× 400)
图18 E-cadherin 在骨软骨瘤中阴性表达 (× 400) Fig.18 Negative expressions of E-cadherin in osteochondroma (× 400)

表5 E-cadherin 在骨肉瘤和骨软骨瘤组中的表达情况Tab.5 E-cadherin expressions of osteosarcoma and osteochondroma
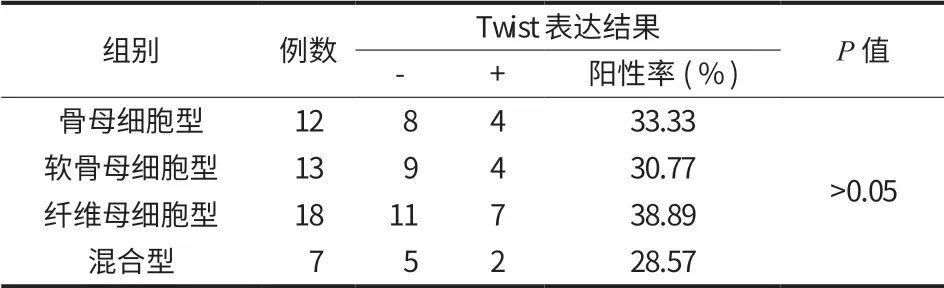
表6 E-cadherin 在骨肉瘤不同病理组织类型的表达情况Tab.6 E-cadherin expressions in different osteosarcoma pathological tissues

表7 E-cadherin 在骨肉瘤低级 (I 级) 与高级 (II、III 级) 组的表达情况Tab.7 E-cadherin expressions of osteosarcoma (grade I; grade II, III)
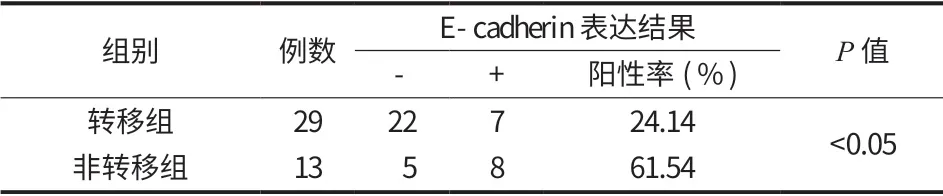
表8 E-cadherin 在骨肉瘤转移组与非转移组中的表达情况Tab.9 E-cadherin expressions of osteosarcoma metastatic group and non-metastatic group
本研究过程中失访的8例骨肉瘤组织有 2例E-cadherin 表达阳性,6例阴性。转移组与非转移组中 E-cadherin 表达的阳性率比较,差异有统计学意义 (P<0.05) (表 8,图 22)。
七、骨肉瘤中 Twist 和 E-cadherin 表达的相关性
运用非参数检验中的 Spearman 等级相关分析骨肉瘤组织中 Twist 和 E-cadherin 表达强度之间的相关关系,结果显示,Twist 和 E-cadherin 表达强度呈明显负相关且差异有统计学意义 (rs=-0.457,P<0.05) (表 9)。
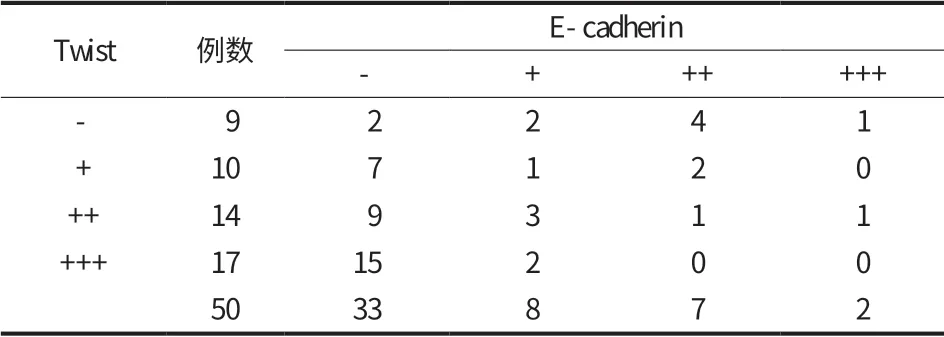
表9 Twist 和 E-cadherin 在骨肉瘤组织中表达的相关性Tab.9 Correlations between Twist and E-cadherin expressions in osteosarcoma tissues
讨 论
骨肉瘤好发于青少年,恶性程度和致残率极高。临床上治疗骨肉瘤常采用扩大切除或截肢术,而保肢术需要联合复杂的修复重建手术,治疗具有挑战性。骨肉瘤的发生发展也和其它肿瘤相似,也是一个由多基因参与、多通路调控的复杂过程。因此,临床上寻求基因治疗骨肉瘤迫在眉睫。
一、Twist 与骨肉瘤发生发展的关系
Twist 是一个可调节胚胎发育细胞重建并赋予其迁移能力的保守转录因子。Twist 高表达可能促进细胞恶性变,是某些恶性肿瘤发生、发展的关键因素,特别是与 EMT 及恶性肿瘤侵袭、转移关系密切。
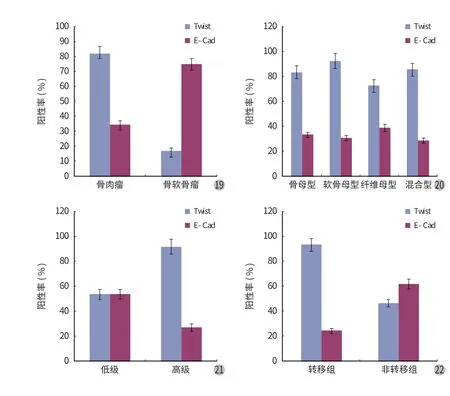
图19 Twist 与 E-cadherin 在骨肉瘤和骨软骨瘤中的阳性率图20 Twist 与 E-cadherin 在骨肉瘤不同组织类型中的阳性率图21 Twist 与 E-cadherin 在骨肉瘤低级和高级组中的阳性率图22 Twist 与 E-cadherin 在骨肉瘤转移和非转移组中的阳性率Fig.19 Positive rates of Twist and E-cadherin in osteosarcoma and osteochondromaFig.20 Positive rates of Twist and E-cadherin in different osteosarcoma tissuesFig.21 Positive rates of Twist and E-cadherin in the lower and higher groups of osteosarcomaFig.22 Positive rates of Twist and E-cadherin in the metastatic and nonmetastatic groups of osteosarcoma
目前研究显示,Twist 主要通过以下作用机制导致肿瘤的发生发展:(1) Twist 可抑制凋亡程序而激活抗凋亡程序,增强细胞抗凋亡能力,并促进细胞发生 EMT[13]。有研究表明 Twist 的凋亡抑制作用也可通过多种通路抑制抑癌基因 p53 的正常表达和转录,发挥抑制细胞凋亡作用,进而导致肿瘤发生[4]。Twist 还可以诱导细胞周期素依赖性蛋白激酶抑制分子 p21WAF1 / CIP1 的表达,增加 p21mRNA 表达水平,抑制细胞凋亡[14]。(2) Twist 参与调节 Wnt 通路,导致细胞增殖、分化、凋亡及黏附等功能的改变。转录因子 Twist、APC、Axin 等可在多种人体肿瘤中发生突变,导致 Wnt 信号通路的紊乱,使其靶基因的相继激活及细胞增生的失控,最终导致肿瘤细胞的形成[4]。(3) 大量研究显示 EMT 参与了多种肿瘤脱离原发灶而发生侵袭转移的过程,Twist 作为EMT 过程中的关键调控因子,对肿瘤细胞侵袭和转移有关键作用[6]。Twist 与 Snail、SIP1 等其它调控因子一样可抑制 E-cadherin 的转录表达[15],Twist 高表达的细胞中的 E-cadherin 和 β-catenin 等黏附蛋白表达降低,从而引起 EMT,其主要机制是 Twist 能与E-cadherin 启动子区的 E-box 结合,抑制 E-cadherin mRNA 的转录,丧失细胞间黏附作用,从而促进EMT 发生[16]。另外,Twist 促进肿瘤浸润侵袭转移还表现在能促进肿瘤血管生成[17]。目前,在多种实体肿瘤中研究发现,Twist 不仅参与了肿瘤的形成,还促进了肿瘤的侵袭转移,恶性程度越高 Twist 表达也越高。
本研究显示,Twist 在骨肉瘤组与骨软骨瘤组表达阳性率比较和表达强度比较,差异均有统计学意义 (P<0.05)。这说明 Twist 在骨肉瘤中高表达,可能是通过抑制细胞凋亡和分化导致骨肉瘤的发生;Twist 在骨肉瘤各种病理分型中阳性表达率差异无统计学意义 (P>0.05),说明 Twist 在其病理分型中表达无差别;随着骨肉瘤恶性程度 (即分级指标) 的递增,Twist 阳性表达率和表达强度均有上升趋势,差异有统计学意义 (P<0.05),说明 Twist 阳性表达率和表达强度可作为判断骨肉瘤分级及判断预后的指标;在随访的转移组中 Twist 阳性表达率为 93.10%(27 / 29),非转移组阳性率为 46.15% (6 / 13),两组差异有统计学意义 (P<0.05),这提示 Twist 可能参与了骨肉瘤的侵袭转移过程。
二、E-cadherin 与骨肉瘤的关系
E-cadherin 属于上皮型钙黏附蛋白,为 I 型跨膜糖蛋白,存在于几乎所有上皮细胞和部分间质细胞表面[18],其主要生理功能有:(1) 介导细胞间连接,是保持细胞相互黏合的主要细胞黏附分子;(2)参与细胞分化和维持机体组织的结构,必要时可通过改变细胞的微环境,影响细胞的分化,参与器官的形成与修复;(3) 维持原位功能,抑制细胞迁移,E-cadherin 表达减少或缺失使瘤细胞具有移动性,使原位肿瘤易发生侵袭和转移。
大量研究表明,E-cadherin 在许多肿瘤组织低表达,而且恶性程度越高表达越低。E-cadherin 在正常细胞及大部分肿瘤细胞上主要为膜表达,胞质内少量表达。张海燕等[19]研究报道,E-cadherin 在胃癌组织中却主要为细胞质及核表达,包膜上极少表达,恶性程度越高其表达量越低。研究显示,E-cadherin 存在或高表达的肿瘤其侵袭转移能力较低,是一种肿瘤抑制蛋白,在乳腺癌[20]、肝癌[21]等许多肿瘤中已被发现。有实验证实,通过基因转染技术 E-cadherin 可逆转恶性肿瘤的侵袭转移能力,而阻断 E-cadherin 在恶性肿瘤细胞内的表达又可重新诱发侵袭转移现象[22]。
本研究发现,与其它大部分肿瘤相比,E-cadherin 在骨肿瘤细胞中阳性染色部位主要定位细胞质内,胞膜仅少量有表达,其在骨肉瘤组和骨软骨瘤组中阳性率比较差异有统计学意义 (P<0.05)。说明E-cadherin 的低表达与骨肉瘤的发生发展过程有一定的关系。
低级别 (I 级) 组与高级别 (II、III 级) 组中E-cadherin 表达的阳性率和表达强度比较,差异均无统计学意义 (P>0.05)。这说明 E-cadherin 与骨肉瘤恶性程度的关系不大,E-cadherin 尚不能作为评价骨肉瘤分级的指标。
E-cadherin 在骨肉瘤各种病理分型中阳性表达率差异无统计学意义 (P>0.05),说明 E-cadherin 在其病理分型中表达无差异;转移组骨肉瘤与非转移组骨肉瘤中 E-cadherin 表达的阳性率比较,非转移组明显高于转移组 (P<0.05)。这提示 E-cadherin 低表达也可能参与了骨肉瘤的侵袭转移过程。
三、骨肉瘤中 Twist 与 E-cadherin 之间的关系
大量研究表明,Twist 与 E-cadherin 在肿瘤发生发展中起非常关键的作用,且分别通过多种通路导致肿瘤发生发展。目前,在研究肿瘤中 Twist 与E-cadherin 关系的焦点通路为 EMT,Twist 可以与E-cadherin 启动子区的 E-box 结合,抑制 E-cadherin mRNA 的转录,从而诱导由 E-cadherin 介导的细胞间黏附消失,并使上皮细胞发生 EMT 转化。有研究报道,通过阻止骨肉瘤细胞 Wnt / LRP5 信号通路可明显上调 E-cadherin 表达,并且可明显降低 Twist 介导的侵袭转移能力[23]。但在骨肉瘤组织中 Twist 下调 E-cadherin 表达的作用机制尚不明确,Twist 是否还存在另外的通路导致 EMT、促进瘤细胞侵袭转移尚不清楚。
本研究运用非参数检验中的 Spearman 等级相关分析骨肉瘤组织中 Twist 和 E-cadherin 表达强度之间的相关关系,结果显示,Twist 和 E-cadherin 表达强度之间呈明显负相关且差异有统计学意义 (rs=-0.457,P<0.05),这说明 Twist 在骨肉瘤中高表达可能抑制 E-cadherin 的表达,EMT 可能也参与了骨肉瘤的侵袭转移。国内外绝大多数研究表明 EMT 主要是上皮性来源肿瘤侵袭转移的机制,而在间叶源性的骨肉瘤中 Twist 与 E-cadherin 是否还通过另外的途径导致骨肉瘤的发生、发展和侵袭转移尚需进一步研究探讨。

