皮肤填充物联合局部热疗在乳腺癌改良根治术后放疗中的效果探讨
丁学锋 李红生 严晓花 温鹏军 谢洪霞 魏旭升
乳腺癌作为女性群体最为常见的一种恶性肿瘤,严重威胁广大女性患者的身心健康。近年来,乳腺癌发病率仍逐年呈增长趋势,目前全球范围内约有130 万左右乳腺癌患者,每年新发患者也在不断增加[1]。研究表明,妇女乳腺癌在我国恶性肿瘤发病率中位居首位,并以每年3%~4%的速度递增[2]。早期乳腺癌患者即使接受了手术及规范的治疗,复发转移率仍可高达30%~40%[3]。我国女性乳腺癌的发病年龄为45~54 岁,即为围绝经期前后的妇女,比欧美国家要提前10 年左右[4],因此加强高危人群健康教育、及时诊断和干预尤为必要。目前,乳腺癌术后胸壁、区域淋巴结复发率较为常见,其中胸壁复发比例最高,是影响乳腺癌患者术后生存率的重要因素。根据循证医学观念,美国临床肿瘤学会(ASCO)将乳腺癌术后胸壁放疗作为A级证据推荐[5]。热疗是利用热的生物效应进行肿瘤治疗。研究表明,热疗对肿瘤具有直接杀伤作用,同时与放化疗也均有很好的协同作用[6]。除此之外,局部热疗还具有安全可靠、价格低廉等的特点[7-9]。在乳腺癌放疗过程中,为保证胸壁照射野辐射剂量的均匀与准确,常需要组织等效填充材料填充组织缺失处,或进行剂量补偿。然而,目前对皮肤填充物的相关报道却相当有限,对皮肤填充物的剂量、时间也尚无统一认知[10]。本文对2014 年2 月~2019 年2 月本院192 例乳腺癌患者的临床资料进行分析,旨在探究皮肤填充物联合局部热疗在乳腺癌患者改良根治术后放疗中的应用效果,以此为乳腺癌患者选择合理的治疗模式、改善患者预后提供理论。
1 资料与方法
1.1 一般资料 收集2014 年2 月~2019 年2 月本院192 例行乳腺癌改良根治术的乳腺癌患者,年龄45~75 岁,平均年龄(52.84±8.72)岁;其中Ⅱ期83 例、Ⅲ期109 例。根据治疗方案不同将患者分为对照组和观察组,各96 例。对照组平均年龄(55.96±8.23)岁;其中Ⅱ期46 例、Ⅲ期50 例。观察组平均年龄(56.14±7.83)岁;其中Ⅱ期48 例、Ⅲ期48 例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
表1 两组患者的一般资料比较[,n(%)]

表1 两组患者的一般资料比较[,n(%)]
注:两组比较,P>0.05;Her-2:人表皮生长因子受体-2
1.2 纳入及排除标准 纳入标准:①所有患者符合乳腺癌诊疗指南标准[4];②仅患有单侧乳腺肿瘤;③患者被诊断为原发性Ⅱ或Ⅲ期乳腺癌患者;④所有患者均经超声、X 线乳房摄影及活检确诊;⑤符合放疗指征,T3以上或腋窝淋巴结转移≥4 枚;⑥手术前均签署知情同意书。排除标准:①1 年之前接受过化疗或放疗者;②合并有其他严重心、脑、肾等内脏器官的功能障碍或严重并发症者;③热疗处皮肤破溃者;④合并免疫系统疾病者;⑤资料不全者。
1.3 方法 两组患者术后均行5 周的三维适形放疗(3D-CRT)及局部热疗,放疗每周5 次,2 Gy/次,放射剂量均为50 Gy。患者仰卧于三维适形治疗专用的碳纤维板乳腺托架上,制作真空垫体位固定袋,用立体定向系统在CT 下定位,扫描层厚5 mm,扫描范围包括整个胸部。模拟CT 图像经网络系统传送至治疗计划系统(topslane venus),放疗医师进行靶区勾画,物理师评估计划并与医生共同确认。模拟定位机下拍片验证靶区位置后选用6MV-X 线,采用2 野照射。局部热疗每周进行2 次,60 min/次,热疗使用HG-2000 体外高频热疗机(珠海和佳医疗设备有限公司),热疗温度控制在42~43℃,根据患者舒适度适当调整。对照组患者放疗时不使用皮肤填充物,观察组患者放疗时(2/3 程)使用皮肤填充物,厚度0.5 cm,材料为聚苯乙烯。
1.4 观察指标及判定标准 对比两组患者治疗前后炎症因子和肿瘤标记物水平,靶区平均剂量与均匀性指数,不良反应发生情况和复发转移情况、生存情况。血清炎症因子包括IL-2、IL-4、TNF-α。肿瘤标志物包括CEA、AFP、CA15-3。不良反应包括放射性肺损伤、放射性皮肤损伤、放射性心脏损伤。放射性损伤分级标准:乳腺癌患者放疗皮肤反应程度按美国肿瘤放疗协作组(RTOG)分级标准[11]。乳腺癌患者急性放射性肺损伤及心脏损伤均参照RTOG 分级标准[12]。靶区剂量使用RGD-3A 热释光剂量仪(北京康科洛电子有限公司产品)测定,计算平均剂量及剂量均匀性指数。对所有患者进行随访,随访截止时间2019 年12 月,记录随访期间复发转移及生存情况。绘制Kaplan-Meier 曲线分析两组患者生存情况。复发情况包括胸壁局部复发、区域复发及远处转移。
1.5 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验;Kaplan-Meier 曲线分析两组患者生存时间,生存差异的比较采用Log-rank 检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者治疗前后炎症因子和肿瘤标记物水平比较 治疗前,两组L-2、IL-4、TNF-α 及CEA、AFP、CA15-3水平比较,差异无统计学意义(P>0.05);治疗后,两组IL-2、IL-4、TNF-α 水平均高于治疗前,CEA、AFP、CA15-3 水平均低于治疗前,差异有统计学意义(P<0.05);治疗后,观察组TNF-α 水平高于对照组,CEA、AFP、CA15-3 水平低于对照组,差异具有统计学意义(P<0.05)。见表2。
2.2 两组患者靶区平均剂量与均匀性指数比较 观察组靶区平均剂量高于对照组,均匀性指数低于对照组,差异具有统计学意义(P<0.05)。见表3。
2.3 两组患者不良反应发生情况 及复发转移情况比较 两组放射性肺损伤、放射性皮肤损伤及放射性心脏损伤发生率比较,差异均无统计学意义(P>0.05)。见表4。随访期间,观察组胸壁局部复发率及远处转移率均显著低于对照组,差异有统计学意义(P<0.05),两组区域复发率比较,差异无统计学意义(P>0.05)。见表5。
2.4 两组患者生存情况比较 对照组死亡率为22.92%(22/96),平均生存期为(28.59±0.73)个月;观察组死亡率为10.42%(10/96),平均生存期为(38.38±0.76)个月;观察组死亡率明显低于对照组,平均生存期长于对照组,差异有统计学意义(χ2/t=5.097、91.025,P<0.05)。见图1。
表2 两组患者治疗前后炎症因子和肿瘤标记物水平比较()
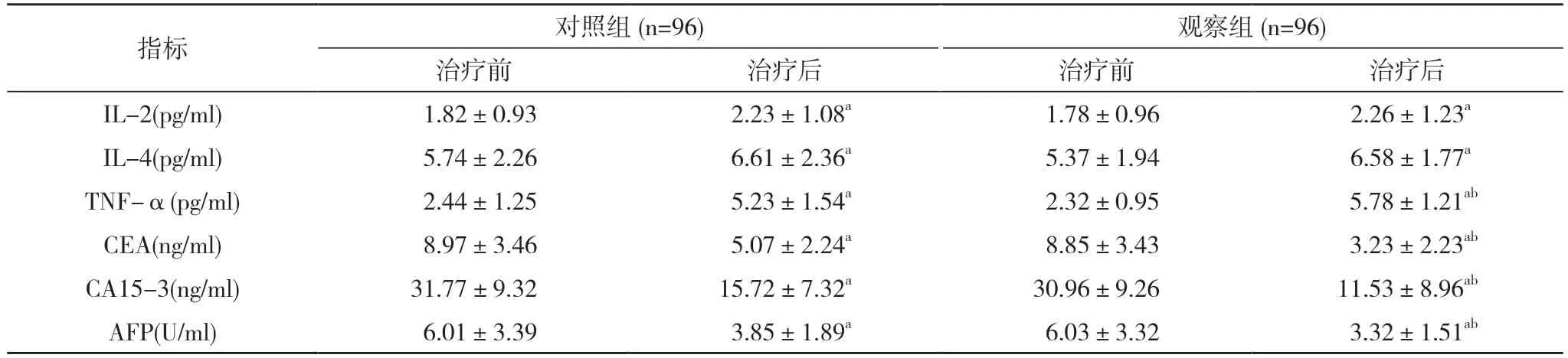
表2 两组患者治疗前后炎症因子和肿瘤标记物水平比较()
注:与治疗前比较,aP<0.05;与对照组比较,bP<0.05
表3 两组患者靶区平均剂量与均匀性指数比较()

表3 两组患者靶区平均剂量与均匀性指数比较()
注:与对照组比较,aP<0.05

表4 两组患者不良反应发生情况比较[n(%)]
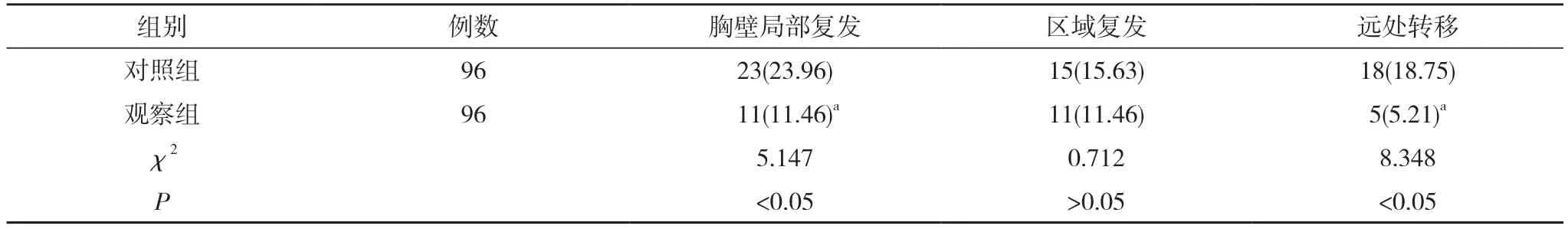
表5 两组患者复发转移情况比较[n(%)]

图1 两组乳腺癌患者Kaplan-Meier 生存曲线
3 讨论
近年来,随着社会工业化的加快以及空气污染,我国乳腺癌发病率呈逐年上升趋势,严重威胁着广大妇女的身心健康。乳腺癌术后复发,尤其胸壁复发是乳腺癌治疗失败以及影响患者预后和生活质量的主要原因之一。作为一种全身性疾病,乳腺癌复发及预后的影响因素众多,根据患者的具体情况选择个体化治疗方案尤为必要[13]。研究表明,胸壁放疗可有效降低局部复发率,消灭残存的病灶;也可有效降低术后隐匿病灶远处转移,从而提高生存率[14]。目前,国际上虽对乳腺癌术后放疗治疗已达成了共识,但对适应证、部位及技术仍有争议[15]。乳腺癌改良根治术后胸壁放疗照射技术如单纯电子线照射、电子线混合线照以及3D-CRT 调强放疗(IMRT)等仍无统一标准,若表面不加等效填充物以上照射技术均无法满足皮肤剂量的要求[16]。然而,世界范围内使用皮肤填充物的认知和使用率也差别很大,美国、澳大利亚、法国、意大利医生皮肤填充物使用率分别有 82%、65%、8%、2%,而我国改良根治术后放疗填充物使用率也从2014 年的35.4%下降到19.3%[17,18]。关于皮肤填充物对放疗效果的影响鲜有报道。
本研究对乳腺癌改良根治术的乳腺癌患者采用3D-CRT 照射技术联合局部热疗,分析乳腺癌患者有无使用皮肤填充物的临床疗效及长期预后。对照组放疗过程未使用皮肤填充物,观察组放疗过程使用皮肤填充物。鉴于胸壁形状不规则、厚薄不均,使用皮肤填充物可有效降低剂量建成效应,提高皮肤和瘢痕区剂量,本研究中观察组患者全程统一使用0.5 cm 填充物提高表面剂量。相关研究中从剂量学证实了填充物的有效性,填充物厚度大致0.3~3.0 cm 不等,未加填充、0.5 cm 填充、1.0 cm 填充3 种情况下均表面剂量分别为处方剂量的65%、97%、103%[19,20]。众多研究表明,使用填充物虽可提高皮肤表面剂量,但在一定程度上加重了皮肤反应。本研究中,对放疗后的不良反应进行了统计,结果表明,两组患者放射性肺损伤、放射性皮肤损伤、放射性心脏损伤发生率比较差异无统计学意义(P>0.05),这与陈军刚等[21]的研究一致。不同的是,相关研究为放疗后半程加1.0 cm 皮肤填充物,复发反应两组间也无区别。本研究中,随访期间,观察组胸壁局部复发率及远处转移率均显著低于对照组,差异有统计学意义(P<0.05);而远处转移的患者很大一部分来自胸壁局部复发的患者。分析其原因,一方面是2/3 程使用0.5 cm 皮肤填充物,两组患者还均给予了局部热疗。观察组靶区平均剂量高于对照组,均匀性指数低于对照组,差异具有统计学意义(P<0.05)。另一方面也可能是纳入的患者不同导致的结果,来本院就诊的均为酒泉当地患者,也可能与当地生活习惯密切相关,这也是下一步研究的方向。杨思原等[22]的研究表明,胸壁表面垫0.5 cm 厚的等效填充物既可使靶区剂量分布更加均匀,又进一步降低了心肺的受照剂量,也有力的支持了作者的结论。结果提示乳腺癌术后皮肤填充物联合热放疗不增加不良反应,且复发率低;胸壁局部复发的患者仍要关注身体变化预防远处转移。
在抗肿瘤过程中血清炎症因子IL-2、IL-4、TNF-α 发挥着巨大的作用[23]。研究表明,热疗与低剂量辐射均能改善乳腺癌患者免疫功能,调节炎症因子水平[24]。本研究结果表明,治疗后,两组IL-2、IL-4、TNF-α 水平均高于治疗前,CEA、AFP、CA15-3 水平均低于治疗前,差异有统计学意义(P<0.05);治疗后,观察组TNF-α 水平高于对照组,CEA、AFP、CA15-3 水平低于对照组,差异具有统计学意义(P<0.05)。结果提示皮肤填充物联合热放疗可明显改善乳腺癌患者炎症因子水平,具有较好的抗肿瘤效果,而皮肤填充物具有增强效应,具体机制有待进一步研究。本次研究为临床应用皮肤填充物联合热放疗治疗乳腺癌提供了理论依据。此外,还分析了随访期间两组患者的生存率,结果表明,观察组死亡率明显低于对照组,平均生存期长于对照组,差异有统计学意义(P<0.05)。具体机制仍需进一步探索。虽然本研究填补了术后乳腺癌患者皮肤填充物联合热放疗的空白,仍有很大局限性。本研究为单中心研究、未对比不同皮肤填充物的厚度、时间限定、不同热疗时间对疗效的影响,这也是今后的研究方向。
总之,皮肤填充物联合局部热疗在乳腺癌患者改良根治术后放疗中具有较好的疗效,靶区平均剂量高,分布更加均匀,可有效改善炎症因子和肿瘤标记物水平,长期随访复发转移率和死亡率低,值得临床推广。

