影响胃癌总体生存率的免疫相关基因筛选*
胡仁旺, 龚建平
华中科技大学同济医学院附属同济医院胃肠外科,武汉 430030
胃癌是常见的消化系统恶性肿瘤,治疗方式以手术切除为主。近年来的研究发现胃癌的预后不仅与病理分期有关,还与肿瘤微环境具有明显的相关性[1-3]。肿瘤微环境主要包括肿瘤细胞、基质细胞和免疫细胞等。越来越多的文献证实免疫细胞的浸润是影响胃癌预后的重要因素,因此筛选影响胃癌预后的免疫相关基因具有重要意义[4]。TCGA(The Cancer Genome Atlas)数据库包含各种肿瘤完整的临床信息和基因测序信息[5-6],且其数据信息及患者随访信息处于不断更新状态。ImmPort(The Immunology Database and Analysis Portal)数据库[7-8]是最常用的免疫相关基因数据库之一,其中包含大量已经鉴别出来的免疫相关基因,因此可以通过R软件将TCGA数据库和ImmPort数据库结合起来筛选出影响胃癌术后总体生存率的免疫相关基因。本研究将筛选出来的免疫相关基因与免疫细胞、基质细胞及肿瘤纯度等肿瘤微环境的相关指标进行相关性分析,探讨其影响肿瘤预后的机制,并通过生物富集分析了解基因的相关表达通路,以此深入了解胃癌免疫相关基因的功能,以期更好地指导临床工作。
1 材料与方法
1.1 数据来源
通过TCGA数据库下载胃癌患者的临床信息和基因表达信息,将临床信息和基因表达信息合并,删除缺失值。通过ImmPort免疫数据库获取免疫相关基因列表,并提取对应的免疫相关基因在胃癌患者中的表达量。
1.2 研究流程
首先利用数据库信息筛选出胃癌患者的癌旁组织和肿瘤组织之间具有统计学意义的差异表达基因,且差异表达在2倍以上。然后利用Kaplan-Meier法在差异表达基因中筛选出影响胃癌患者预后的基因,并与通过单因素COX回归分析筛选出来的临床指标进行合并,再进行多因素COX回归分析,筛选出独立预后的风险基因。对筛选出来的风险基因进行与临床病理、免疫细胞浸润、肿瘤微环境的相关性分析和基因信号通路富集分析。
1.3 统计学方法
所有统计计算均通过R软件完成,生存分析采用Kaplan-Meier法,2个指标之间的比较采用Wilcox检验法(如肿瘤组织和癌旁组织之间基因表达量的比较),3个及以上指标之间的比较采用Kruskal-Wallis检验法(如单个基因在肿瘤不同T分期患者之间的比较),临床相关性分析采用Spearman相关分析法。图形绘制均用R软件完成,均以P<0.05为差异具有统计学意义。
2 结果
2.1 纳入病例的临床资料及筛选出的基因信息
通过数据整理及基因与临床信息的合并,删除缺失值后,最终纳入患者313例,其中男性198例,女性115例。Grade分级:Ⅰ级7例,Ⅱ级108例,Ⅲ级198例。T分期:T1期15例,T2期64例,T3期151例,T4期83例。M分期:M0期292例,M1期21例。N分期:N0期94例,N1期86例,N2期69例,N3期64例。筛选出胃癌肿瘤组织和癌旁组织之间差异表达的免疫相关基因345个,其中对胃癌术后总体生存率有影响的基因有20个(CGB5、INHBB、TMSB15A、DKK1、GDF7、SLC22A17、GHR、MMP12、PGF、FGFR4、IGHV3-35、INHBA、IGHD3-16、IGLV3-22、MASP1、BMP8A、CARD11、NOX4、NPR3、IGHA1)。
2.2 临床指标的单因素COX回归分析
如图1所示,通过对临床指标进行单因素COX回归分析发现:年龄[HR=1.020,95%CI:1.003~1.037,P=0.019]、T分期[HR=1.369,95%CI:1.102~1.702,P=0.005]、M分期[HR=2.502,95%CI:1.435~4.365,P=0.001]和N分期[HR=1.349,95%CI:1.155~1.575,P<0.01]为影响胃癌预后的风险因素。

图1 临床指标单因素COX回归分析Fig.1 Univariate COX regression analysis of clinical indexes
2.3 多因素COX回归分析
将影响患者预后的临床指标(年龄、T分期、M分期、N分期)与影响患者术后生存率的20个免疫相关基因合并进行多因素COX回归分析。如图2所示:临床指标中,年龄[HR=1.054,95%CI:1.030~1.078,P<0.01]、M分期[HR=2.596,95%CI:1.217~5.537,P=0.014]和N分期[HR=1.276,95%CI:1.050~1.551,P=0.014]为影响胃癌术后的独立风险因素。在基因指标中:NOX4基因[HR=3.008,95%CI:1.706~5.306,P<0.01]、SLC22A17基因[HR=1.087,95%CI:1.024~1.154,P=0.007]和DKK1基因[HR=1.003,95%CI:1.000~1.007,P=0.039]为影响胃癌预后的独立风险因素,且这3个基因的表达量越高,患者预后越差。

图2 多因素COX回归分析Fig.2 Multivariate COX regression analysis
2.4 预后免疫相关基因对患者总体生存率的影响
如图3所示:高表达NOX4基因(χ2= 4.2,P=0.041)、SLC22A17基因(χ2= 6.6,P=0.010)、DKK1基因(χ2= 7.4,P=0.007)患者的术后总体生存率明显低于低表达组患者,差异均有统计学意义。
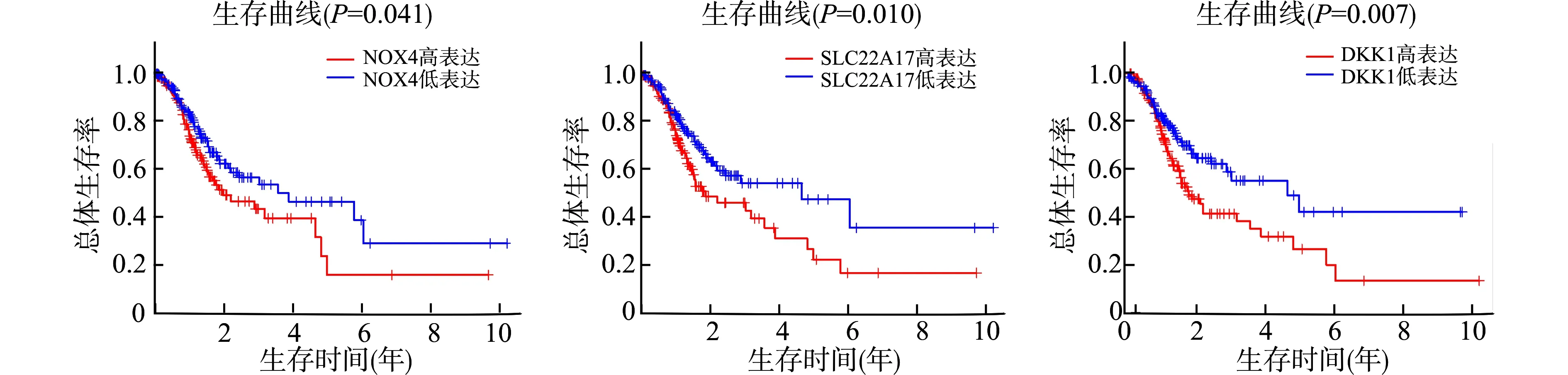
图3 预后免疫相关基因生存曲线Fig.3 Survival curves of prognostic immune-related genes
2.5 预后免疫相关基因表达量分析
如图4所示:在肿瘤组织中NOX4基因、DKK1基因表达量明显高于正常组织(均P<0.05),而SLC22A1基因在肿瘤组织中表达量的中位值低于正常组织(P<0.01)。
2.6 预后免疫相关基因与临床病理指标的相关性分析
通过R软件,采用Kruskal-Wallis检验方法对病理分级和病理分期(T、N、M)进行检验。NOX4、SLC22A17、DKK1基因的表达在N分期和M分期中均无统计学差异,因此未绘制图形。如图5所示:在T分期中,随着T分期的进展NOX4基因和SLC22A17基因表达量有逐渐增高趋势,而DKK1基因在T2和T3期的基因表达量相对较高,差异均具有统计学意义。在病理分级中,NOX4基因和SLC22A17基因在不同病理分级中表达不同,但没有明显的上升趋势,DKK1基因表达在各病理分级中的差异无统计学意义。

图4 预后免疫相关基因在正常组织和肿瘤组织的表达量Fig.4 Expression of prognostic immune-related genes in normal and tumor tissues

图5 预后免疫相关基因与临床病理指标相关性分析Fig.5 Analysis of the correlation between prognostic immune-related genes and clinicopathological indexes
2.7 预后免疫相关基因与免疫细胞浸润量的相关性分析
通过TIMER免疫细胞数据库[9-10]探索NOX4、SLC22A17及DKK1基因与免疫细胞浸润量的相关性,相关性分析采用Spearman相关分析法。如表1所示:NOX4基因表达与B细胞浸润量、CD8+T细胞浸润量、CD4+T细胞浸润量、巨噬细胞浸润量、中性粒细胞浸润量和树突状细胞浸润量之间均具有明显相关性,差异均具有统计学意义。SLC22A17基因表达量与B细胞浸润量、CD8+T细胞浸润量、CD4+T细胞浸润量、巨噬细胞浸润量、中性粒细胞浸润量和树突状细胞浸润量之间均具有明显相关性,差异均具有统计学意义。DKK1基因表达量与CD8+T细胞浸润量和巨噬细胞浸润量之间具有明显相关性,差异均具有统计学意义。

表1 预后免疫相关基因与免疫细胞浸润量的相关性分析Table 1 Analysis of the relationship between prognostic immune-related genes and immune cell infiltration
2.8 预后免疫相关基因与肿瘤微环境相关性分析
基质细胞和免疫细胞是构成肿瘤微环境的重要组成部分,通过R语言“estimate”包采用“ESTIMATE”免疫评分算法[11]对基质细胞和免疫细胞进行评分,并计算其与NOX4、SLC22A17及DKK1基因表达的相关性,相关性方法也采用Spearman相关系数法。如表2所示:NOX4基因表达量与基质细胞评分、免疫细胞评分及总评分之间均呈正相关(P<0.01)。SLC22A17基因与基质细胞评分、免疫细胞评分及总评分之间也均呈正相关(P<0.01)。而DKK1基因表达与肿瘤微环境的基质细胞及免疫细胞均无相关关系。
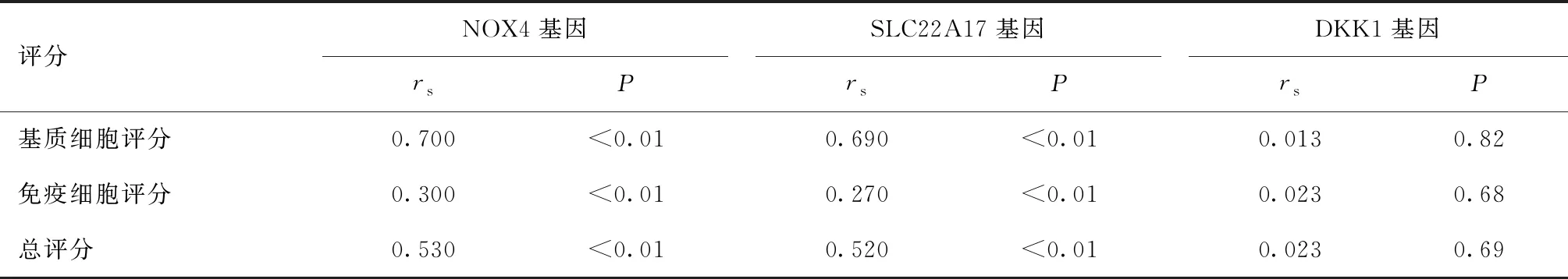
表2 预后免疫相关基因与肿瘤微环境相关性分析Table 2 Analysis of the relationship between prognostic immune-related genes and tumor microenvironment
2.9 免疫相关基因的通路富集分析
通过R软件“org.Hs.eg.db”包对影响胃癌术后总体生存率的20个基因进行GO(Gene Ontology)通路富集分析和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析。将20个基因全部纳入后,富集分析分析的通路相对更为准确且同时可以缩小寻找NOX4、SLC22A17及DKK1基因通路的研究范围。通过GO富集分析(BP、CC、MF分别代表生物过程、细胞组成、分子功能3种富集分析方法)发现346条有统计学意义的基因通路;通过KEGG富集分析,发现7条有统计学意义的基因通路。筛选各种富集分析方法中有意义的前10条基因通路绘制图6。从图中可知与预后相关的免疫相关基因可能与细胞因子生物合成过程的调控(regulation of cytokine biosynthetic process)、细胞因子代谢过程(cytokine metabolic process)和细胞因子受体间相互作用(Cytokine-cytokine receptor interaction)等基因通路具有一定相关性。

图6 GO、KEGG基因通路富集分析Fig.6 Gene pathway enrichment analysis by GO and KEGG
3 讨论
免疫相关基因是指通过研究鉴别出来的与免疫反应个别通路或部分通路明显相关的基因。本研究通过Kaplan-Meier法筛选出来的20个与免疫相关的基因,均影响胃癌患者的术后总体生存率,通过GO和KEGG生物富集分析,我们也发现这些影响肿瘤预后的基因表达量与多条细胞因子通路和免疫突触具有明显的相关性。通过多因素COX回归分析,我们筛选出3个影响胃癌预后的独立风险基因:NOX4、SLC22A17和DKK1基因。其中NOX4基因(NADPH Oxidase 4,NADPH氧化酶4)有研究表明其可依赖脂肪酸氧化促进巨噬细胞NLRP3炎症小体激活[12]。在胃癌中通过RNAi介导的NOX4沉默调节JAK2/STAT3信号通路可抑制胃癌细胞的侵袭[13],也可诱导通过GLI1途径调节胃癌细胞的增殖和凋亡[14]。在通过GO法富集到的346条有统计学意义的基因通路中,与NOX4基因相关的有45条,其中还与DNA生物合成的调控(positive regulation of DNA biosynthetic process)、丝氨酸/苏氨酸激酶活性的调控(positive regulation of protein serine/threonine kinase activity)等信号通路明显相关。目前关于SLC22A17基因(solute carrier family 22 member 17,溶质载体家族蛋白22成员17)在胃癌中的研究尚未见文献报道,但有文献表明,SLC22A17基因与脂钙蛋白2(lipocalin2,Lcn2)基因协同参与子宫内膜癌细胞的侵袭过程[15]。通过上文分析我们发现SLC22A17基因在肿瘤组织中表达量的中位值低于正常组织(P<0.01)。这在基因与肿瘤预后的研究中也是非常常见的现象,因为SLC22A17基因为蛋白编码基因,mRNA基因高表达并不代表着蛋白水平高表达,肿瘤的发生、发展过程是一个非常复杂的生物学过程,对于促癌基因在肿瘤中的基因表达水平也可能低于正常组织。通过富集分析我们发现SLC22A17基因与辅因子输运(cofactor transport)通路具有明显的相关性。而对于DKK1基因(dickkopf Wnt signaling pathway inhibitor 1,Dickkopf-Wnt信号通路抑制剂1),单纯从基因的命名上来看我们就知道DKK1基因与Wnt信号通路具有明显的相关性,通过富集分析,我们发现与DKK1基因表达具有明显相关的信号通路有100条,而与Wnt信号通路有相关性的有4条,分别为:非典型Wnt信号通路的正调控(positive regulation of non-canonical Wnt signaling pathway)、Wnt信号通路与细胞极性通路(regulation of Wnt signaling pathway,planar cell polarity pathway)、非典型Wnt信号通路的调控(regulation of non-canonical Wnt signaling pathway)、Wnt信号通路与钙调节通路(Wnt signaling pathway,calcium modulating pathway)。通过检索文献我们发现DKK1基因与MIR-493基因相互作用,共同调控胃癌细胞的侵袭[16]。也有文献表明DKK1基因受启动子甲基化的调控,影响胆汁酸诱导的胃黏膜肠化生[17]。因此,基于DKK1基因的免疫调控作用,有学者研究证明,抗DKK1的抗体DKN-01可以作为免疫调节剂用于肿瘤的治疗[18]。
肿瘤免疫治疗是近年来研究的热点[19],最常见且较易检测的免疫细胞包括6种:B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞、树突状状细胞。通过TIMER免疫数据库对NOX4、SLC22A17和DKK1基因与免疫细胞浸润量进行相关性研究,我们发现NOX4和SLC22A17基因表达量与这6种免疫细胞的相关性均具有统计学意义,DKK1基因表达量与CD8+T细胞、巨噬细胞的浸润量的相关性具有统计学意义,这也再次说明了筛选出来的3个独立预后的免疫相关基因与肿瘤免疫密切相关。同时我们也发现这3个基因在胃癌患者中均与巨噬细胞的浸润量具有明显相关性,这一结论与很多文献一致[20-22]。目前很多文献的研究结果均表明胃癌患者的预后与巨噬细胞的浸润量明显相关。
胃癌患者的术后总体生存率是由多项临床指标和基因表达共同影响的[23],近年来越来越多的研究者发现肿瘤微环境也是影响肿瘤预后的关键因素[24]。通常肿瘤微环境由肿瘤细胞、基质细胞[25]、免疫细胞及各种细胞因子[26]共同组成,这些组成部分之间相互作用,生物学过程复杂[27]。通常以肿瘤纯度评估肿瘤细胞含量的多少,肿瘤纯度一般与基质细胞和免疫细胞的含量呈负相关关系。通过本研究我们也发现NOX4基因和SLC22A17基因与免疫细胞评分、基质细胞评分及二者相加的总评分之间均呈正相关(均P<0.01)。因此也说明了NOX4基因和SLC22A17基因对胃癌患者总体生存率的影响,可能也有免疫系统的作用。
总之,本研究使我们加深了对胃癌的免疫相关基因的认识,同时也筛选出了所有影响预后的风险免疫相关基因。通过对免疫细胞、基质细胞、基因通路的进一步探索,也为我们的下一步研究明确了方向,对胃癌的免疫治疗具有一定的临床意义。

