二代测序技术在急性髓系白血病患者预后中的应用价值
牛晓娜 葛菲 郭宏岗 陈香丽 郭建民
急性髓系白血病(Acute myeloid leukemia,AML)是成人中最常见急性白血病类型,以中老年人居多。AML 发病过程中,每个群体不同时间段里经历不同的遗传学改变,致使染色体核型、基因突变类型及临床特征有很大异质性,而这些异质性是预后差异的基础[1-2]。现阶段,临床已将AML患者分子生物学层面纳入危险度分层系统,分为预后良好、预后中等、预后不良。随着高通量基因测序技术的发展,国内外学者研究了AML 相关基因突变及其在疾病发生中的机制,并已明确了一些特殊类型的突变或融合基因用于指导治疗方案的制定[3-4]。本研究尝试分析二代测序(Next-generation sequencing,NGS)技术下AML 患者基因突变情况,并探讨具体基因突变类型对预后及生存状况的影响。报道如下。
1 资料与方法
1.1 一般资料
选取本院2016年1月至2018年6月确诊的298例AML 患者作为研究对象,男186 例,女112 例,年龄≥45 岁120 例,年龄<45 岁178 例。纳入标准:①均符合AML 诊断标准[5];②经骨髓和外周血细胞形态学检查、流式免疫分型、骨髓活检、染色体核型分析等检查确诊;③患者知情同意。排除标准:治疗相关性白血病、MDS 或MPN 转化白血病等继发白血病患者。研究经本院医学伦理委员会审批同意。
1.2 方法
1.2.1 检测方法
抽取患者骨髓液4~6 mL,EDTA 抗凝,分离并收集骨髓单个核细胞,柱式抽提试剂盒提取DNA,采用AML/MDS-NGS 芯片(上海源奇生物医药科技有限公司)进行基因突变检测,涵盖ASXL1、NPM1、
FLT3、KIT、DNMT3A、CEBPA、IDH、EZH2、TET2、RUNX1、TP53、SF3B1、PHF6、SRSF2、RAS、U2AF1、JAK等基因的热点突变区域,测序深度3 000×。
1.2.2 治疗方法
年龄≤60 岁者,予IA3+7 方案(去甲氧柔红霉素8~12 mg/m2×3 d+阿糖胞苷100 mg/m2×7 d)诱导化疗;年龄>60 岁者,予DA3+7 方案或CAG(阿克拉霉素10~14 mg/m2×4 d+阿糖胞苷10 mg/m2,2 次/d×14 d+集落刺激因子300 μg/d)等预激方案诱导化疗。完全缓解(CR)后进入巩固阶段,予中、大剂量阿糖胞苷单药至少4 个疗程。
1.3 观察指标
①AML 基因突变频率及分布情况。②根据《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)》[6]中预后危险度分级分为预后良好组、预后中等组、预后不良组,对比3 组临床资料、基因突变频率、主要基因突变类型。③基因突变与预后的关系。④伴或不伴基因突变对无病生存期、总生存期的影响。⑤不同基因突变类型对中位无病生存期的影响。
1.4 统计学方法
采用SPSS 22.0 统计软件进行数据分析;计数资料以n(%)表示,采用χ2检验;符合正态分布的计量资料采用(±s)表示,组间比较用独立样本t检验。预后影响因素分析应用Logistic 回归分析;Kaplan-Meier 生存曲线分析伴基因突变、NPM1、FLT3-ITD、DNMT3A、TET2 突变阳性与患者生存期的关系,采用Log-Rank 检验;P<0.05 为差异有统计学意义。
2 结果
2.1 AML 基因突变频率及分布情况
298 例AML 患者中位突变数目为两个(0~6),其中256 例可检测到基因突变,占85.91%;≥3 种基因突变71 例,占23.83%。突变频率最高的前5 个基因分别为NPM1、FLT3-ITD、CEBPA、DNMT3A、TET2。见图1。
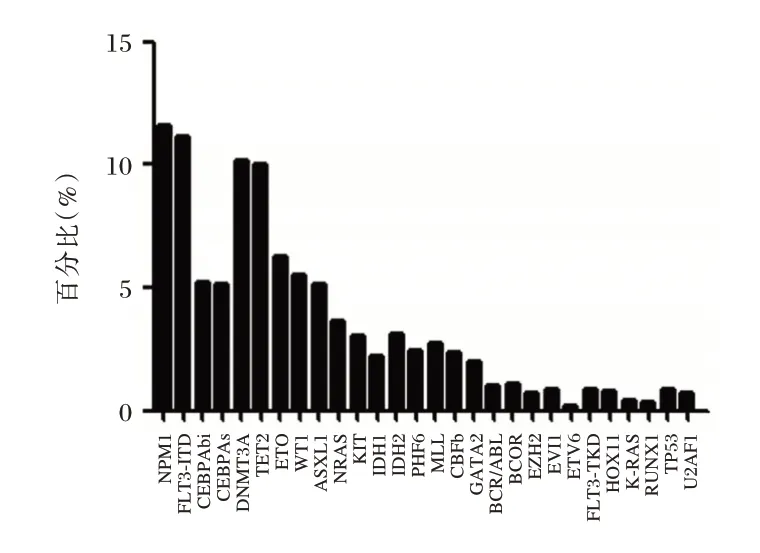
图1 AML 基因突变频率及分布情况Figure 1 Frequency and distribution of AML gene mutations
2.2 3 组临床资料、基因突变频率
3 组初诊骨髓原始细胞、附加染色体异常、伴基因突变、NPM1、FLT3-ITD、CEBPA、DNMT3A、TET2突变阳性比例比较,差异有统计学意义(P<0.05)。见表1。
2.3 基因突变与预后不良的关系
将初诊骨髓原始细胞、附加染色体异常等其他因素控制后,伴基因突变、FLT3-ITD、DNMT3A、TET2突变阳性仍与预后不良显著相关(P<0.05);CEBPA突变阳性与预后不良无关。见表2。
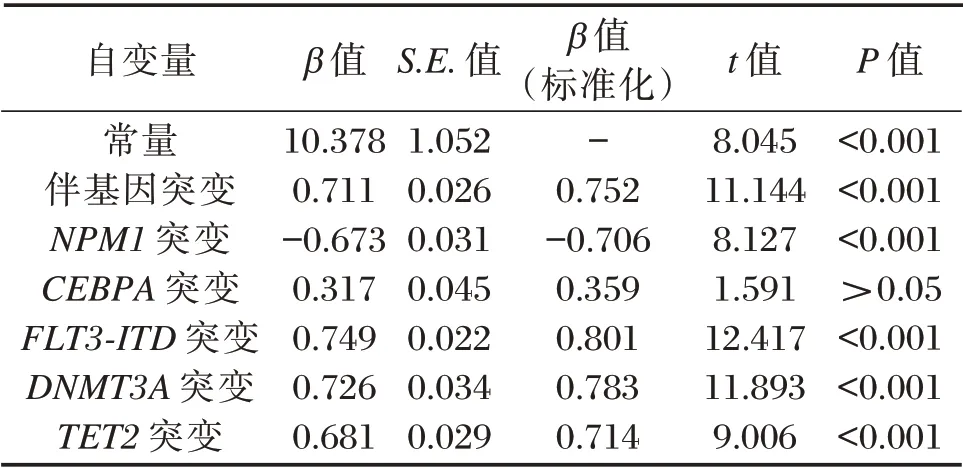
表2 基因突变与预后不良的关系Table 2 Relationship between gene mutation and poor prognosis
2.4 基因突变对无病生存期、总生存期的影响
随访两年,脱落8 例。伴基因突变的AML 患者中位无病生存期11.87 个月短于不伴基因突变的AML 患者15.07 个月(χ2=5.168,P=0.023)。见图2。
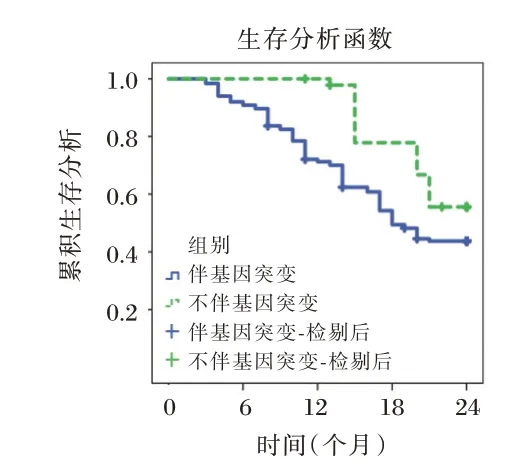
图2 基因突变对中位无病生存期的影响Figure 2 The effect of gene mutations on median diseasefree survival
2.5 不同基因突变类型对中位无病生存期的影响
Kaplan-Meier 曲线分析,NPM1突变阳性的AML 患者中位生存期14.71 个月长于阴性患者11.63 个月,FLT3-ITD、DNMT3A、TET2突变阳性的AML 患者中位无病生存期11.06 个月、11.24 个月、11.32 个月短于FLT3-ITD、DNMT3A、TET2突变阴性的AML 患者15.73 个月、14.86 个月、14.19 个月,差异有统计学意义(χ2=5.223、6.277、5.341、7.552,P=0.022、0.012、0.021、0.006)。见图3。
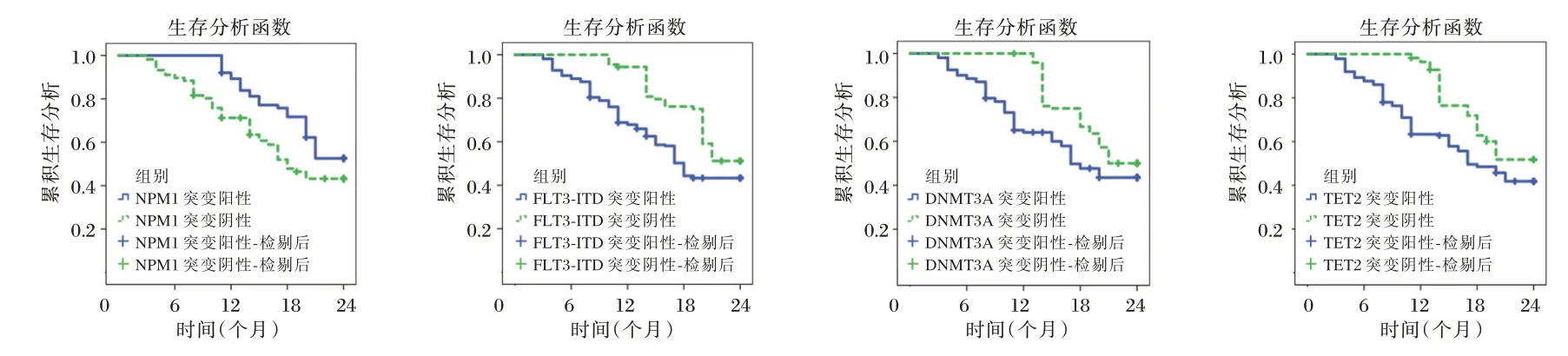
图3 不同基因突变类型对中位无病生存期的影响Figure 3 The effect of different gene mutation types on median disease-free survival
3 讨论
NGS 技术在大型综合基因组分析的应用极大提高了临床对AML 发生、发展机制的认识,重现性基因突变的不断发现打开了相关机制研究的思路。2016年WHO 对AML 分类再次做了更新[7],NPM1、CEBPA、RUNX1等突变均已被纳入AML 诊断参考,为AML 做进一步的精细分层。
现阶段,采用NGS 技术探索AML 患者基因突变谱的大样本数据有限,美国癌症基因谱研究网络报道病例数为200 例,欧洲多中心数据共纳入1 540例患者,国内多个研究中心,包括苏州大学附属第一医院、上海7 家综合性医院等[8-11]也发表了各自数据。虽然各中心检测的目标基因略有不同,但都基本覆盖了NPM1、FLT3、IDH、DNMT3A、TET2、TP53、RUNX1、RAS、WT1、CEBPA等AML 常见基因。本研究与美国多中心数据22%相近,高于上海7 家综合性医院报道的数据13%。从基因突变结果看,AML 伴NPM1突变患者占11.62%,与国内其他中心数据相似,但明显低于美国人群(27%)与欧洲人群(28%)。产生差异的原因尚不明确,是否与患者种族、生活方式、生活环境等有关还期待更多数据支持。伴DNMT3A突变的患者占10.15%,苏医一附院6%,上海7 家综合性医院9%,均低于美国数据(26%)。研究证实,DNMT3A突变与诊断时的高白细胞、老年和不良预后有关[12]。上海7 家综合性医院对入组患者进行年龄分层后发现,50 岁以上患者DNMT3A突变频率是50 岁以下患者的3倍以上。苏医一附院患者中位年龄42 岁,而美国患者中位年龄55 岁。故推测各中心患者中位年龄可能是数据差异的原因之一。
NPMl突变在成人AML 中的中位年龄偏高,血小板、白细胞数目较高,且与CD34 和CDll7 低表达相关[13]。研究显示,NPMl突变预示化疗后易达到CR[14]。本研究发现,NPM1突变阳性者预后好。FLT3-ITD突变的AML 患者外周血骨髓原始细胞比例、白细胞数较高,CR 率和总生存率偏都偏低,复发率偏高[15]。本研究发现,FLT3-ITD基因突变是预后不良因素。DNMT3A基因贯穿造血干细胞自我更新、分化和抑癌基因失活、原癌基因激活的过程,该基因突变在AML 发病机制中起着举足轻重的作用。Meta 分析显示,DNMT3A基因突变是AML 患者第一疗程缓解率和总体生存率的危险因素[16]。本研究结果提示,DNMT3A突变阳性提示预后不良。目前,TET2基因突变在评估疾病预后方面尚无统一结论。本研究数据显示,TET2突变阳性者生存期短,与李佳佳等[17]研究一致,但TET2基因突变易发生在年龄偏大的患者中,而年龄不同治疗方案不一,故预后可能受到年龄及治疗方案影响,可能导致数据偏移,仍需扩大样本数排除影响因素进行进一步分析。
综上可知,不同预后AML 患者基因突变频率存在差异,伴基因突变及FLT3-ITD、DNMT3A、TET2突变阳性者生存期短,预后差,而NPM1突变阳性者与之相反。