西格列汀与格列美脲联合二甲双胍治疗初诊2型糖尿病并高糖毒性患者的有效性及安全性比较:一项随机对照非劣效性研究
何明倩,王静雅,邓 梅,施秉银,隋 婧
(1. 西安交通大学第一附属医院内分泌科,陕西西安 710061;2. 山东省单县中心医院内分泌科,山东菏泽 274300;3. 西安交通大学第一附属医院内分泌科涉外病房,陕西西安 710061)
全球糖尿病的发病率及患者的数量迅速增加,国际糖尿病联盟(IDF)统计,2017年全球糖尿病患者人数已达4.25亿,糖尿病的全球医疗花费高达7 270亿美元[1]。2017年《JAMA》刊登的中国最新糖尿病流行病学调查结果显示,目前中国糖尿病患病率高达10.9%,而糖尿病患者中知晓率仅为36.5%,控制率仅为49.2%[2]。糖尿病患者的数量急剧增加,控制率却很低,因此探讨更为有效的治疗措施已迫在眉睫。
高糖毒性,即“胰岛β细胞葡萄糖毒性”,指患者体内血糖呈持续性增高,长期高血糖状态导致胰岛β细胞非生理性和不可逆性的损伤,高糖毒性作用进一步抑制β细胞分泌功能,随之β细胞功能进一步衰竭[3]。《2018 ADA/EASD 2型糖尿病高血糖管理共识》及《中国2型糖尿病防治指南(2017年版)》等中外指南均推荐:对于糖化血红蛋白(hemoglobin A1c, HbA1c)≥9.0%或空腹血糖(fasting plasma glucose, FPG)≥11.1 mmol/L伴显著高血糖症状的新诊断2型糖尿病患者可实施短期胰岛素强化治疗[4-6]。然而,对初诊2型糖尿病患者使用胰岛素治疗非常困难,相比较胰岛素注射治疗,口服降糖药物治疗操作简单,易于实行。然而,口服药物治疗初发2型糖尿病高糖毒性患者的研究报道较少。DPP-4抑制剂通过抑制二肽基肽酶-4(DPP-4)活性,有效减少胰高血糖素样肽-1(GLP-1)的失活,在生理范围内增加有活性的GLP-1水平,以葡萄糖浓度依赖的方式促进胰岛素释放,并降低胰高血糖素水平[7-8]。格列美脲作为磺脲类药物,通过与胰岛β细胞表面磺脲类受体的亚单位相结合,关闭ATP依赖性钾通道而快速刺激胰岛素分泌[9],也是《中国2型糖尿病防治指南(2017年版)》推荐的常用降糖药物之一。
目前初诊2型糖尿病伴高糖毒性患者口服降糖药如何选择在国内外临床试验数据有限。本研究选择HbA1c≥9.0%和FPG≥11.1 mmol/L的初诊2型糖尿病伴高糖毒性患者,探讨西格列汀联合二甲双胍较格列美脲治疗的疗效性及安全性评估,以及对胰岛分泌功能以及胰岛素抵抗的作用,为初诊2型糖尿病伴高糖毒性患者提供安全、有效、方便的治疗方案。
1 对象和方法
1.1 研究对象本研究经西安交通大学第一附属医院伦理委员会批准(XJTU1AF2016LSL-048),所有研究对象在研究开始前均知情同意并签署知情同意。
1.1.1入选标准 研究人群来自2014年1月1日至2019年1月1日西安交通大学第一附属医院内分泌科门诊初诊2型糖尿病高糖毒性患者156例,纳入标准:①能够理解研究目的,自愿参加并签署知情同意书;②初诊2型糖尿病,未服用任何降糖药物;③年龄18~70周岁,体质量指数(body mass index, BMI)18~30 kg/m2;④肝、肾功能无明显异常[ALT/AST小于正常值上限的2.5倍;血清肌酐正常;尿酮体≤(1+)];⑤FPG≥200 mg/mL(11.1 mmol/L)和HbA1c≥9.0%;⑥能够依从研究者决定的降糖方案和糖尿病饮食,并能够按照要求使用血糖仪监测指尖FPG和餐后2 h血糖。
1.1.2排除标准 ①1型糖尿病患者;②肝、肾功能损害:ALT/AST大于正常值上限的2.5倍;血清肌酐大于正常值上限的1.2倍;③筛选前曾使用降糖药物;④筛选前出现严重酮症或酮症酸中毒或高渗高血糖综合征;⑤正在使用糖皮质激素、免疫抑制剂或细胞毒性药物治疗,既往有胰腺炎病史或胰腺手术史;⑥严重的全身性疾病(如心血管系统、呼吸系统、消化系统、神经系统、内分泌系统、泌尿生殖系统疾病、重度贫血等)、恶性肿瘤、精神疾病及其他可能干扰本研究结果的疾病;⑦妊娠及哺乳期女性;⑧对西格列汀、格列美脲过敏的患者;⑨研究者判断患者依从性差,无法按照要求完成研究。
1.2 研究方法
1.2.1试验设计 本研究采用随机、对照的非劣效性研究设计。将符合入选条件的受试者,由研究医师根据入组顺序和内分泌科门诊护士站提供的随机数字表上的数字(由第三方产生随机序列,并密封于不透光的信封内),随机分为研究组与对照组。
1.2.2干预措施 研究组给予西格列汀(捷诺维100 mg,每日1次口服, 默沙东公司)联合二甲双胍(格华止,500 mg每日3次口服,施贵宝公司)治疗1月,1月后单用二甲双胍治疗2月;对照组给予格列美脲(亚莫利,2 mg每日1次口服,赛诺菲公司)联合二甲双胍(格华止500 mg,每日3次口服,施贵宝公司)治疗1月,1月后单用二甲双胍治疗2月。
1.2.3随访过程 第1次随访为研究开始前以筛选合适的患者,符合要求的2型糖尿病患者将在第2次随访(即研究开始)时接受药物治疗。随后进入12周的治疗期,随后的4次现场访视在第2、4、8、12周进行,每周电话随访患者,记录低血糖发生的次数和时间,血糖监测情况;记录治疗期间与本研究药物有关的和无关的不良反应,由研究者判定是否与本研究方案相关。
1.2.4结局指标 主要疗效指标为治疗3个月后HbA1c的降幅。次要疗效指标为治疗3个月后FPG、体质量、BMI的变化,血糖达标时间,FPG和HbA1c达标率。
初诊及每次随访时均测量身高、体质量、腰围、臀围, 精确至0.1 kg和0.1 cm,计算体质量指数(BMI=体质量kg/身高m2);由固定人员操作。分别于治疗第0、2、4、8、12周随访测定两组患者血清FPG、血脂系列、尿常规等生化指标,12周随访测定两组患者HbA1c,计算FPG<6.1 mmol/L及FPG<7.2 mmol/L的达标率,比较两组血糖控制情况及血糖达标时间差异;于治疗第12周行口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)+同步胰岛素释放,测定空腹胰岛素(FINS),服糖粉后60 min、120 min和180 min血清胰岛素水平,计算胰岛β功能相关指标:HOMA-IR,HOMA-β,血糖曲线下面积(AUC-PG),胰岛素曲线下面积(AUC-INS),△I60/△G60,Ip/I0,DI及改良β细胞功能指数(MBCI),比较上述指标的组间差异,评估胰岛功能。具体计算公式如下[10-12]:
HOMA-IR=FINS×FPG/22.5; HOMA-β=20×FINS/(FPG-3.5)
AUC-PG=(PG0 min+PG60 min)/2+PG120 min+PG180 min
AUC-INS=(INS0 min+INS60 min)/2+INS120 min+INS180 min
△I60/△G60=(INS60 min-INS0 min)/(PG60 min-PG0 min)
Ip/I0=peak insulin/fasting insulin
DI=(△I60/△G60)/HOMA-IR
MBCI=(INS0 min×PG0 min)/(PG120 min+PG60 min-2×PG0 min)
1.2.5安全性评价指标 主要的安全性指标包括受试者主诉、研究者访视和体格检查中发现的不良事件、实验室检查指标中有临床意义的异常变化、低血糖的发生率以及药物耐受性等。
不良反应判定:用药期间出现恶心呕吐腹泻,皮疹皮肤红痒等症状及时记录,无法耐受者退出试验,化验肝肾功能出现异常者退出试验;根据2018年ADA对低血糖分类标准[4],出现严重低血糖(出现中枢神经系统症状,自己无法处理),轻度低血糖(有低血糖症状且指尖血糖<3.9 mmol/L,可自行进食后缓解)、低血糖症状(仅有低血糖症状且指尖血糖>3.9 mmol/L)者分别进行记录。
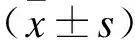
根据主要疗效指标HbA1c在3个月后距基线的差值(△HbA1c)计算样本量。根据既往文献报道,设定非劣效界值为δ=-0.65%,标准差经估算约为σ=1.4,同时设定α=0.05(单侧),β=0.15,把握度1-β=0.85。采用样本量计算软件PASS按照非劣效性研究计算,得到每组所需样本量为51例,考虑脱落、剔除等因素,最终确定样本量为每组60例。
2 结 果
2.1 基线资料本研究共筛选156例受试者,随机化129例,研究组随机入组66例,最终纳入分析61例,对照组随机入组63例,最终纳入分析53例(具体受试者纳入流程图见图1)。两组患者性别、年龄、身高、体质量、BMI、FPG、HbA1c等基线资料比较差异无统计学意义(P>0.05,表1),提示2组受试者之间具有良好的可比性。

图1 受试者纳入流程图
2.2 有效性评价
2.2.1HbA1c降幅及达标率 治疗3个月后,西格列汀组和格列美脲组的HbA1c平均降幅分别为(4.03±1.47)%和(4.13±1.50)%。与基线相比均可见显著下降(P<0.05)。研究组与对照组间HbA1c平均降幅差值的最小二乘均数以及双侧95%置信区间为-0.097(-0.648,0.453)%,下限为-0.648%,大于预先设定的-0.65%的非劣效界值,提示主要疗效指标的非劣效性假设成立。

表1 两组患者的基线资料特征
此外,结果显示治疗3个月后,西格列汀组与格列美脲组患者HbA1c的达标率无统计学差异(P>0.05,图2)。

图2 FPG及HbA1c达标率比较
2.2.2FPG的降幅及达标率 结果显示,西格列汀组患者FPG达到正常值所需时间短(P<0.05,图3),1个月后两组患者FPG均较基线有明显下降(P<0.05,表2),且西格列汀组患者FPG更低,较基线下降幅度更大,治疗1个月时两组患者FPG差异有统计学意义(P<0.05,表3、图4);治疗3个月后,两组患者FPG及其较基线下降幅度无统计学差异(P>0.05,表4、图4),两组间相比无统计学差异;HbA1c均明显下降(P<0.05,表2)。治疗1月后FPG<6.1 mmol/L达标率,西格列汀组明显高于格列美脲组,有统计学差异(P<0.05,图2A);而FPG<7.2 mmol/L达标率,西格列汀组轻度高于格列美脲组,无统计学差异。治疗3月后FPG及HbA1c达标率,西格列汀组与格列美脲组无统计学差异(P>0.05,图2B、图2C)。西格列汀组与格列美脲组相比,患者FPG达标时间短,FPG水平更低,治疗1个月后FPG<6.1 mmol/L达标率高,提示西格列汀可以在更短时间内控制高血糖水平,降糖效果更好。

图3 FPG达标时间比较
2.2.3体质量变化 治疗1个月后,西格列汀组患者体质量及BMI较基线水平显著降低,而格列美脲组患者则较基线水平显著升高(P<0.05,表2),且体质量变化程度有统计学意义(P<0.05,表3)。治疗3个月后,两组患者体质量及BMI较基线差异均无统计学意义(P>0.05,表2),但两组患者上述两指标的变化程度差异有统计学意义(P<0.05,表4)。因此,使用西格列汀有利于降低患者体质量及BMI,而格列美脲会增加体质量和BMI。
2.2.4胰岛β细胞功能评估 治疗3个月后对患者进行口服葡萄糖耐量试验,计算胰岛素抵抗及胰岛β细胞功能相关指标,两组患者胰岛β细胞功能指标HOMA-IR、HOMA-β、AUC-PG、AUC-INS、△I60/△G60、Ip/I0、DI及MBCI均未见明显差异(P>0.05,表5)。

表2 1个月及3个月治疗前后各指标值及与基线比较的变化Tab.2 Changes in the values of each index before and after treatmentin January and March compared with the baseline

表3 治疗1个月后各指标的比较Tab.3 Comparison of all indexes after 1 month of treatment

图4 FPG变化趋势
2.3 安全性评价在治疗观察的3个月内,西格列汀组2例患者出现低血糖症状,格列美脲组6例患者出现低血糖症状,其中2例出现轻度低血糖,自行进食后症状缓解,两组相比无统计学差异;未观察到其他不良反应。
3 讨 论
在糖尿病人群中,初诊2型糖尿病伴高糖毒性患者是特殊而复杂的群体,如何优化降糖方案对内分泌科医生仍是一个巨大的挑战。本研究专门针对初诊2型糖尿病高糖毒性患者开展,结果表明与格列美脲相比,西格列汀联合二甲双胍治疗可在短期内降低血糖,“胰岛β细胞葡萄糖毒性”是导致胰岛β细胞功能障碍的重要原因,持续高糖毒性会诱发β细胞特异性转录因子失活,诱发β细胞凋亡,抑制β细胞分泌功能,导致β细胞功能衰竭[13]。若不及时治疗,则最终会造成不可逆转的胰岛细胞损害[14]。尽早解除高糖毒性,最大限度地恢复和保护胰岛β细胞功能是研究的关键所在。研究表明,短期胰岛素强化治疗是减轻高糖毒性非常有效的方法,它能迅速缓解高葡萄糖毒性,改善胰岛素抵抗,恢复胰岛β细胞功能[15]。然而,在实际临床工作中,胰岛素治疗遇到很多的困难和问题:部分患者因害怕注射或害怕出现低血糖而拒绝胰岛素注射治疗;可能会出现血糖波动大、体质量增加,注射错误等[16]。对于需要长期治疗的慢性病,口服药物治疗是有一定优势的[17]。因此,迫切需要探索和改进治疗方案以满足个性化需求。

表4 治疗3个月后各指标的比较Tab.4 Comparison of various indexes after 3 months of treatment

表5 两组患者胰岛β细胞功能指标的对比Tab.5 Comparison of islet cell function between the two groups
GLP-1是一种肠促胰素类激素,以葡萄糖浓度依赖的方式促进胰岛素分泌;此外,还可抑制胰高血糖素分泌,维持葡萄糖稳态和延迟胃排空[18]。基于肠促胰素类药物DPP-IV抑制剂可降解和失活DPP-4酶,导致内源性GLP-1增加2~3倍[7-8]。西格列汀是一种高度选择性二肽基肽酶-4的酶抑制剂,通过增加内源性GLP-1水平,从而增加血循环中胰岛素释放,并降低胰高糖素水平来发挥其降糖作用[8,19]。西格列汀作为单一药物疗法或与其他口服抗糖尿病药物联合使用都具有良好的耐受性,且具有方便的每日1次的口服方案、对体质量的中立性、低血糖风险低、良好的疗效和安全性,是治疗2型糖尿病患者的重要选择[20-21]。
低血糖症是糖尿病的常见并发症,可能成为糖尿病发病率和死亡率的重要危险因素[4]。传统的降糖药如磺脲类药物有低血糖的风险[9]。与传统促泌剂不同,DPP-4抑制剂是以葡萄糖浓度依赖性的方式促进胰岛素分泌[21],因此降糖的同时低血糖风险降低。最新的荟萃分析汇总了58项RCT研究结果显示,DPP-4抑制剂均可以显著的降低FPG和HbA1c,低血糖发生率低[22]。本研究显示两组患者低血糖发生率无统计学差异,分析原因主要包括两个方面:一是本研究入选人群为初诊糖尿病患者,胰岛功能尚可,肝肾功能正常,对低血糖的代偿功能尚可;二是本研究降糖药物只用了1个月,用药时间短,低血糖发生率有待于进一步观察。
众所周知,约80%的糖尿病患者超重或肥胖,而体质量增加会加重胰岛素抵抗和糖尿病并发症的风险[22]。本研究发现西格列汀在发挥降糖作用的同时,还有对体质量的积极作用。本研究显示治疗1个月后,西格列汀组患者体质量及BMI较基线水平降低,而格列美脲组患者则较基线水平升高,3个月时两组患者体质量的变化程度差异有统计学意义,提示格列美脲增加体质量,而西格列汀不增加体质量,这与既往研究的结果类似[9]。因此,对于初诊高糖毒性患者,相比较格列美脲,应用西格列汀更有利于管理患者的体质量及BMI。
动物实验研究显示,DPP-4抑制剂可抑制小鼠β细胞损伤,抑制凋亡,保存胰岛结构,改善HOMA-β指数,促进β细胞再生,同时抑制胰岛α细胞增殖[8,23]。相比较格列吡嗪,西格列汀可以促进胰岛α、β细胞比例恢复,促进胰岛形态恢复正常[24]。临床研究也发现,应用西格列汀治疗3个月后,胰岛β细胞指标HOMA-β和胰岛素原/胰岛素比值明显改善[25-26]。在人类脂肪组织中,西格列汀可以改善胰岛素信号传导,增强胰岛素敏感性[27]。本研究中未发现两种药物对于改善胰岛β细胞功能相关指标的差异,分析原因主要包括两个方面:一是目前胰岛功能相关评估指标多是以空腹胰岛素和空腹血糖水平为基础,本研究入选人群为初诊糖尿病患者,胰岛功能尚可,空腹胰岛素水平和空腹血糖水平无统计学差异;二是本研究降糖药物只用了1月,用药时间短,胰岛β细胞功能指标有待于进一步观察。
本研究存在以下不足:由于本研究设计还存在局限性,如研究样本量少、观察时间短等,因此若要进一步探索两种药物对患者胰岛β细胞功能是否有影响、不良反应发生率是否有差别等问题还需更大样本量、更长时间的随机对照实验进行研究。
综上所述,本研究发现对于初诊2型糖尿病伴高糖毒性患者这个特殊而复杂的群体,与格列美脲联合二甲双胍相比,西格列汀联合二甲双胍治疗可在短期内降低血糖,FPG达标率更高,有降低体质量及BMI的趋势,低血糖风险低。因此,从疗效性及安全性综合来看,对于胰岛素注射治疗有困难的患者,西格列汀联合二甲双胍治疗服用方便,依从性好,降糖效果明显,可以作为胰岛素治疗之外的选择。

