白洋淀水域夏季细菌群落结构及与环境因子的关系
罗同阳,高庆华,董 聪,马金国,王 玥,王庆庆
(河北省微生物研究所,河北保定 071051)
白洋淀位于河北省中部,是海河流域最大的淡水湖泊,也是华北地区最大的内陆淡水湖泊,水质肥美,生物繁茂,历史上有“华北明珠”之称[1,2]。近年来随着人民生活水平提高,白洋淀旅游业发展迅速,但是由于盲目扩张,开发过程中缺乏科学的规划以及管理,水域生态系统受到过多的人为因素干扰,湖水质量恶化,生态系统受到破坏[3]。尤其是在夏季,由于气温升高,水中浮游动物、浮游植物以及鱼、虾等水生生物生长旺盛,会产生大量代谢物,加之随着降水量增多,周围工业废水和生活污水随地表径流进入湖中,加重水体污染。
在水生生态系统中,微生物群落是生物地球化学循环的基础结构,对微生物群落结构演变的研究和评价非常重要[4]。细菌是微生物的重要组成部分,其在水环境中的作用十分重要,它们能够把有机物矿化成能被浮游植物利用的无机化合物,并且是水生食物网中的重要营养环节,其群落的丰度和多样性直接受水体环境的影响,能在一定程度上反映湖泊生态系统的健康情况[5]。但是目前对于白洋淀的研究主要为浮游动物、浮游植物多样性,水环境现状分析[6-8]等方面,对于水体微生物的研究较少。近年来分子生物学发展迅速,通过高通量测序能够快速准确地获得样品中微生物群落的组成[9],因此,本研究通过16S rDNA扩增子测序分析技术,对白洋淀夏季水域进行采样,解析水体细菌群落分布特征并与环境因子进行关联分析,以期为白洋淀环境监测和污染防治提供参考依据。
1 材料与方法
1.1 采样点布设
于2019年8月份,结合白洋淀水域情况,水样调查共设置8个采样点,如图1所示,烧车淀(SCD)位于淀区最北部,水面开阔,枣林庄(ZLZ)为淀区出水口,这两地距离污染源较远,受人为活动干扰小,水质较好;圈头(QT)、光淀(GD)、采浦台(CPT)和端村(DC)属于典型水上村落,水产养殖业较发达;王家寨(WJZ)是白洋淀旅游景区,受人为活动影响较大;南刘庄(NLZ)为污水性河流入口,水质较差。
1.2 样品的采集
采集方法为使用1 L有机玻璃采水器(型号为WB-PM,北京普利特仪器有限公司)在水域表层、中层、底层各采集2 L水样,6 L水样混合均匀后采集2 L水样作为一个处理,每个采样点共三个处理。
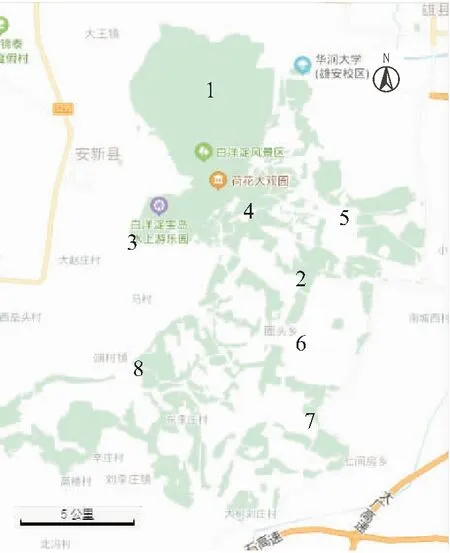
图1 白洋淀采样点布设Fig.1 Sampling sites map of the Baiyangdian lake 1.SCD;2.GD;3.NLZ;4.WJZ;5.ZLZ;6.QT;7.CPT;8.DC
1.3 水质指标的测定
采用便携式pH计(型号为pH5F平面笔式pH计,上海三信仪表厂)现场测定水温(T)及pH,塞氏盘法测定透明度(SD)。其他指标在样品带回实验室24 h内进行测定。溶解氧(DO)采用GB7489-1987《水质 溶解氧的测定 碘量法》,生化需氧量(BOD5)依据HJ 505-2009《水质 五日生化需氧量(BOD5)的测定 稀释与接种法》标准进行测定。化学需氧量(COD)、总磷(TP)和总氮(TN)通过紫外可见智能型多参数水质分析仪测定(型号为LH-3BA,华联科技)。
1.4 数据处理与分析
试验数据用Excel处理后,采用SPSS软件的One-way ANOVA程序进行显著性分析,多重比较采用Duncan方法检验,P<0.05为差异显著,测定结果以“平均值±标准差”表示。
1.5 DNA的提取及高通量测序
取1 L水样通过微孔滤膜(直径50 mm,孔径0.22 mm)进行抽滤。抽滤过后的滤膜收集于无菌培养皿中,存放干冰盒内。每个采样点三个处理的滤膜合并为一个样本送至诺禾致源公司(天津)进行样品基因组DNA提取、16S rDNA基因扩增和测序,并对数据进行多样性分析。
DNA的提取和PCR扩增:采用SDS方法对样本基因组DNA进行提取,之后用1%琼脂糖凝胶电泳检测DNA的纯度和浓度,将提取得到的DNA进行稀释备用。PCR扩增及其高通量测序采用细菌引物为(515F和806R),以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物,New England Biolabs公司的Phusion®High-Fidelity PCR Master Mix with GC Buffer进行PCR。
PCR产物的混样和纯化:PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用Qiagen公司提供的胶回收试剂盒回收产物。
文库构建和上机测序:使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和QPCR定量,文库合格后,使用Illumina NovaSeq6000进行上机测序。
2 结果与分析
2.1 水质理化性质分析
由表1可以看出,白洋淀夏季各采样点水温基本在25 ℃,差异不大,平均pH为7.95,为偏碱性湖泊。采样点之间SD差异显著,SCD和ZLZ两地透明度较高,均超过100 cm,水质较清澈。各采样点DO含量较高,平均值可达16.67 mg/L。COD含量在12.04~65.47 mg/L波动,WJZ含量最低。BOD5含量为1.26~5.43 mg/L,SCD、CPT和DC含量相对较高,与其他地区差异显著。TN的浓度在1.11~4.71 mg/L之间波动,含量最高水域为NLZ,差异显著,最低为SCD。不同样点间TP浓度差异也较大,在0.025~0.145 mg/L之间波动,DC含量最高,ZLZ含量最低。
2.2 细菌多样性分析
Alpha多样性指数可以反映出样本内的微生物群落多样性。Coverage指数代表测序对物种的覆盖度,表2中Coverage指数均大于0.99,说明样本测序结果可以反映样品的真实情况。稀释曲线(图2)基本趋于平缓,也反映出测序深度达到要求,可信度较高。Chao1指数和Ace指数常用于物种丰富度的评价,由表可以看出白洋淀整体细菌群落丰富度较高,其中GD地区细菌丰富度最高,QT地区丰富度最低。Shannon指数和Simpson指数通常被用来评价微生物群落多样性,Shannon指数越高,物种多样性越好,稳定性越强;Simpson指数越高,群落多样性越低,稳定性越差[10]。表中可以看出Shannon指数较高,为7.151~8.443,Simpson指数较低,为0.986~0.992,说明白洋淀各采样点微生物群落多样性较丰富,稳定性较好,且同样以GD地区多样性最为丰富。
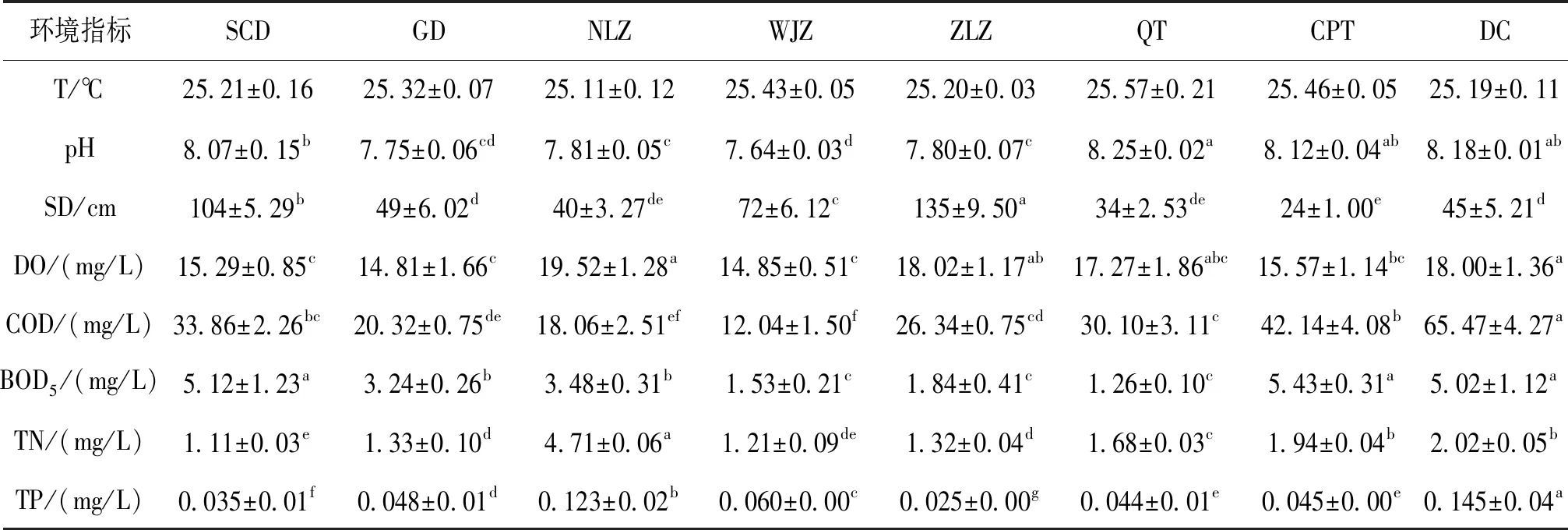
表1 白洋淀水质理化指标Tab.1 Physical and chemical properties of Baiyangdian lake
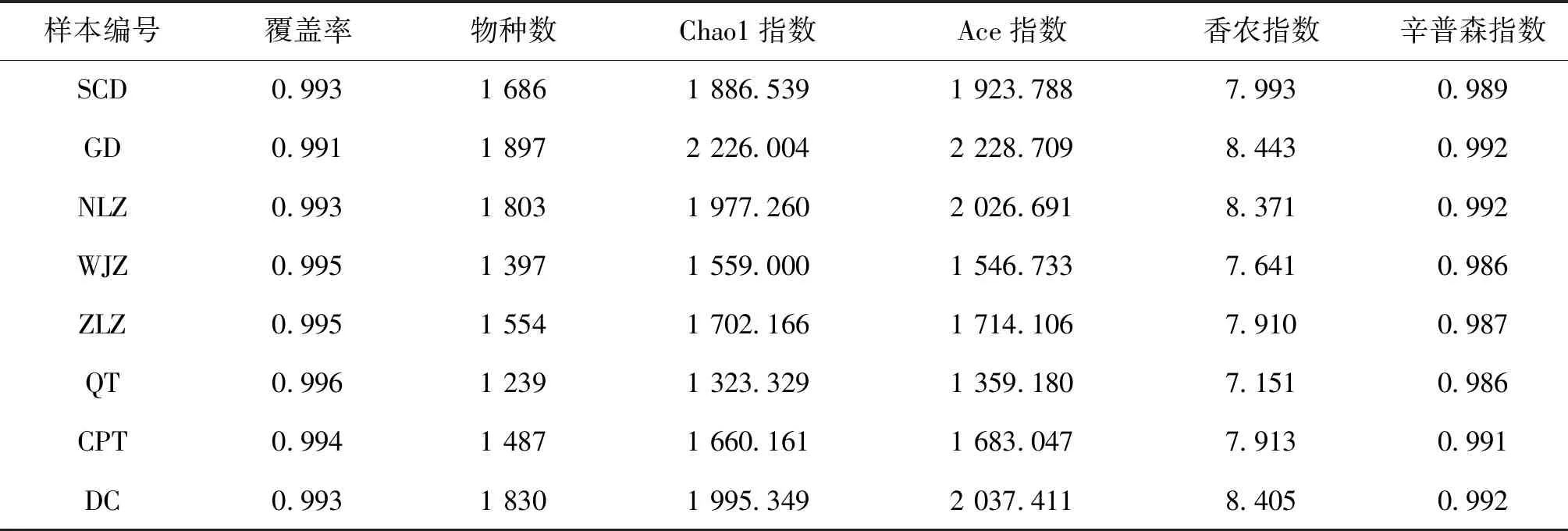
表2 白洋淀水域细菌群落的α-多样性指数Tab.2 Microbial α-diversity index of samples in each station of the Baiyangdian lake
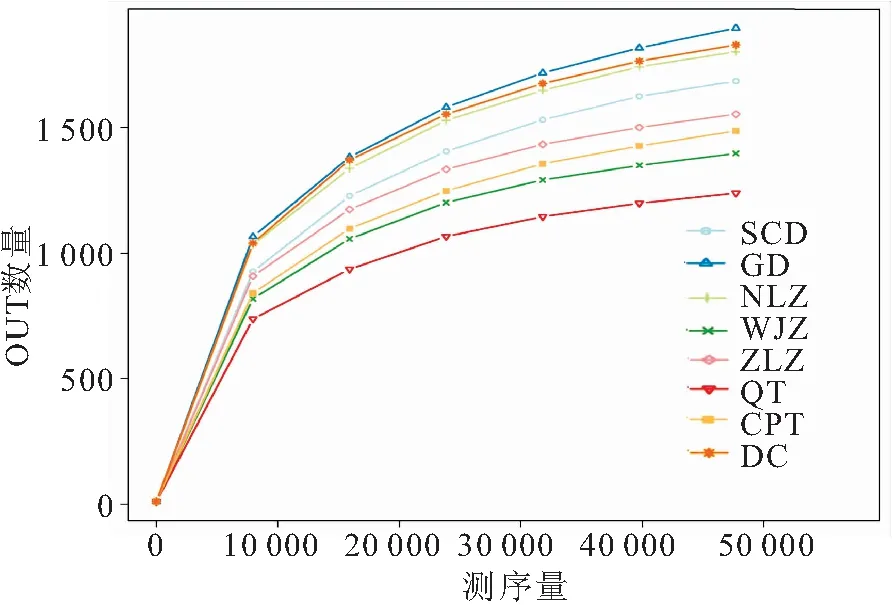
图2 稀释曲线Fig.2 Rarefaction curves of OTU number
2.3 细菌群落结构特征
如图3所示,白洋淀细菌序列主要分布于10个菌门中,其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)之和在各个样品中可达90%以上。各采样点中变形菌门(Proteobacteria)均为第一优势门类,占全细菌群落的44.15%~60.18%。QT地区厚壁菌门(Firmicutes)为第二优势菌,丰度为23.34%,但在其他采样点,该菌含量均较低。庞微菌门(Verrucomicrobia)相对于各采样点之间,在SCD和CPT地区含量较高,丰度分别为5.45%和5.67%。其他被检测到的主要优势菌门还有绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)和硝化螺旋菌门(Nitrospirae)。
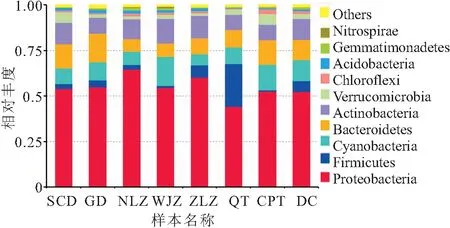
图3 门水平物种群落组成Fig.3 Community composition of phylum level
在属水平上,白洋淀各采样点检测到的细菌主要属于变形菌门,且丰度差异较大(表3)。除QT地区外,其余采样点基本以unidentified_Cyanobacteria、多核杆属(Polynucleobacter)和Limnohabitans为主要优势菌属,其中WJZ地区三者丰度之和最大,为22.17%,GD地区三者丰度之和最小,为11.53%。而QT地区以奈瑟菌属(Neisseria)和嗜血杆菌属(Haemophilus)为主要优势菌属,丰度之和达9.65%。ZLZ地区链球菌属(Streptococcus)含量最高,丰度为5.46%,GD地区地杆菌属(Geobacter)含量相比其他地区较高,丰度为4.80%。其他检测到的菌属主要还有Vogesella,噬氢胞菌属(Hydrogenophaga)和产乙醇杆菌属(Ethanoligenens)。较为特殊的是在SCD地区和CPT地区均未检出嗜血杆菌属(Haemophilus),且CPT地区还未检出链球菌属(Streptococcus)。
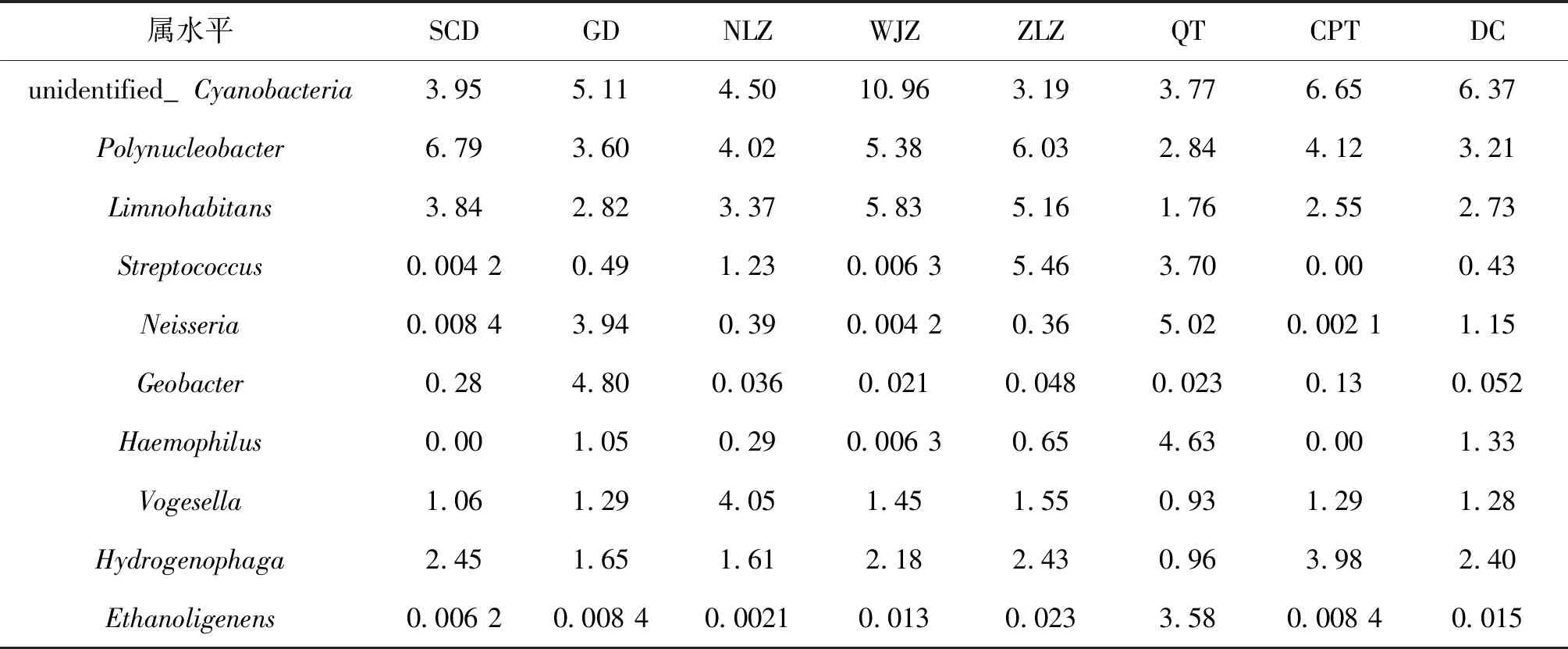
表3 属水平上物种群落组成/%Tab.3 Community composition of genus level/%
2.4 环境因子分析
通过R软件(Version 2.15.3)进行CCA分析,在门水平上构建了白洋淀细菌群落与环境变量之间的关系。如图4所示,第一主轴与第二主轴对细菌群落相对丰度方差的解释占比分别为73.42%和17.96%,两者共解释91.38%的方差变化,表明细菌群落和环境变量之间关系可靠。DO和pH对细菌群落结构分布影响较大,DO与第一、第二排序轴的相关性分别为-0.3716、0.9284,蓝细菌门、拟杆菌门和庞微菌门受其影响较大,存在负相关性。pH与第一、第二排序轴的相关性分别为-0.6527和-0.7576。pH和与变形菌门呈显著性负相关,与庞微菌门呈现正相关性。
3 讨论
3.1 水质分析
白洋淀湖泊水体溶氧整体较高,说明水体自净能力较好[11]。在对白洋淀水质进行分析后发现,该水域整体呈碱性,QT、CPT、DC相比其他采样点水质更偏碱性,且TN和TP含量也相对较高, 更适宜藻类繁殖[12-14],导致水体SD较低。夏季是渔业网箱养殖的旺季,大量鱼蟹饵料的投入会引起有机耗氧量的增加导致COD的升高[15],QT、CPT和DC水产养殖业较发达,因而COD含量更高。
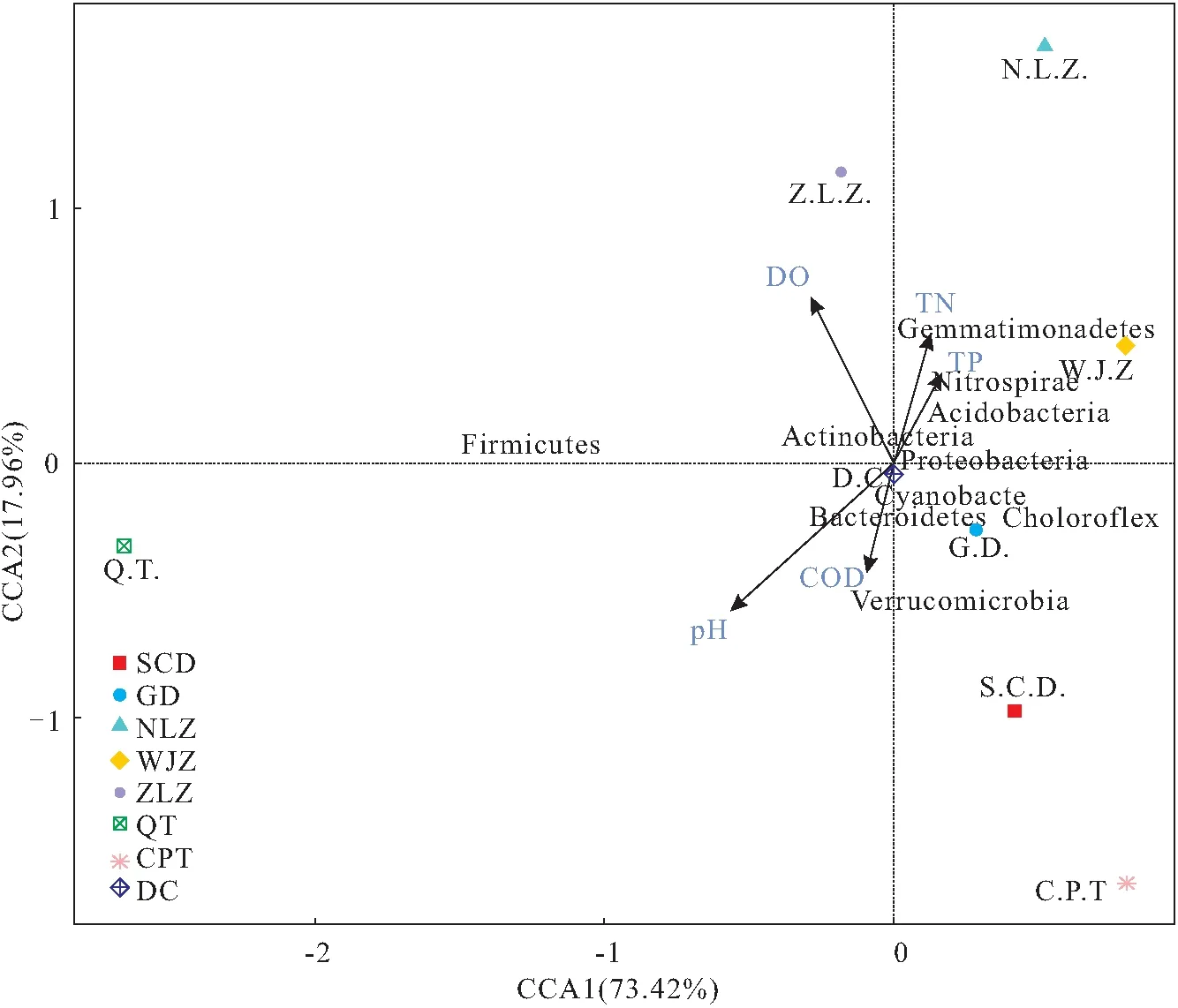
图4 白洋淀细菌与环境因子CCA分析Fig.4 CCA of bacterial and environmental factors in Baiyangidna lake
SCD由于位于最北部,水面开阔,水生植物较多,能快速吸收氮磷等营养物,分解有机污染物[16],水体TN和TP含量较低,SD较高,水质较好。
3.2 细菌群落结构分析
α-多样性指数是反映微生物多样性的综合性指标,丰富度指数和多样性指数尤为重要。与鄱阳湖和北海湖细菌多样性相比[17,18],白洋淀Ace指数、Chao1指数和shannon指数均较高,表明白洋淀水域细菌丰富度和多样性较好。
通过高通量测序,对白洋淀水域细菌群落结构分布特征进行了研究,发现该地区不同水域细菌群落组成结构相似,优势菌门主要有变形菌门、厚壁菌门、蓝细菌门、拟杆菌门和放线菌门,这些都属于典型的淡水细菌门类,其他研究水体细菌群落结构的文献结果相似,但在属水平上,不同地区差异较大[19-21]。
变形菌门是水环境中普遍存在的一种原核生物,有研究指出在湿地、污染河流和深海沉积物等环境中以第一优势门存在[22-24],在本研究中同样表现为相对丰度最高的优势菌门。在属水平上,Limnohabitans作为主要的优势菌属,TP和TN有利于其生长繁殖[18],间接反映出水体TP、TN含量较高。本试验结果还显示蓝细菌的相对丰度较高,是由于其嗜高温的特性使其在夏季大量繁殖[25,26]。除此之外蓝细菌在水体自净中也可起到积极作用,能够吸收水体中氮、磷等无机物,可作为水体富营养化的指示生物,因此一定程度上也可表明白洋淀水体中氮、磷等含量较高。除此之外检测出的厚壁菌门和庞微菌门也均是富营养化水体中常见的细菌[27,28]。白洋淀水中还检测到存在于人和动物体内的一些致病菌,例如拟杆菌门以及进一步检测到的链球菌属、奈瑟菌属和嗜血杆菌属[29,30],且所占比例均相对较高,说明该区域受人为活动的影响较大。
4 结论
本研究通过对白洋淀水域的细菌宏基因组16S rDNA测序及OTUs分子生物信息分析表明,不同采样点水体中细菌均具有较高的丰富度和多样性,稳定性较好,且以光淀(GD)地区多样性最为丰富。在门分类水平上,变形菌门、厚壁菌门 、蓝细菌门、放线菌门和拟杆菌门为白洋淀水域主要优势菌门,平均丰度之和能达到90%,变形菌门为第一优势门类;属水平上以unidentified_Cyanobacteria、多核杆属和Limnohabitans为主要优势菌属。CCA分析结果显示DO和pH是影响白洋淀细菌群落分布的主要环境因子。

