基于指纹图谱结合多模式化学计量学方法评价补骨脂药材质量
王玉勤,范国荣, 2*
基于指纹图谱结合多模式化学计量学方法评价补骨脂药材质量
王玉勤1,范国荣1, 2*
1. 上海交通大学药学院,上海 200240 2. 上海交通大学附属第一人民医院临床药学科,上海 200080
采用指纹图谱并结合多种化学计量方法,筛选特征化学成分,区分不同来源的药材,综合评价中药的质量。采用HPLC法建立补骨脂药材指纹图谱,相似性分析(similarity analysis,SA)、聚类分析(hierarchical cluster analysis,HCA)、主成分分析(principal component analysis,PCA)化学计量方法进行分析。色谱柱为Waters X Select HSS T3 xp(150 mm×2.1 mm,2.5 μm),流动相为乙腈(A)-水(B),梯度洗脱,0~10 min,5%~10% A;10~15 min,10%~35%A;15~25 min,35%~60%A;25~35 min,60%~85%A;35~50 min,85%~95%A;体积流量0.3 mL/min,检测波长为246 nm,柱温为30 ℃,进样量为1 μL。以补骨脂素为参照,绘制11批样品的HPLC图谱,采用《中药色谱指纹图谱相似度评价软件(2012年版)》进行相似性评价分析,确定共有峰,并采用SIMCA 13.0、SPSS 22.0软件进行HCA和PCA。11批补骨脂样品的HPLC图谱有12个共有峰,根据相似度均在是否大于0.95,可将11批次药材分为2类;采用HCA的2种计算方法,分类结果基本一致,说明样品的一致性良好;3个主成分因子的累积方差贡献率为94.524%,以S8样品的主成分因子综合得分最高、整体质量最好。所建HPLC指纹图谱的相似度分析及聚类分析和主成分分析方法结果可为补骨脂药材的质量控制提供参考。
补骨脂;高效液相色谱法;相似度分析;聚类分析;主成分分析
补骨脂为豆科植物补骨脂L. 的干燥成熟果实。具有温肾助阳、纳气平喘、温脾止泻的功效[1]。化学研究表明补骨脂中的主要成分为香豆素类和黄酮类以及酚类化合物[2]。补骨脂素、异补骨脂素、补骨脂异黄酮、补骨脂乙素、补骨脂酚为补骨脂的主要有效成分,其中补骨脂素和异补骨脂素具有具有抗肿瘤、抗白血病、促骨形成(拟雌激素)、缓解抑郁症等药理作用,是评价补骨脂药材质量的主要指标,因此对补骨脂及其制剂的含量测定多以补骨脂素和异补骨脂素这2种成分为质量控制指标[3]。其含量测定方法有薄层扫描法、气相色谱法、高效液相色谱法,但仅采用单一药味的显微及薄层色谱鉴别以及补骨脂素一种成分的含量测定来控制产品的质量,无法全面反映产品的质量。鉴于此,笔者通过检测11批补骨脂样品,建立其高效液相色谱(HPLC)指纹图谱[4],并结合相似度分析、聚类分析、主成分分析对其质量进行全面评价,旨在为补骨脂药材的质量控制提供参考。
1 材料与仪器
1.1 材料
11批补骨脂药材购于云南、河南、江苏等地,经范国荣教授鉴定为豆科植物补骨脂L.的干燥成熟果实,具体信息见表1。补骨脂素(批号1018444-F2290010,质量分数大于98%)、异补骨脂素(批号1017007-HO150006,质量分数大于98%)购自上海安谱实验科技有限公司;补骨脂异黄酮(批号112021-201601,质量分数大于98%);补骨脂乙素(批号MB7009,质量分数大于98%);补骨脂酚(批号MB6546,质量分数大于95%);甲醇、乙腈(色谱纯,Merck(Darmstadt公司,德国),其他试剂均为分析纯,超纯化水(Milli-Q系统)。

表1 样品信息
1.2 仪器
Thermo U-3000超高效液相色谱仪,配备自动进样器、DAD检测器、变色龙7.0工作站(美国Thermo Fishe Scientific公司);旋转蒸发仪(上海信科科技有限公司);DionexTMASETM350加速溶剂萃取仪(美国Thermo Fishe Scientific公司);Millipore(Bedford公司,MA,美国);Eppendorf 5804R型高速冷冻离心机(Eppendorf公司,德国);Scientific Industries Vortex-Genic 2型涡旋混合器(Scientific Industries公司,美国);SK5200H超声仪(上海科导超声仪器有限公司);Sartorius CPA 225D十万分之一电子天平(赛多利斯公司,德国);梅特勒托利多AL104-01万分之一电子天平(梅特勒托利多公司,德国);DJ-O4B型中药粉粹机(上海淀久中药机械有限公司公司)。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液的制备 分别精密称取补骨脂素10.02 mg、异补骨脂素10.01 mg、补骨脂异黄酮17.50 mg、补骨脂乙素5.20 mg、补骨脂酚6.05 mg对照品适量,分别置于25 mL量瓶中,加甲醇制得质量浓度分别为400.8、400.4、700.0、208.0、242.0 μg/mL的对照品溶液。
2.1.2 供试品溶液的制备 将11批次干燥补骨脂药材分别放入粉碎机中粉碎1 min,过2号筛、40目的粗筛,称取补骨脂粗粉约1.000 g,与硅藻1∶1,充分混匀后,置于样品池中进行ASE萃取,收集萃取液,减压回收溶剂,加入适量甲醇溶解,定容至25 mL量瓶中,精密吸取1 mL加50%甲醇定容至10 mL量瓶中,取1 mL供试品溶液,13 000 r/min 离心10 min,重复离心2次,上清液作为供试品溶液进HPLC分析。
2.2 色谱条件
色谱柱为Waters X Select HSS T3 xp(150 mm×2.1 mm,2.5 μm),流动相为乙腈(A)-水(B),洗脱梯度:0~10 min,5%~10% A;10~15 min,10%~35%A;15~25 min,35%~60%A;25~35 min,60%~85%A;35~50 min,85%~95%A,体积流量0.3 mL/min,检测波长为246 nm,柱温为30 ℃,进样量为1 μL。混合对照品和样品色谱图见图1。

1-补骨脂素 2-异补骨脂素 6-补骨脂异黄酮 9-补骨脂乙素 12-补骨脂酚
2.3 方法学考察
2.3.1 线性关系考察 分别精密移取“2.1.1”项对照品母液适量,用50%甲醇逐级稀释成补骨脂素质量浓度分别为269.123、134.562、67.281、33.640、16.820、8.410、4.205 μmol/L;异补骨脂素质量浓度分别为268.850、134.425、67.212、33.606、16.803、8.401、4.200 μmol/L;补骨脂异黄酮质量浓度分别为182.073、91.036、45.518、22.759、11.380、5.690、2.845 μmol/L;补骨脂乙素质量浓度分别为160.311、80.155、40.078、20.039、10.019、5.010、2.505 μmol/L;补骨脂酚质量浓度分别为235.978、117.989、58.994、29.497、14.749、7.374、3.687 μmol/L;进样10 μL测定。以对照品质量浓度()对峰面积()进行线性回归,补骨脂素的线性回归方程=0.493 9+0.068 7,2=0.999 9;异补骨脂素的线性回归方程:=0.517 1+0.111 9,2=0.999 9;补骨脂异黄酮的线性回归方程=0.181 5+0.022,2=0.999 9;补骨脂乙素的线性回归方程=0.058 6-0.006 4,2=1.000 0;补骨脂酚的线性回归方程:=0.038 7-0.004 9,2=1.000 0;结果表明,5个化合物在各自的浓度范围内线性关系良好,且2均在0.999 9以上。
2.3.2 精密度试验 将补骨脂供试品溶液(批号180101)连续进样6次,记录各主要峰的峰面积,5个特征峰相对峰面积RSD值分别为0.552%、0.570%、0.735%、0.916%、0.486%。
2.3.3 稳定性试验 取同一补骨脂试品溶液(批号180101),分别于室温下放置0、2、4、8、12、24 h进样分析,记录各主要峰的峰面积。结果,5个特征峰相对峰面积RSD值分别为1.000%、0.885%、3.566%、1.519%、1.154%。
2.3.4 重复性试验 取同一批补骨脂样品(批号1801011),按“2.1.2”项下方法平行制备6份,进样分析,记录各主要峰的峰面积。结果表明,5个特征峰相对峰面积RSD值为0.925%、1.035%、3.558%、1.270%、0.992%。
2.3.5 加样回收率试验 精密称取6份已测定的补骨脂药材(批号1801011)粉末适量,分别加入等量的的5种对照品,按照“2.1.2”项下供试品溶液的制备方法制备供试品溶液,依法测定并计算加样回收率,补骨脂素、异补骨脂素、补骨脂异黄酮、补骨脂乙素、补骨脂酚的平均回收率为92.32%、91.80%、102.99%、104.26%、107.79%,RSD%分别为3.99%、1.98%、1.38%、1.09%、1.03%。
2.4 补骨脂药材中特征性成分的定量测定
分别取不同来源的11批补骨脂药材精密称定,根据“2.2”项色谱条件,测定补骨脂素、异补骨脂素、补骨脂异黄酮、补骨脂乙素、补骨脂酚的含量见表2。
2.5 指纹图谱的建立
2.5.1 精密度试验 取补骨脂药材(S1)供试品溶液,按“2.2”项下确定的色谱条件下连续进样6次,检测指纹图谱,以补骨脂酚色谱峰为参照峰(S),计算各共有指纹峰与S峰的相对保留时间和相对峰面积RSD值均小于3.0%,表明仪器精密度良好。
2.5.2 重复性试验 取同一批次的补骨脂药材粉末(S1)共计6份,按“2.1.2”项下确定的供试品溶液制备方法制备6份供试品溶液,分别进样测定,检测指纹图谱,以补骨脂酚色谱峰为参照峰(S),计算各共有指纹峰与S峰的相对保留时间和相对峰面积RSD值均小于3.0%,表明该方法重复性良好。
2.5.3 稳定性试验 取补骨脂药材(S1)供试品溶液,分别在0、2、4、6、8、12、24 h进样分析,检测指纹图谱,以补骨脂酚色谱峰为参照峰(S),计算各共有指纹峰与S峰的相对保留时间和相对峰面积RSD值均小于3.0%,说明供试品溶液在24 h内稳定性良好。
2.5.4 指纹图谱的建立及相似度评价 取11批补骨脂样品(S1~S11),按照“2.1.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,将得到的色谱图导入《中药色谱指纹图谱相似度评价系统(2012年版)》,以S1为参考图谱,时间窗宽度设为0.1 min,手动匹配11批指纹图谱(采用多点校正),建立补骨脂HPLC指纹图谱的共有模式(平均值法)[5-6]。根据匹配结果确定12个共有峰,并生成对照指纹图谱,计算出各批次样品的指纹图谱相似度。在所有共有峰中,12号峰对照品易得,并且该成分色谱峰面积最大,分离度及对称性均良好,确定为参照峰(S)。相似度测定结果分别见表3。S1~S11指纹图谱叠加图谱和对照指纹图谱见图2、3。

表2 不同产地补骨脂中药材中5种主要成分的含量

图2 11批样品的HPLC叠加指纹图谱

1-补骨脂素 2-异补骨脂素 6-补骨脂异黄酮 9-补骨脂乙素 12-补骨脂酚
2.5.5 指纹图谱中共有峰指认 通过与对照品图谱(图3)比对可以指认其中的5个色谱峰,可作为特征峰,分别是补骨脂素(1号峰)、异补骨脂素(2号峰)、补骨脂异黄酮(6号峰)、补骨脂乙素(9号峰)、补骨脂酚(12号峰)。
2.6 相似度分析
相似性分析(similarity analysis,SA)[7-8],精确计算原始数据的相关系数,对样本的相似性和差异性进行分类,并对原始数据进行识别,用相关系数评价它们的相似度见表3,一般来说,相似度越接近于1,2种色谱图越接近,基于11批次补骨脂相似度分析的结果,将相似性系数大于0.95的分为1组,其余的分为另1组;即S1、S4、S5、S7、S11为1类;S2、S3、S6、S8、S9、S10为1类。
2.7 聚类分析
聚类分析(hierarchical cluster analysis,HCA)是一组将研究对象分为相对同质的群组(clusters)的统计分析技术,也称分类分析(classification analysis)或数值分类,实质是在多维空间中将样本看作不同的点,用不同的测量方法计算样本点之间的距离,并建立分类基[9-10]。
以11批样品的12个共有峰的相对峰面积为原始数据,采用SPSS 22.0软件,以Ward最小方差法以及组间平均连接的系统聚类法结合欧氏距离()为测度进行分析,结果见图4。由图4可知,用Ward最小方差法,=25时,11批样品可聚为1类;=5时,后一类又可聚为4类,即S2、S5、S6、S7聚为1类,S3、S9聚为1类,S1、S4、S10聚为1类,S11为1类;用系统聚类法,=25时,11批样品可聚为1类;=5时,后1类又可聚为2类,即S5、S7、S2、S6聚为一类,S3、S9聚为1类。
2.8 主成分分析 (principal component analysis,PCA)
PCA作为一种数据简约技术,即无监督数据降维。通过建模方法将多维数据标准化,消除变量之间在数量级上的差异,计算标准化数据的相关矩阵并计算相关矩阵的特征向量、特征值和累积贡献率,确定主成分的个数,计算每个样品的综合函数得分,以该得分进行排序评价,并能提供一个可视化的分布视图[11-12]。
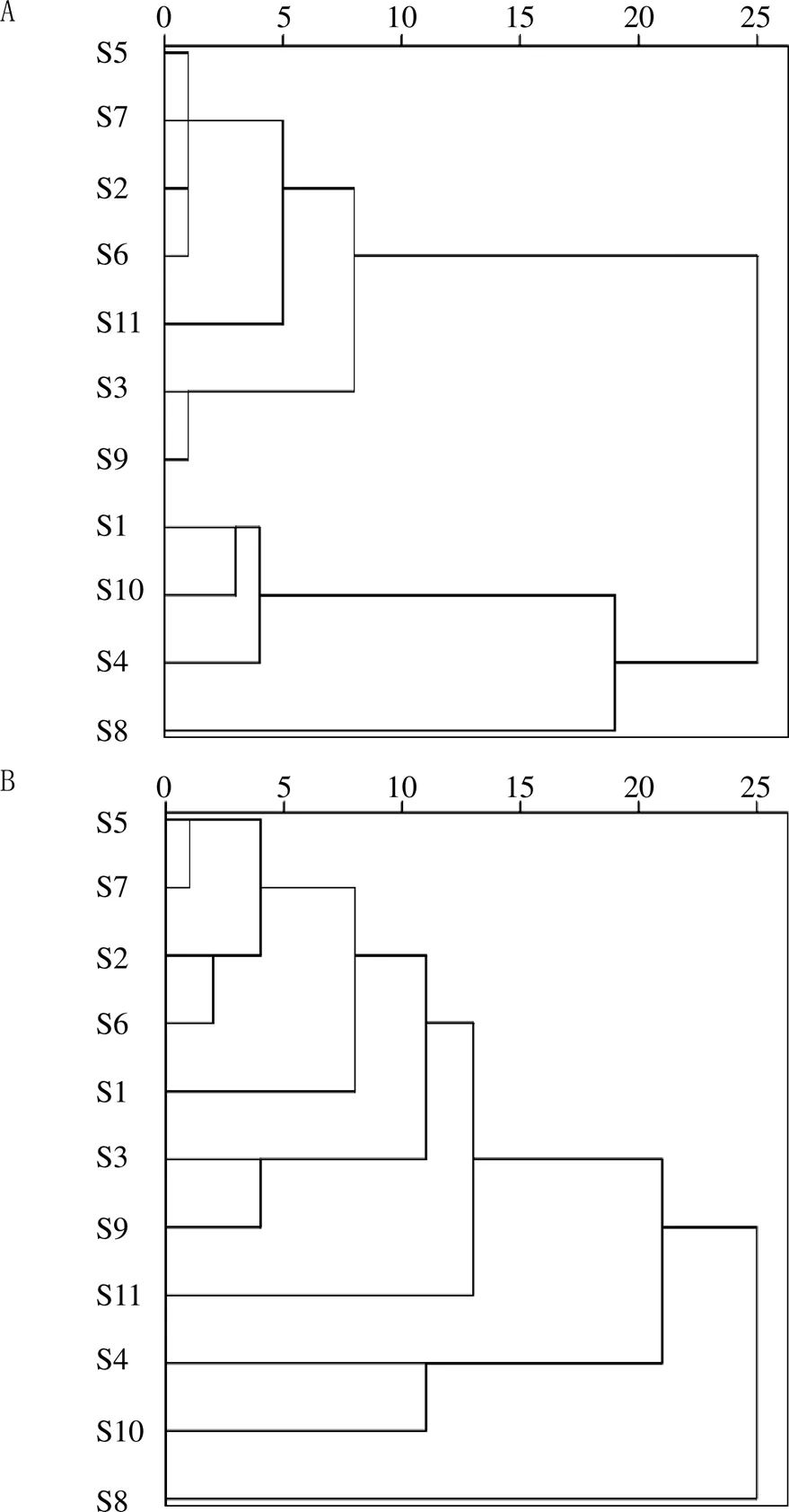
A-Ward最小方差法计算平方欧氏距离 B-欧几里得法计算平方欧氏距离
以各共有峰的相对峰面积为指标,将11批补骨脂12个共有峰的相对峰面积进行标准化处理,采用SPSS 22.0软件和SIMCA 13.0软件进行PCA,得到12种共有成分在11批次补骨脂样品中的得分图和装载图,见图5,表明不同产地的补骨脂药材的化学成分指纹图谱有明显的差别。在载荷图中选取距离原点较远的几个点,得到主成分1中变量的权重值,权重值越大表明该成分在决定样品区分中的作用越大,其中前4名变量的权重值分别为0.58、0.90、0.14和0.11,它们的保留时间分别为21.81、22.19、27.82和30.22 min,分别为指纹图谱中的1、2、6和9号色谱峰。
用SPSS 22.0软件计算其特征值和方差贡献率,以特征值>1为标准,得到前3个因子的特征值分别为7.001、3155、1.186,是影响补骨脂质量评价的主要因子[13]。结合表4,前3个主成分因子的累积方差贡献率为94.524%。选择提取该3个主成分因子对11批补骨脂样品进行评分,以方差贡献率为分配系数,线性组合3个主成分因子,计算各批样品的主成分因子得分及综合得分,并对综合得分进行排序[14],结果见表5,综合得分由高到低的批次依次为S8、S3、S9、S7、S2、S5、S10、S1、S11、S4。
3 讨论
中药指纹图谱是一种多指标质量控制模式,可通过表征中药复杂成分及其内在质量的关系来较全面地反映所含化学成分的种类和数量,从而反映药品的质量,在中药制剂的质量评价中应用广泛[15]。本研究通过查阅文献资料[16-17]在制备测定补骨脂HPLC供试品溶液时,考察了提取工艺以及色谱柱、流动相、波长、温度等因素的选择,确定最佳提取条件和色谱条件。
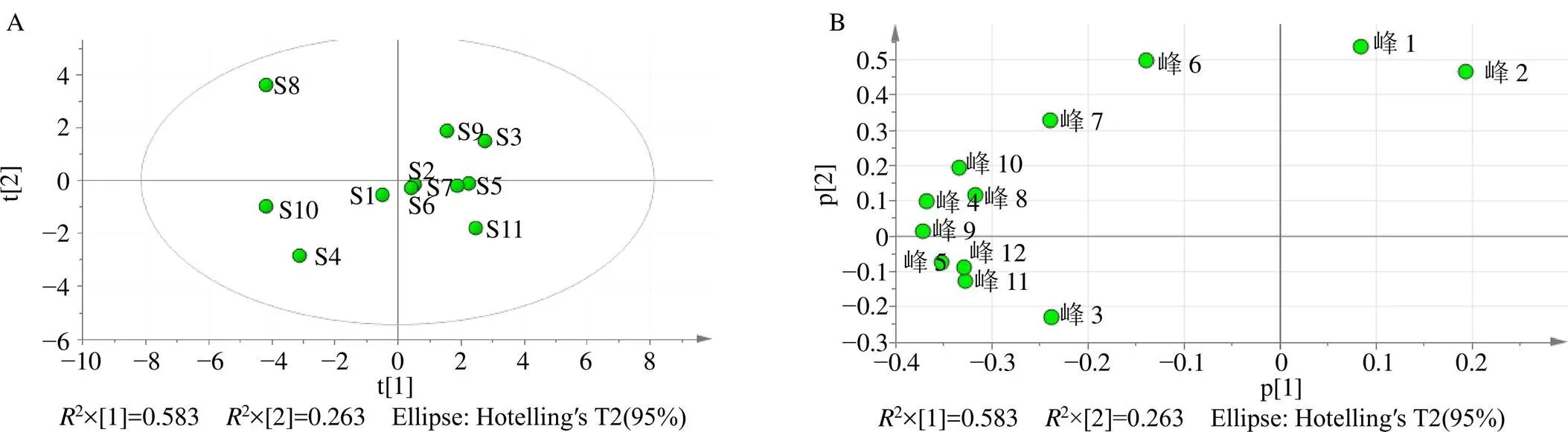
图5 11批次样品的主成分分析PCA评分图(A) 和12种共有成分的PCA装载图(B)

表4 3个主成分因子的特征值和方差贡献率

表5 11批补骨脂样品主成分因子得分及排序
本实验所建立的补骨脂HPLC指纹图谱,可反映补骨脂的整体性和特异性信息,在12个共有峰中,通过与对照品HPLC图谱比对指认出5个成分。SA选择成分的平均值进行分析,精确计算原始数据的相关系数,对样本的相似性和差异性进行分类,将样品的共有峰作为特征性成分进行定量的计算标记;HCA和PCA则是选择样品中的相似对象进行分类分析,通过对象倾向找出潜在的聚类,将整个色谱图转化为统计结构,将不同来源的样品分成不同的簇和类别。本研究具备了定性、鉴别和定量测定的双重作用,提高了中药材的内在质量控制水平,为不同化学计量方法与质量评价的比较提供了一种新的综合策略,对中药材的质量控制提供了准确性和可靠性的有价值的参考依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2015: 187.
[2] 周晓英, 黄晓婧, 周世玉, 等. 《中国药典》补骨脂项下含量测定方法的探讨 [J]. 中国药品标准, 2015, 16(1): 3-4.
[3] 赵婷, 朱汀滢, 吴斌. 补骨脂中补骨脂素和异补骨脂素测定 [J]. 中成药, 2015, 37(5): 1036-1040.
[4] Zhang Y M, Chen Z Y, Xu X K,. Rapid separation and simultaneous quantitative determination of 13 constituents inby a single marker using high-performance liquid chromatography with diode array detection [J]., 2017, 40(21): 4191-4202.
[5] 沈晓宇, 刘雪松, 毕宇安, 等. 盐补骨脂标准汤剂质量评价体系的建立 [J]. 中草药, 2018, 49(1): 100-108.
[6] 伍红年, 谭诗涵, 王元清, 等. 白三七及近源种药材指纹图谱与识别模式的构建及其应用研究 [J]. 中草药, 2019, 50(1): 217-224.
[7] 龙立梅, 宋沙沙, 曹学丽. 基于香气成分气相色谱-质谱指纹图谱的判别分析和相似度评价用于绿茶等级差异研究 [J]. 色谱, 2019, 37(3): 325-330.
[8] Yang G, Zhao X, Fan G. A modification on the vector cosine algorithm of similarity analysis for improved discriminative capacity and its application to the quality control of[J]., 2017, 1518: 34-45.
[9] Hans-Friedrich Köhn, Lawrence J H. Hierarchical cluster Analysis [M]. Wiley StatsRef: Statistics Reference Online, 2015: 236.
[10] 林林, 于凤蕊, 徐丽华, 等. 女金丸HPLC指纹图谱建立及聚类分析和主成分分析 [J]. 中国药房, 2019, 30(10): 1339-1343.
[11] Gao F Y, Xu Z H, Wang W Z,. A comprehensive strategy using chromatographic profiles combined with chemometric methods: Application to quality control ofSieb. et Zucc [J]., 2016, 1466: 67-75.
[12] Granato D, Santos J S, Escher G B,. Use of principal component analysis (PCA) and hierarchical cluster analysis (HCA) for multivariate association between bioactive compounds and functional properties in foods: A critical perspective [J]., 2018, 72: 83-90.
[13] 蔡晓洋, 张思荻, 曾俊, 等. 基于主成分分析和聚类分析的栀子种质资源评价 [J]. 中国实验方剂学杂志, 2017, 23(14): 30-37.
[14] 王洪兰, 姚卫峰, 朱丹妮, 等. 不同来源瓜子金药材的HPLC-DAD-ELSD指纹图谱和主成分分析 [J]. 中国天然药物, 2010, 8(5): 343-348.
[15] 刁嘉茵, 徐灿, 王淑美, 等. 中药指纹图谱与药效相关性研究进展 [J]. 药学研究, 2018, 37(3): 165-168.
[16] 李凯, 鲁亚奇, 周宁. 补骨脂中补骨脂素和异补骨脂素提取工艺研究 [J]. 中医学报, 2018, 33(9): 1716-1720.
[17] Zhu L, Wang Z, Zhai X,. Simultaneous quantitative determination of 13 active components in the traditional Chinese medicinal preparation Suanzaoren oral liquid by HPLC coupled with diode array detection and evaporative light scattering detection [J]., 2017, 40(11): 2320-2325.
Quality evaluation ofby using chromatographic profiles combined with chemometric methods
WANG Yu-qin1, FAN Guo-rong1, 2
1. School of Pharmacy, Shanghai Jiao Tong University, Shanghai 200240, China 2. Department of Clinical Pharmacy, Shanghai General Hospital, Shanghai Jiao Tong University, Shanghai 200080, China
To distinguish the medicinal materials from different sources and evaluate the quality of Chinese herbal medicines by using chromatographic profiles combined with chemometric methods.HPLC, similarity analysis (SA), cluster analysis (HCA) and principal component analysis (PCA) were used to analyze the original data. The chromatographic column was Waters X Select HSS T3 xp (150 mm×2.1 mm, 2.5 μm), the mobile phase was acetonitrile-water (gradient elution), the flow rate was 0.3 mL/min, the detection wavelength was 246 nm, the column temperature was 30 ℃, and the injection volume was 1 μL. HPLC profiles of 11 batches of samples were drawn using psoralen as the reference. Similarity evaluation software of Chinese traditional medicine chromatographic fingerprint (2012 edition) was used for similarity evaluation and analysis to determine the common peaks, and hierarchical cluster analysis and principal component analysis were conducted by SIMCA 13.0 and SPSS 22.0 software.There were 12 common peaks in the fingerprint of 11 batches of. samples. According to whether the similarity index was > 0.95 or not, 11 batches of medicinal materials could be divided into two categories. Two methods of hierarchical cluster analysis were adopted, and the classification results were basically consistent, indicating the good consistency of samples. The cumulative variance contribution rate of the three principal component factors was 94.524%, and the S8 sample had the highest comprehensive score of principal component factors and the best overall quality.The results of similarity analysis, cluster analysis and principal component analysis of HPLC fingerprint can provide reference for quality control ofsamples.
L.; high performance liquid chromatography; similarity analysis; hierarchical cluster analysis; principal component analysis
R286.2
A
0253 - 2670(2021)04 - 1143 - 07
10.7501/j.issn.0253-2670.2021.04.028
2020-06-03
上海市卫生和计划生育委员会中医药科研专项(2016ZJP003)
王玉勤(1995—),女,汉族,山东菏泽人,硕士研究生。Tel: 15201973182 E-mail: 18865737427@163.com
范国荣(1965—),男,汉族,浙江慈溪人,教授,博士研究生导师,主要从事临床药学和临床药代动力学研究。Tel: 13301777863 E-mail: guorfan@163.com
[责任编辑 时圣明]

