盐质量分数对鱼头汤熬煮过程中微纳米颗粒形成的影响
翟争妍,樊馨怡,陶宁萍,2,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306)
作为一种大型远洋性鱼类,金枪鱼以其非常高的营养价值享誉全球水产品市场。经济价值高的金枪鱼有6 种,分别是蓝鳍金枪鱼、大眼金枪鱼、黄鳍金枪鱼、长鳍金枪鱼、北方黑鲔和鲣鱼,其中属瘦肉型的大眼金枪鱼因肉质鲜嫩、生食味美且捕捞量较高,是目前市场上制作生鱼片的主要原料[1-2]。但是在金枪鱼加工过程中会产生鱼内脏、鱼头、鱼皮、鱼骨等大约70%的副产物[3],作为主要副产物之一的金枪鱼头富含二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)、蛋白质以及多种生物活性物质[4-5]。目前,对于金枪鱼头的利用主要集中在生产蛋白质酶解产物以及提取粗鱼油。杨萍等[6]研究了大眼金枪鱼蛋白酶解产物经过超滤所得1 ku组分的抗氧化能力,1 ku的组分在进行体外实验时表现出一定的还原能力,在进行体内实验时能够显著提高衰老小鼠的抗氧化能力。Tao Ningping等[7]采用超临界CO2萃取法提取黄鳍金枪鱼眼窝肉中的鱼油,结果表明,提取的DHA占总脂肪酸的27.1%。刘书成等[8]采用酶解法从金枪鱼头中提取鱼油,经过理化分析得知,提取的鱼油中包含23.63%的DHA和4.84%的EPA。通过中国传统烹调方式将金枪鱼头熬煮成鱼头汤,既能够保证鱼头中营养成分的充分利用,又能够丰富汤类产品的市场,提高鱼头的食用价值和经济价值;因此,本实验以金枪鱼头为材料,通过熬煮对该副产物进行利用研究。
食盐(NaCl)作为食品加工生产过程中最常使用的添加剂之一,在肉类、乳制品、烘焙食品和汤的加工、保藏以及感官可接受性方面发挥着十分重要作用[9]。除此之外,由于NaCl还可以通过增加蛋白质与脂肪之间的结合能力,起到促进乳化的作用,因此其在食品乳液的形成与稳定过程中扮演着重要的角色。冯美琴等[10]研究不同NaCl浓度对O/W乳液稳定性的影响时发现,随着NaCl浓度的增加,乳液的稳定性呈现先提高后降低的趋势。Inguglia等[11]研究结果表明,在肉制品的加工过程中,NaCl可以通过增强蛋白质和脂肪之间的结合从而促进热稳定性乳液的形成。
食品原料作为一种多相分散系统,通常含有大量的两亲化合物,在其加工过程中会受到各种结合力的影响,并且通过共价和非共价相互作用,分子间会产生大量的自组装胶体颗粒,其尺寸分布范围从微米到纳米,即微纳米颗粒(micro/nano particles,MNPs)[12]。研究表明熬煮1 h后的蛤蜊汤中含有平均粒径为78 nm的MNPs[13]。汤中的MNPs还有一定的营养功效,如猪骨汤中的MNPs具有抗氧化作用[14]。然而,在鱼汤熬煮过程中有关盐对MNPs的形成以及稳定性的影响却鲜有报道。
本实验以金枪鱼头汤为研究对象,探究盐质量分数对金枪鱼头熬煮过程中营养物质迁移规律的影响。同时以平均粒径、聚合物分散性指数(polymer dispersity index,PDI)和Zeta-电位为评价指标,研究加盐质量分数对熬煮过程中MNPs形成的影响。利用光学显微镜和激光共聚焦显微镜研究盐质量分数对金枪鱼头汤中MNPs形态及其组分之间相互作用的影响,为金枪鱼头汤的精深加工提供理论依据,实现金枪鱼副产物的高值化利用。
1 材料与方法
1.1 材料与试剂
大眼金枪鱼头(Thunnus obesus)(同批次30 条,体长(27.09±2.04)cm、体宽(25.69±1.00)cm、体质量(1.52±0.19)kg)购自大连翔祥食品有限公司;食盐、大豆油为市售。
五水硫酸铜、浓硫酸、蒽酮、氢氧化钠、氢氧化钾、三氯乙酸、高氯酸、氯仿、甲醇等均为分析纯;正己烷、三氯甲烷、三氟化硼甲醇均为色谱级;尼罗红上海麦克林生物科技有限公司;3 种核苷酸标准品、十九烷酸、十九烷酸甲酯、37 种脂肪酸甲酯混合标准品上海安谱科学仪器有限公司;CoroNa™ Green、MQAE美国赛默飞世尔科技有限公司;Rhod-PE、尼罗蓝美国Avanti Polar Lipids公司;WGA488染液 美国Biotium公司。
1.2 仪器与设备
C21-WT2112T美的电磁炉 广东美的网络科技有限公司;HWS-24电热恒温水浴锅 上海恒科学仪器有限公司;Tracegcultra气相色谱仪 美国Thermo Fisher公司;L-8800氨基酸自动分析仪 日本日立公司;UV-2200紫外分光光度计 美国Unico公司;RV 10旋转蒸发仪 德国IKA集团;1260液相色谱仪 美国安捷伦科技有限公司;ZEN 3600纳米粒度电位仪 英国马尔文仪器有限公司;MS500W倒置光学显微镜 上海明兹精密仪器有限公司;LSM710 NL0激光共聚焦显微镜德国蔡司股份公司。
1.3 方法
1.3.1 样品制备
参考钱雪丽等[15]的方法熬煮金枪鱼头汤,煮沸开始计时并加盐,经过感官预实验确定盐质量分数使用范围,即0.3%、0.4%、0.5%、0.6%和0.7%。鱼头汤熬煮过程中每隔30 min取一次样,过滤,分装在50 mL小瓶并于-70 ℃进行保藏。
1.3.2 总脂质量浓度的测定
总脂质量浓度的测定参考Folch等[16]的方法并略作修改。向锥形瓶中加入20 mL的鱼头汤和400 mL氯仿/甲醇(2∶1,V/V)溶液,振荡摇匀后于4 ℃的冰箱中放置24 h。然后过滤以除去混合液中的不溶性物质。加入质量分数为0.9%的NaCl溶液并摇匀,静置分层后除去上层的甲醇,重复两次。最后使用旋转蒸发仪除去三氯甲烷得到总脂,称质量并计算得出总脂质量浓度。最后充入氮气,并于-70 ℃保存以用于EPA和DHA含量的测定。
1.3.3 EPA和DHA含量的测定
取0.08~0.10 g总脂于100 mL圆底烧瓶中,参照Zhang Jing等[17]的方法对其进行甲酯化后,采用气相色谱法对EPA和DHA含量进行检测。
1.3.4 水溶性蛋白质量浓度的测定
参考Lowry等[18]的研究,采用Folin-Ciocaileu法测定水溶性蛋白质量浓度。先用超纯水将5 mL的鱼头汤稀释至100 mL,之后再取1 mL稀释至10 mL。取1 mL的样品和5 mL的Folin-Ciocaileu试剂A液混合并于40 ℃加热30 min,然后加入0.4 mL的Folin-Ciocaileu试剂B液混合并再次加热10 min。最后在500 nm波长处测定样品的吸光度并计算水溶性蛋白质量浓度。
1.3.5 游离氨基酸质量浓度的测定
游离氨基酸质量浓度的测定参考Tanimoto等[19]的方法并略作修改。取2.0 mL鱼头汤和15 mL质量分数为5%的三氯乙酸于离心管中并匀浆,将匀浆的样品超声5 min后于4 ℃条件下静置2 h。然后离心(10 000 r/min、4 ℃)10 min,取5 mL上清液置于10 mL烧杯中,然后用6 mol/L的NaOH溶液调节上清液的pH值至2.0,并用超纯水定容至10 mL,过0.22 μm的水相尼龙滤膜后收集到棕色进样瓶中。最后使用氨基酸自动分析仪进行检测分析,其参数条件为:色谱柱规格4.6 mm×150 mm,7 μm;柱温50 ℃;通道1流速0.4 mL/min;通道2流速0.35 mL/min;流动相为pH值分别为3.2、3.3、4.0、4.9的柠檬酸钠和柠檬酸的混合缓冲液以及质量分数4%的茚三酮缓冲液。
1.3.6 低聚肽质量浓度的测定
低聚肽质量浓度的测定参考曾清清[20]的方法并略作修改。首先在离心管中加入2 mL鱼头汤和2 mL质量分数为2%的三氯乙酸,混匀后以4 000 r/min离心10 min。取1.5 mL上清液和1.5 mL质量分数为6%的NaOH溶液于试管中并摇匀,加入0.15 mL的双缩脲试剂并于漩涡振荡器上振荡摇匀。在室温条件下静置15 min后,利用紫外分光光度计在310 nm波长处测其吸光度。以牛血清白蛋白为标准品。
1.3.7 总糖质量浓度的测定
总糖质量浓度参考Fan Xinyi等[21]的方法,采用硫酸-蒽酮法进行测定。将20 mL的鱼头汤倒入50 mL烧瓶中,向烧瓶中加入10 mL盐酸,然后在100 ℃的沸水中加热20 min。将混合物放入冰水中冷却至室温(25 ℃),过滤,然后用蒸馏水定容至100 mL。取10 mL样品溶液稀释10 倍,之后再取1 mL置于试管中,将4 mL蒽酮试剂(1 g蒽酮溶于500 mL体积分数80%的硫酸溶液中)加入试管并充分混合。然后将试管在100 ℃加热10 min,取出并置于冰水中冷却20 min,最后在620 nm波长处测其吸光度。
1.3.8 5’-核苷酸质量浓度的测定
5’-核苷酸质量浓度的测定参考Qiu Weiqiang等[22]的方法并略作修改。取5 mL鱼头汤和10 mL质量分数为10%的高氯酸于离心管中并匀浆2 min。超声处理5 min后,使用冷冻离心机离心(10 000 r/min、4 ℃)15 min并取上清液于25 mL烧杯中。再取5 mL质量分数为5%的高氯酸于离心管中,与离心管中沉淀混匀后离心(10 000 r/min、4 ℃)15 min。合并两次上清液于25 mL烧杯中,使用6 mol/L的氢氧化钾溶液调节pH值至5.8。然后静置30 min,取上清液并用超纯水定容到50 mL。过0.22 μm的水相尼龙滤膜后收集到棕色进样瓶中,之后在高效液相色谱仪中进行分析检查。整个过程全部都在4 ℃下进行。色谱条件:色谱柱:Venusil XBP C18液相色谱柱(3.9 mm×150 mm,5 μm);流动相:A为20 mmol/L磷酸二氢钾和20 mmol/L磷酸氢二钾的混合溶液,并用磷酸调节pH值至5.8;B为甲醇溶液;等度洗脱流速:1 mL/min;柱温:28 ℃;进样量:10 μL;检测波长:254 nm。
1.3.9 MNPs平均粒径、PDI和Zeta-电位的测定
MNPs平均粒径、PDI和Zeta-电位的测定参考冯美琴等[10]的方法并略作修改。将汤用煮沸后的去离子水稀释10 倍,搅拌均匀。使用马尔文纳米粒度分析仪测定金枪鱼头汤中MNPs的平均粒径和PDI,其中MNPs的折射率为1.440 4,分散剂为水,分散折射率为1.330。
1.3.10 光学显微镜观察MNPs的形态变化
参考Qian Xueli等[23]的方法。将金枪鱼头汤过滤,取20 μL样品滴到载玻片上并将盖玻片缓慢覆盖到上面。使用MS500W倒置光学显微镜(×40目镜)观察不同盐质量分数在熬煮150 min后对金枪鱼头汤中MNPs形态特征的影响。
1.3.11 激光共聚焦显微镜观察MNPs中各组分之间的相互作用
首先,将金枪鱼头汤过滤以除去不溶性杂质。染料配制及鱼汤染色过程中均应避光操作以防止荧光染料见光猝灭。配制尼罗红(42 μg/mL,丙酮配制)[24]、MQAE(5 mg/mL,二甲基亚砜配制)[25]、CoroNaTMGreen(500 µg/mL,二甲基亚砜配制)[26]、Rd-DOPE(1 mg/mL,氯仿配制)[27]、尼罗蓝(210 µg/mL,乙醇配制)[28]、WGA488(1 mg/mL,磷酸盐缓冲液配制)[29]染液。然后将100 μL尼罗红、40 μL MQAE以及40 μL CoroNaTMGreen加入至1 mL处理过的鱼汤中,对汤中甘油三酯、Cl-和Na+进行染色;将20 μL Rd-DOPE、10 μL尼罗蓝和10 μL WGA488加入1 mL处理过的鱼汤中,对汤中磷脂、蛋白质和糖基化分子(糖脂和糖蛋白)进行染色。然后在黑暗的条件下静置30 min使汤中物质得到充分染色。然后取10 μL染色后的样品于载玻片上,并用盖玻片覆盖。室温下于黑暗条件下放置20 min待其晾干。最后使用激光共聚焦显微镜进行观察,选择63×1.4油镜用于成像,并使用在488 nm激发的氩激光器(在500~535 nm之间检测到发射波长)、在543 nm激发的He-Ne激光器(在565~615 nm之间检测到发射波长)和在633 nm激发的二极管激光器(采用长通滤波器大于650 nm检测)。
1.4 数据处理与分析
所有实验均重复3 次,结果以平均值±标准偏差表示。采用SPSS 16.0软件根据单因素方差法对数据进行差异显著性比较分析,P<0.05表示数据之间存在显著性差异。采用GraphPad Prism 5和Origin 8.0软件处理和生成图像。
2 结果与分析
2.1 营养物质的迁移规律
在熬煮这一典型的食品加工过程中,营养物质会从金枪鱼头的内部向表层迁移,接着再从表层向汤中迁移[12]。由图1可知,随着熬煮时间的延长,汤中营养物质的溶出量逐渐增加并在熬煮150 min时后达到最大,这与Qian Xueli等[23]的研究结果一致,表明加盐并不会改变熬煮过程中营养物质迁移的总体趋势。分析盐质量分数对营养物质迁移的影响可以看出,随着盐质量分数的增加,汤中营养物质的溶出量总体呈现先增加后减少的趋势,并在0.5%的条件下达到最大。其原因可能是随着盐质量分数从0.3%增加到0.5%,汤熬煮过程的渗透压增大,有利于营养物质的溶出。但当盐质量分数从0.5%增加到0.7%时,较高的盐质量分数会促使汤中营养物质与NaCl发生相互作用,导致营养物质含量减少[30-31]。

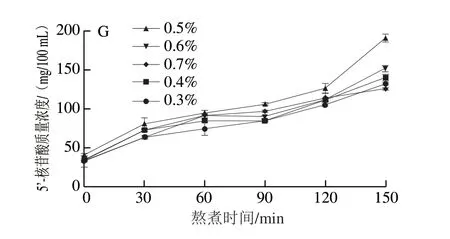
图1 盐质量分数对金枪鱼头汤熬煮过程中营养物质迁移的影响Fig.1 Effect of salt concentration on the migration of nutrients during the cooking of tuna head soup
2.2 营养物质迁移规律的主成分分析结果
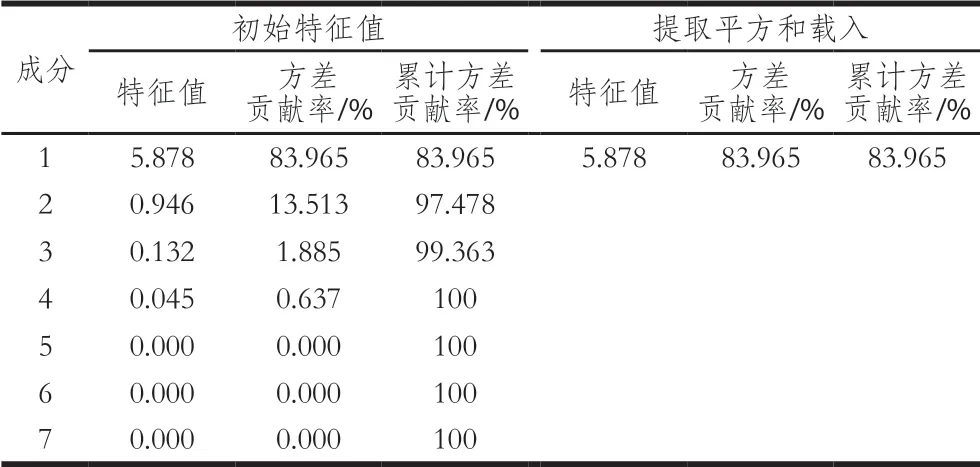
表1 特征值与贡献率Table 1 Eigenvalues and contribution rates
主成分分析是一种数学工具,它可以降低数据的维数,使实验数据中的底层结构和数据与样本之间的关系可视化。对6 种不同盐质量分数鱼头汤的营养物质迁移规律进行主成分分析,得到鱼头汤营养品质的7 个主成分特征值及累计方差贡献率(表1)。由表1可知,第1主成分的特征值为5.878,其累计方差贡献率为83.965%。当累计方差贡献率大于70%时,表明第1主成分已经包含了鱼汤的绝大部分信息,此结果与Qian Xueli等[23]所报道的鱼汤中MNPs主要是以甘油三酯为中心,外层主要包被磷脂双分子层这一结论相一致。因此可以使用缩减的第1主成分来代替原来的7 个营养品质指标用以筛选最适的加盐质量分数。

表2 第1主成分的载荷矩阵Table 2 Loading matrix of first principal component for seven nutrients
采用SPSS 20.0软件对主成分进行分析得到的第1主成分的载荷矩阵(表2),载荷值主要反映各变量与主成分之间的相关系数,其绝对值越大,对第1主成分的影响越大。因此,由表2可知,第1主成分以总糖、水溶性蛋白以及脂质中的EPA和DHA的迁移量对其影响最为重要,其次是5’-核苷酸质量浓度,游离氨基酸质量浓度的影响最小。

表3 不同加盐质量分数条件下鱼头汤的成分得分和综合得分Table 3 Component scores and comprehensive scores of tuna head soup with different salt concentrations
由载荷矩阵可以得出,第1主成分得分与其他营养品质指标之间的线性关系:Z=0.954X1+0.982X2+0.983X3+0.515X4+0.938X5+0.995X6+0.950X7。其中,X1~X7分别表示总脂、EPA和DHA、水溶性蛋白、游离氨基酸、低聚肽、总糖以及5’-核苷酸的水平。以第1主成分所对应的特征值的方差贡献率及其线性关系建立综合评价函数为:F=Z/83.965。计算每个加盐质量分数条件下鱼头汤的综合得分,然后进行排序评价每个鱼头汤的营养品质。由表3可知,综合得分由高到低的排序为0.5%、0.6%、0.7%、0.4%以及0.3%。其中当盐质量分数为0.5%时,金枪鱼头汤的综合得分为6.195 分,说明在该盐质量分数下熬煮的鱼头汤营养品质的综合品质最高。
2.3 不同盐质量分数对MNPs形成的影响
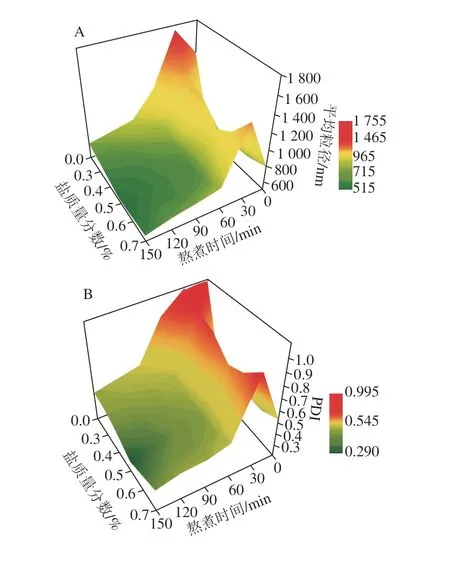

图2 盐质量分数对金枪鱼头汤中MNPs形成的影响Fig.2 Effect of salt concentration on the formation of MNPs during the cooking of tuna head soup
金枪鱼头汤熬煮过程会因为受到各种结合力的影响通过共价或非共价的相互作用而自组装形成大量的MNPs,为了判断其稳定性,一般采用平均粒径、PDI和Zeta-电位对其进行表征。由图2可知,随着熬煮时间的延长,MNPs的平均粒径、PDI和Zeta-电位呈先增大后减小并趋于平稳的趋势,表明汤中MNPs逐渐趋于不易聚集的稳定状态。此外,含NaCl的汤中MNPs平均粒径、PDI和Zeta-电位均小于不加盐的鱼头汤。且随着盐质量分数的逐渐提高,汤中MNPs的平均粒径、PDI和Zeta-电位呈先减小后增大的趋势,这与冯美琴等[10]的研究结果相似。在盐质量分数为0.5%时,MNPs的平均粒径、PDI和Zeta-电位达到最小,意味着其重力减小且布朗运动可能完全克服重力带来的影响,从而使得在汤放置的过程中MNPs不易发生聚集沉降,有利于营养物质的保留。
2.4 不同盐质量分数对MNPs形貌的影响
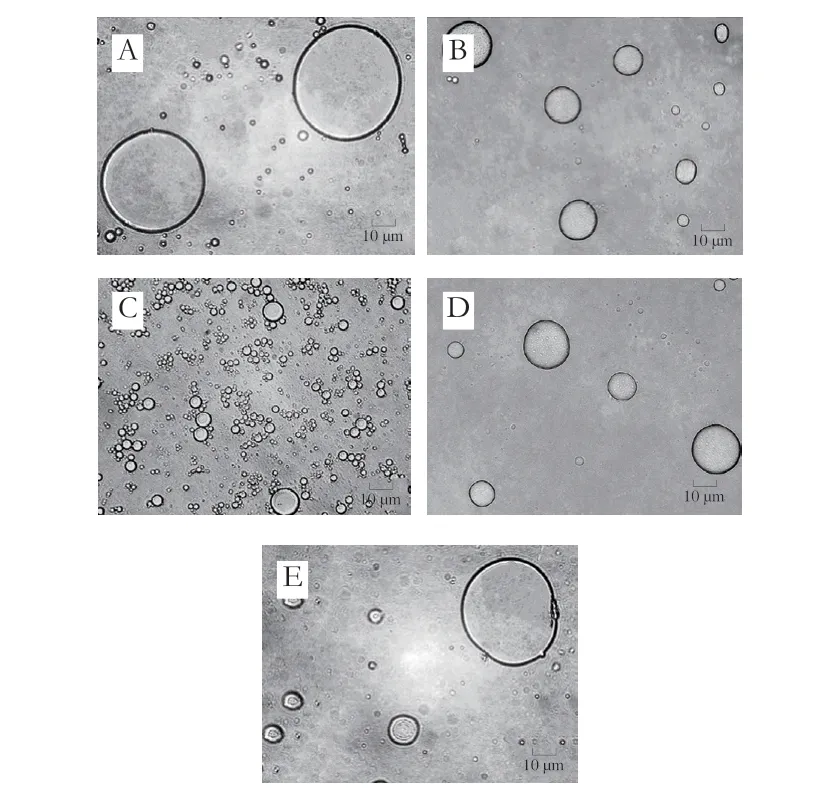
图3 不同盐质量分数下熬煮150 min后金枪鱼头汤中MNPs的形貌图Fig.3 Morphology of MNPs in tuna head soup boiled for 150 min with different salt concentrations
通过光学显微镜可以进一步观察熬煮150 min后,不同加盐质量分数条件下金枪鱼头汤中MNPs的形态变化(图3)。不同加盐质量分数条件下,汤中MNPs的形态存在比较明显的区别。随着盐质量分数的增加,汤中MNPs的大小呈现先减小后增大的趋势。在盐质量分数为0.5%时,汤中MNPs的平均粒径最小且分布较为均一,与盐质量分数对MNPs平均粒径和PDI影响的结果一致(图2A、B)。此时汤中MNPs的尺寸较小,更易在小肠中被吸收,减少肠道营养吸收负担。在盐质量分数为0.3%~0.5%时,汤中MNPs的尺寸及其分布减小的原因可能是随着盐质量分数的增加,汤中溶出的盐溶性球蛋白和阴离子多糖含量增加,使得越来越多的蛋白质和阴离子多糖结合在MNPs的表面,促使MNPs之间的静电斥力增大并抑制MNPs之间发生聚集而使其尺寸减小。但是当盐质量分数超过0.5%时,过量的盐会屏蔽MNPs表面由阴离子多糖和蛋白质表面的羟基基团所提供的负电荷,导致其表面静电斥力的降低。较弱的静电斥力促使MNPs之间彼此接近并聚集形成尺寸较大的MNPs聚集体[23]。
2.5 激光共聚焦显微镜观察MNPs各组分之间相互作用


图4 不同盐质量分数下甘油三酯、Cl- 和分布Fig.4 Distribution of triglycerides, Cl- and Na+ in MNPs at different salt concentrations



图5 不同盐质量分数下磷脂、蛋白质和糖基化分子分布图Fig.5 Distribution of phospholipids, proteins and glycosylated molecules(glycoproteins and glycolipids) in MNPs at different salt concentrations
从图4可以看出,作为非极性分子的甘油三酯主要位于MNPs的中心;而由图5可知,极性磷脂、蛋白质和糖基化分子这3 种两亲性物质则吸附在甘油三酯上从而在其表面形成了能够良好连接水相和油相的膜结构,这与Qian Xueli等[23]的研究结果一致。其中蛋白质和多糖除了作为MNPs的基本组成部分之外,它们还能够通过提高膜表面的黏弹性从而增加MNPs的稳定性。NaCl作为一种离子化合物,当被加入到汤中后,NaCl晶体在汤中会自动分解成Na+和Cl-。其中Cl-与甘油三酯结合,Na+与电负性的多糖和蛋白质表面的羟基结合。但是Na+和Cl-的存在会改变蛋白质与多糖之间的相互作用,从而导致MNPs的稳定性受到影响。在盐质量分数为0.3%时,从图4A和图5A可以看出,汤中存在大小不一的MNPs,并由于小颗粒与大颗粒之间的溶解度和化学势的差异,在MNPs不断进行布朗运动的过程中,小颗粒会吸附在大颗粒的表面并形成粒径更大的MNPs。当盐质量分数增加到0.4%时(图4B和图5B),可以观察到MNPs内部存在着磷脂、蛋白以及糖基化分子等两亲性物质。其原因可能是在该盐质量分数条件下,MNPs之间的聚集虽然减少,但当其发生聚集时,甘油三酯之间的结合不紧密,破裂的膜结构就会处于甘油三酯的间隙中。而盐质量分数为0.5%时(图4C和图5C),共聚焦显微镜的结果也进一步说明在该质量分数下,汤中MNPs的粒径最小且尺寸分布最均一。随着盐质量分数增加到0.7%(图4E和图5E),MNPs的粒径逐渐增大,与光学显微镜结果一致。
3 结 论
本实验研究了加盐质量分数对金枪鱼头汤中物质迁移以及MNPs形成的影响,结果表明,在1∶8鱼水质量比、120 ℃油煎温度煎40 s后再熬煮150 min的条件下,分别加盐质量分数0.3%、0.4%、0.5%、0.6%、0.7%,其中最适宜的加盐质量分数为0.5%,此条件下营养物质的迁移量达到最大且营养品质优。当盐质量分数为0.5%时,NaCl能够促进MNPs的形成,此时汤中形成的MNPs具有稳定双分子层以及最小的平均粒径((519.10±3.11)nm)。同时,Cl-渗透进入MNPs的中心并与甘油三酯结合,Na+则与分布在MNPs外围的电负性多糖结合并抵消其负电荷。

