磷脂对自微乳口服吸收、淋巴转运和体外特征的影响
廖恒锋,廉春放,高越,张运,刘玉玲(中国医学科学院,北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,药物传输技术及新型制剂北京市重点实验室,北京 100050)
自微乳化药物递送系统(SMEDDS)是一种由脂质(油相)、表面活性剂(乳化剂)、助表面活性剂(助乳化剂)和药物组成的均一混合物,可用于提高水难溶性药物的生物利用度[1]。SMEDDS 口服后可在胃肠液中自发乳化为水包油型纳米级乳滴,粒径一般为10 ~300 nm[2],可通过增强药物溶解度、提高药物胃肠道黏膜渗透性和淋巴转运等方式改善药物口服吸收[3]。SMEDDS 乳化后,药物会从乳滴的油相进入表面活性剂层,然后释放到水相中。水相中的药物被肠上皮细胞吸收后可通过门静脉吸收入血,或是与脂蛋白结合形成乳糜微粒后通过肠道淋巴系统进入血液循环。SMEDDS 形成的纳米级乳滴也可以直接通过细胞旁路途径、肠上皮细胞和肠道相关淋巴组织的内吞作用进入肠道淋巴系统,而进入肠道淋巴系统的药物可经肠系膜毛细淋巴管、淋巴结、乳糜池、肠干、胸导管等,最终在左颈静脉和左锁骨下静脉的连接处汇入血液。同时,由于淋巴系统是T、B 淋巴细胞等免疫细胞的转运通路,因此,与门静脉吸收相比,药物经淋巴转运的优势在于不仅可避开肝脏的首过效应,而且可以增强免疫调节剂或化疗药物的淋巴靶向,有利于免疫调节类药物直接作用于免疫细胞[4-8]。
为了获得更好的乳化效果,口服自乳化制剂中通常以非离子型表面活性剂如吐温等作为乳化剂,很少以两亲性的磷脂作为乳化剂。但有将药物制备成磷脂复合物后再构建SMEDDS 的报道,其目的是为了增加药物的亲脂性,提高载药量。如Hui 等[9]报道的一种基于磷脂复合物的汉黄芩苷过饱和自乳化制剂(S-SEDDS),其载药量远高于普通自乳化制剂(SEDDS),且粒径从759.5 nm 减小到386.0 nm。同时相比于普通SEDDS,汉黄芩苷磷脂复合物S-SEDDS 的体外肠吸收和体内生物利用度也显著增加。此外,依托泊苷磷脂复合物自微乳、苦参碱磷脂复合物自微乳、桑色素磷脂复合物自微乳以及鞣花酸磷脂复合物自微乳等都取得了类似的结果[10-13]。在前期研究中,本课题组对黄芩素磷脂复合物自微乳(BA-PC-SMEDDS)进行研究,其相对生物利用度高达448.7%(相对于黄芩素原料药)。与传统黄芩素自微乳(CBA-SMEDDS)相比,BA-PC-SMEDDS 的AUC0~t和Cmax分别提高了1.31倍和1.87 倍。而与黄芩素原料药相比,BA-PCSMEDDS 可使黄芩素的淋巴转运比例从18.8%增加到70.2%[14]。
磷脂复合物中的磷脂进入胃肠道后可被磷脂酶A2 代谢为游离脂肪酸和溶血磷脂酰胆碱,参与肠道脂蛋白的合成。在药物淋巴转运的过程中,药物可与脂蛋白的疏水性核心结合从而被摄入肠道淋巴系统[15]。因此推测,SMEDDS 中如加入游离磷脂,有可能对促进吸收和促淋巴转运有积极作用。但关于磷脂作为联合乳化剂对SEDDS 胃肠吸收和淋巴转运影响的研究相对较少。因此,本文以黄芩素为模型药物,考察吐温-80/磷脂为联合乳化剂对黄芩素自微乳(BA-PC-SMEDDS)的体内外特征影响,并与传统不含磷脂的自微乳(CBA-SMEDDS)以及文献报道的黄芩素磷脂复合物的自微乳(BAPCSMEDDS)[14]进行比较,评价单纯加入磷脂的效果。这对于难以形成磷脂复合物的模型药物的自微乳制备,具有重要学术价值与实际借鉴意义。
1 材料
1.1 试药
黄芩素(含量:98%,批号:ZL2017-01-22,南京泽朗生物科技有限公司);大豆磷脂(上海太伟药业有限公司);油酸乙酯、吐温-80、抗坏血酸(国药集团化学试剂有限公司);三羟基马来酸甲酯、牛磺脱氧胆酸钠(NaTDC)、猪胰腺胰脂肪酶、6-羟基黄酮(Sigma-aldrich);黄芩苷对照品(含量:98.0%,Lot:LG40S31)、放线菌酮、肝素钠(百灵威);黄芩素对照品(含量:98.0%,上海诗丹德生物技术有限公司,Lot:5699);Transcutol HP(法国嘉法狮);乙腈、甲醇、甲酸(Fisher Chemical)为色谱纯,其余试剂为分析纯。
1.2 仪器
Agilent 1260 高效液相色谱仪、HPLC-MS/MS仪(安捷伦科技有限公司);NICOMPTM380ZLS型粒度仪(美国PSS 粒度仪公司)。
2 方法
2.1 黄芩素自微乳的制备
以油酸乙酯、吐温-80 和Transcutol HP(2∶5∶3)分别作为油相、乳化剂和助乳化剂,黄芩素原料药投料量2.2%,大豆磷脂(联合乳化剂)投料量7.8%。按处方量称取适量油酸乙酯(EO)、吐温-80 和Transcutol HP 于适宜玻璃容器内,摇晃均匀,得空白自微乳浓缩液。再称取黄芩素原料药(BA)和大豆磷脂(PC)置空白自微乳中,并将其置于空气浴振荡器中(25℃,210 r·min-1),待黄芩素与大豆磷脂溶解完全后,12 000 r·min-1,离心15 min,取上清液即得黄芩素自微乳(BA-PCSMEDDS)。以不加大豆磷脂的自微乳浓缩液作为传统自微乳(CBA-SMEDDS)。
2.2 黄芩素含量测定
采用高效液相色谱法(HPLC)测定BA-PCSMEDDS 和CBA-SMEDDS 中黄芩素的含量,以Agilent ZORBAX SB C18(250 mm×4.6 mm,5 μm)为色谱柱,0.05%磷酸-甲醇(35∶65,V/V)为流动相,流速为1.0 mL·min-1,柱温为25 ℃,进样量为10 μL,检测波长275 nm。
2.3 乳化效率及粒径、电位测定
用移液枪移取200 μL 自微乳浓缩液缓慢加入20 mL 蒸馏水中(37℃水浴,缓慢搅拌),记录自乳化时间及外观,并按照下列标准判断自乳化效率的级别:Ⅰ.迅速分散乳化(时间≤1 min),形成澄清或微微泛蓝的微乳;Ⅱ.迅速分散乳化(时间≤1 min),形成蓝白色微乳;Ⅲ.分散乳化稍慢(时间≤2 min),形成亮白色奶状乳剂;Ⅳ.分散乳化较慢(时间>2 min),液体呈暗灰白色,外观略带油状;Ⅴ.分散乳化困难,无法形成均一体系,一直都有油滴存在。取乳化后的溶液,采用激光粒度仪测定自微乳乳滴的电位、粒径及其分布。
2.4 浊点
用移液枪移取200 μL 自微乳浓缩液缓慢加入20 mL 蒸馏水中(37℃水浴,缓慢搅拌),梯度升温(2 ℃·min-1),溶液出现浑浊现象时的温度即为浊点温度。
2.5 稀释稳定性
用移液枪移取适量自微乳浓缩液,按1∶5、1∶10、1∶20、1∶50、1∶100、1∶500、1∶1000的比例用适量蒸馏水稀释乳化(37 ℃水浴,缓慢搅拌),考察不同稀释倍数对自微乳乳化效率及乳滴粒径的影响。
2.6 体外释放度考察
2.6.1 不同pH 对药物释放的影响 取100 μL 自微乳浓缩液于5 mL 水中稀释后,精密量取1 mL置经纯水过夜浸泡处理的透析袋内,透析袋两端用夹子夹紧,放入盛有100 mL 释放介质(pH 1.0或pH 6.8)的烧杯中,于震荡水浴锅中37℃,100 r·min-1下搅拌,每个处方平行操作3 次,分别于0.5、1、2、4、8、12、24 h 取样2 mL。每次取样前搅拌充分,取样后补加2 mL 释放介质。依法测定,计算BA-PC-SMEDDS 和CBA-SMEDDS 黄芩素的累积释放度。
2.6.2 胰酶对药物释放的影响 取1 mL 自微乳置45 mL 人工肠液(2 mmol·L-1三羟基马来酸甲酯、150 mmol·L-1氯化钠、5 mmol·L-1氯化钙、5 mmol·L-1牛磺脱氧胆酸钠、1.25 mmol·L-1磷脂,pH 6.5)中稀释乳化(37℃,缓慢搅拌1 min)。加入5 mL 猪胰酶溶液(16 mg·mL-1),体外脂解开始,精密量取1 mL 脂解液置经纯水过夜浸泡处理的透析袋内,透析袋两端用夹子夹紧,放入盛有100 mL 释放介质(pH 6.5)的烧杯(250 mL)中,于震荡水浴锅中37℃、100 r·min-1下搅拌,每个处方平行操作3 次,分别于5、15、30、45、60、90、180 min 取样2 mL。每次取样前搅拌充分,取样后补加2 mL 释放介质。照含量测定HPLC 方法,依法测定,计算BA-PC-SMEDDS 和CBASMEDDS 黄芩素的累积释放度。
2.7 长期储存稳定性考察
分别制备BA-PC-SMEDDS 和CBA-SMEDDS,在4、25 和40℃条件下放置3 个月,并在0、1、2、3 个月时取样观察并记录自微乳浓缩液的外观形态,测定其乳化效率和粒径。
2.8 大鼠体内药代动力学研究
雄性SD 大鼠10 只,体质量(250±20)g,随机分成两组,实验前禁食12 h,不禁水,实验期间自由饮水。按40 mg·kg-1灌胃给予CBASMEDDS 和BA-PC-SMEDDS,给药后分别于5、15、30、45、60、75、180、360、480、600、720和1440 min 眼眶后静脉丛取血0.5 mL,置预先肝素化的1.5 mL 尖底离心管中,4000 r·min-1离心15 min,吸取上层血浆,置-80℃冰箱保存,测定前常温放置解冻。
2.9 淋巴转运研究
雄性SD 大鼠10 只,体质量(250±20)g,实验前禁食12 h,不禁水,实验期间自由饮水。随机分成两组,分别腹腔注射3 mg·kg-1的放线菌酮生理盐水注射液,再于1 h 后按40 mg·kg-1剂量分别灌胃给予CBA-SMEDDS 和BA-PCSMEDDS,并 于5、15、30、45、60、75 和180 min 眼眶后静脉丛取血0.5 mL,置预先肝素化的1.5 mL 尖底离心管中,4000 r·min-1离心15 min,吸取上层血浆,置-80℃冰箱保存,测定前常温放置解冻。
2.10 体内分析
2.10.1 样品处理 取血浆100 µL,置1.5 mL 尖底离心管,加入抗坏血酸10 µL(200 mg·mL-1)、内标工作液20 µL(6-羟基黄酮,5 μg·mL-1),再加入300 µL 甲醇,涡旋混合60 s,于12 000 r·min-1离心10 min,然后吸取上清液,置离心管中,离心浓缩挥去溶剂(40℃),再加200 µL 甲醇-水(80∶20,V/V)溶解,涡旋30 s 后,于12 000 r·min-1离心5 min,取上清液20 µL 进样,按“2.10.2”项下色谱条件和质谱条件测定血浆中黄芩苷药物浓度。
2.10.2 色谱条件
① 色谱条件:色谱柱为Agilent ZORBAX SB C18柱(250 mm×4.6 mm,5 µm),进样体积为20 µL,柱温为25 ℃,流动相为乙腈-0.1%甲酸,流速为1.0 mL·min-1,采用线性梯度洗脱,洗脱程序如表1所示。
② 质谱条件:离子源为电喷雾离子源(ESI),正离子方式检测,多离子反应监测模式(MRM);雾化器压力40 psi,干燥气流速9 L·min-1,干燥气温度350℃,毛细管电压4000 V,分流比1∶2。用于定量的MRM 检测离子对:黄芩苷,CE18,F115,[M +H]+447.0 →271.1;6-羟基黄酮,CE30,F135,[M +H]+239.0 →137.0。

表1 梯度洗脱表Tab 1 Program of gradient elution
2.11 统计学方法
采用DAS 2.0 软件计算相关药代动力学参数,结果表示为±s。采用SPSS 17.0 软件中独立样本t检验进行统计学分析,P<0.05 代表差异具有统计学意义。
3 结果
3.1 SMEDDS 质量表征
本研究为了考察磷脂作为联合乳化剂对黄芩素自微乳体内外行为的影响,选择20 mg·g-1作为两种自微乳的载药量。实验结果表明BA-PC-SMEDDS用水稀释后,在1 min 内乳化完全,且乳液澄清透明,静置24 h 无相分离现象或药物沉淀。BA-PCSMEDDS 和CBA-SMEDDS 的乳滴粒径、电位及其多分散指数如表2所示,其中CBA-SMEDDS 的数据来自文献[14]。由表2可知BA-PC-SMEDDS 乳化后的乳滴粒径为(11.7±0.3)nm,其Zeta 电位(-35.63±0.58)mV 显著高于CBA-SMEDDS 的Zeta 电位(-19.58±1.30)mV。而BA-PC-SMEDDS的多分散指数高于CBA-SMEDDS,推测可能是由于磷脂的亲水亲油平衡值(HLB)值(7)低于吐温-80(15),致使SMEDDS 的乳化能力有所下降。此外,由于Zeta 电位可以反映乳滴表面电荷数量,当乳滴表面电荷增加时可以抑制乳滴聚集增强微乳稳定性,而表面电荷减小则有可能导致相分离[16]。因此,本实验结果表明磷脂作为联合乳化剂可以增加黄芩素自微乳乳滴的表面电荷,增强微乳液的胶体稳定性,避免微乳发生相分离。同时,BA-PC-SMEDDS 的浊点温度(71 ~75℃)高于37℃也保证了自微乳进入胃肠道后不会发生相分离,进而影响药物的释放及吸收。
将SMEDDS 用双蒸水稀释不同倍数后,考察自微乳乳滴粒径变化及是否有药物沉淀发生。结果如图1所示,其中CBA-SMEDDS 的数据来自文献[14]。当稀释倍数为20 ~100 倍时,BA-PCSMEDDS 的乳滴粒径无明显变化。当稀释倍数小于20 倍或大于100 倍时BA-PC-SMEDDS 的乳滴粒径小于15 nm,同时乳化后12 h 内乳液未出现相分离、浑浊或药物沉淀等现象。因此,结果表明BA-PC-SMEDDS 在5 ~1000 倍稀释范围内均能稳定乳化,同时从图1中也可看出含磷脂的BA-PC-SMEDDS 的乳滴粒径在各稀释条件下均小于CBA-SMEDDS,说明磷脂作为联合乳化剂可以提高黄芩素自微乳的稀释稳定性。
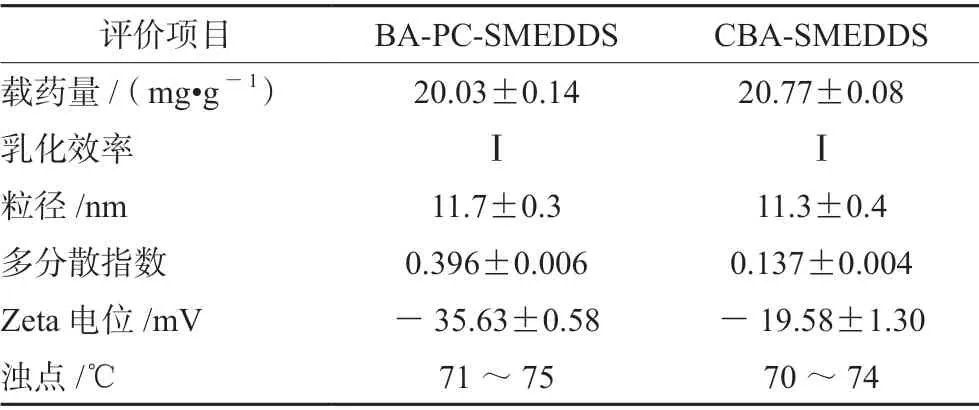
表2 BA-PC-SMEDDS 和CBA-SMEDDS 质量评价(n =3)Tab 2 Characterization of BA-PC-SMEDDS and CBA-SMEDDS(n =3)
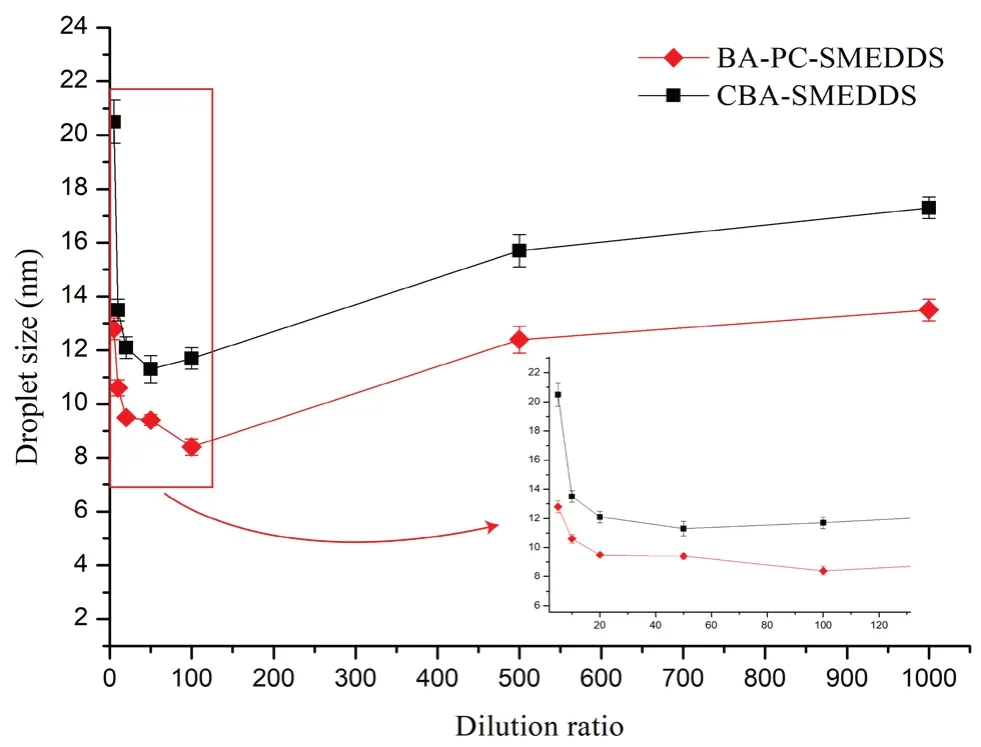
图1 BA-PC-SMEDDS 和CBA-SMEDDS 在不同稀释倍数下的粒径分布(n =3)Fig 1 Size of BA-PC-SMEDDS and CBA-SMEDDS subject to different folds of dilution with purified water(n =3)
3.2 体外释放度考察
采用透析法考察游离药物从自微乳中的释放,BA-PC-SMEDDS 和CBA-SMEDDS 在pH 1.0 和pH 6.8 缓冲介质中的释放曲线如图2所示,其中CBASMEDDS 的数据来自于文献[14]。结果表明,BAPC-SMEDDS 在开始2 h 内释放速度较快,2 h 后随着时间的延长释放速度逐渐变慢,12 h 内的累积释放度可达90%以上,但BA-PC-SMEDDS 和CBASMEDDS 的释放曲线较为相似并无明显区别。因此,可以推测磷脂的加入可能对于黄芩素自微乳体外释药速度并无明显影响。此外,还考察了胰酶对自微乳体外药物释放的影响,如图3所示,BAPC-SMEDDS 和CBA-SMEDDS 的释放曲线显示胰酶对自微乳体外释药速度并无明显影响。该实验结果表明胰酶和人工肠液中其他成分均对自微乳中药物释放无明显影响。
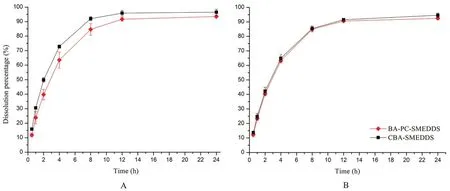
图2 BA-PC-SMEDDS 和CBA-SMEDDS 在pH 1.0(A)和pH 6.8(B)不同介质中的药物释放曲线(n =3)Fig 2 Release profile of baicalein in pH 1.0(A)and pH 6.8(B)medium from BA-PC-SMEDDS and CBA-SMEDDS(n =3)
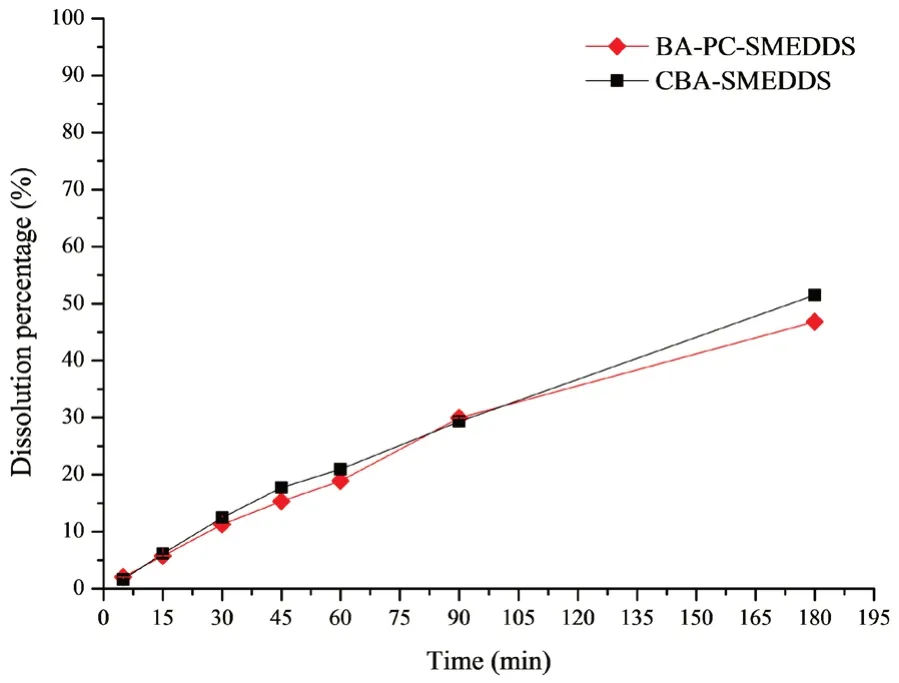
图3 BA-PC-SMEDDS 和CBA-SMEDDS 在人工肠液中的药物释放曲线(n =3)Fig 3 Release profile of baicalein from BA-PC-SMEDDS and CBASMEDDS in the simulated intestinal fluid(n =3)
3.3 长期储存稳定性
实 验 表 明BA-PC-SMEDDS 在4、25 和40℃条件下放置3 个月,自微乳浓缩液均澄清透明,但传统自微乳CBA-SMEDDS(数据来自文献[14])在3 种条件下放置1 个月即出现药物沉淀。同时BAPC-SMEDDS 在不同条件下放置后取出,均能在1 min 内乳化完全,乳液澄清透明,其乳滴粒径无明显变化且均小于CBA-SMEDDS(见图4)。因此,本实验表明磷脂作为联合乳化剂有助于提高黄芩素自微乳的长期稳定性,避免药物析出。
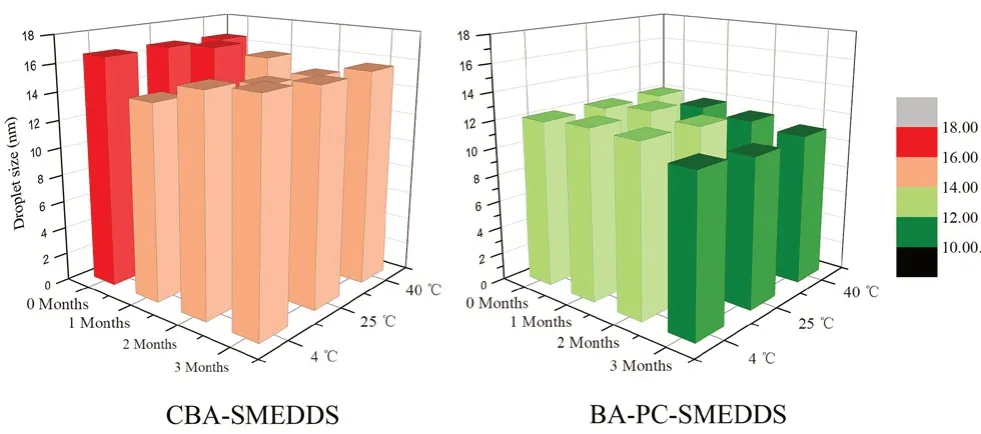
图4 BA-PC-SMEDDS 和CBA-SMEDDS 在不同温度下储存3 个月后的乳滴粒径分布Fig 4 Droplet size of BA-PC-SMEDDS and CBA-SMEDDS at different temperature for 3 months
3.4 大鼠体内药代动力学研究
黄芩素口服进入血浆后会迅速发生葡萄糖醛酸化代谢,在血浆中主要以其活性代谢产物黄芩苷的形式存在,而黄芩素原形药的浓度较低。因此,我们选择血浆中的黄芩苷对黄芩素自微乳的血浆药代动力学特征进行研究。大鼠口服BA-PCSMEDDS 和CBA-SMEDDS 后,血浆中黄芩苷的浓度-时间曲线和药代动力学参数分别如图5和图6所示,其中CBA-SMEDDS 的数据来自文献[14]。结果表明BA-PC-SMEDDS 的黄芩苷血浆药物浓度显著高于CBA-SMEDDS,Cmax为CBA-SMEDDS的1.39 倍,而AUC0~t为CBA-SMEDDS 的1.37倍。由此我们可以推测磷脂作为联合乳化剂不仅可以增强自微乳的物理稳定性而且可以进一步提高黄芩素的口服吸收。
3.5 淋巴转运研究
研究表明脂溶性药物被小肠上皮细胞吸收后可通过淋巴转运和门静脉两种途径进入血液循环系统,而药物的淋巴转运途径则完全依赖于小肠上皮细胞中乳糜微粒的形成和分泌。根据文献报道[17-19],乳糜微粒的分泌可以被放线菌酮完全阻断,也就是说放线菌酮可以抑制药物的淋巴转运途径,且该效果与淋巴管插管的结果相同。根据前期体内药代动力学研究的结果,发现黄芩素进入血浆后会被快速代谢为黄芩苷,同时黄芩素的吸收与代谢过程主要发生在口服后3 h 内。因此,本实验采用黄芩素口服后3 h 内血浆中黄芩苷暴露量来进行黄芩素的淋巴转运研究。
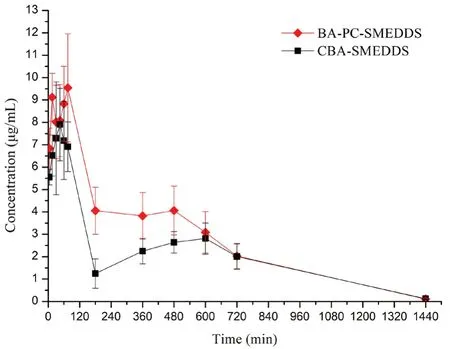
图5 大鼠口服BA-PC-SMEDDS 和CBA-SMEDDS 后血浆中黄芩苷的药物浓度-时间曲线(n =5)Fig 5 Mean plasma concentration-time curves of baicalin after the oral administration of BA-PC-SMEDDS and CBA-SMEDDS in rats (n =5)
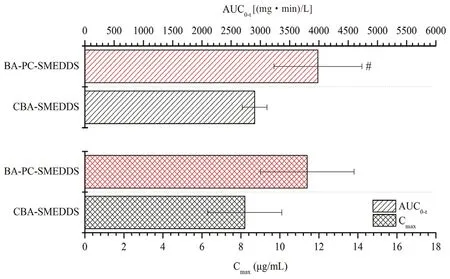
图6 大鼠口服BA-PC-SMEDDS 和CBA-SMEDDS 后血浆中黄芩苷的药代动力学参数(n =5)Fig 6 Pharmacokinetic parameters of baicalin after the oral administration of BA-PC-SMEDDS and CBA-SMEDDS in rats (n =5)
未经前处理的黄芩苷的AUC反映的是经所有途径吸收的黄芩素(包括门静脉和淋巴转运)。而腹腔注射放线菌酮后的黄芩苷AUC反映的是从除淋巴转运外其他途径吸收的黄芩素,该部分黄芩素经上皮细胞吸收后直接进入血液循环系统。因此,药物淋巴转运量由未经前处理的黄芩苷血浆AUC减去腹腔注射放线菌酮后的血浆AUC计算而得,最终结果如图7和图8所示,其中CBA-SMEDDS 的数据来自文献[14]。
药代动力学研究表明大鼠口服BA-PC-SMEDDS后,黄芩苷Cmax高达11.5 μg·mL-1。而从图7中可以看出,腹腔注射放线菌酮后,BA-PC-SMEDDS 的黄芩苷血药物浓度显著下降,表明BA-PC-SMEDDS口服后大部分黄芩素经淋巴转运进入循环系统。此外,当淋巴转运被完全抑制后,BA-PC-SMEDDS 和CBA-SMEDDS 的血浆药物浓度-时间曲线除45 min和60 min 这两个时间点外并无明显区别。而图8的结果表明,相比于传统自微乳,磷脂可以将黄芩素口服吸收后的淋巴转运程度从56.2%提高到68.6%。由此可以推断,磷脂作为联合乳化剂主要是通过增强黄芩素的淋巴转运来提高自微乳口服吸收。而在45 min 和60 min这两个时间点BA-PC-SMEDDS 的血药浓度略高于CBA-SMEDDS,可能是由于磷脂为细胞膜的主要成分,BA-PC-SMEDDS 中磷脂的加入可以提高乳滴与细胞膜的生物相容性从而促进肠上皮细胞对乳滴的摄取,使得BA-PC-SMEDDS 的血药浓度略有增加。
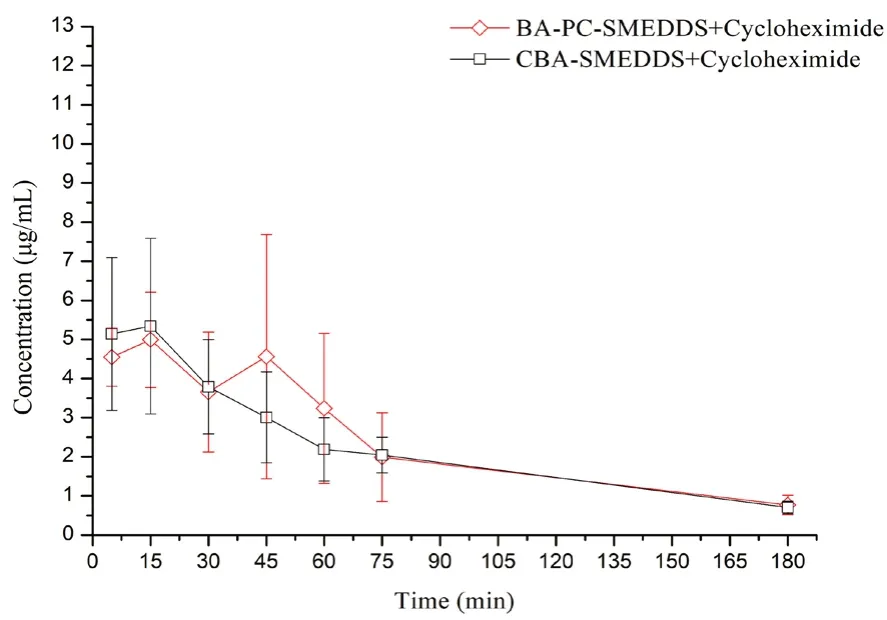
图7 腹腔注射3.0 mg·kg-1 放线菌酮的大鼠口服BA-PC-SMEDDS和CBA-SMEDDS 后3 h 内血浆中黄芩苷的药物浓度-时间曲线(n=5)Fig 7 Mean plasma concentration-time curves of baicalin in rats within 3 h after the intraperitoneal pretreatment with 3.0 mg·kg- 1 cycloheximide following oral administration of BA-PC-SMEDDS and CBA-SMEDDS(n =5)
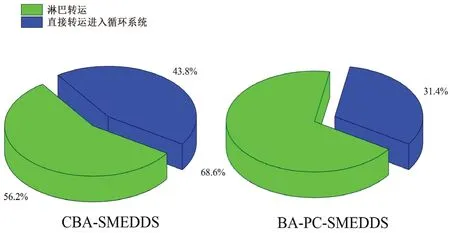
图8 大鼠口服CBA-SMEDDS 和BA-PC-SMEDDS 后直接转运进入循环系统的黄芩素和通过淋巴转运间接进入循环系统的黄芩素Fig 8 Fraction of baicalein transported directly to the systemic blood circulation and fraction of baicalein transported indirectly to the systemic blood circulation via intestinal lymphatic system after the oral administration of CBA-SMEDDS and BA-PC-SMEDDS
4 讨论
磷脂是一类具有两亲性的脂类分子,在结构上由两个疏水性的脂肪酸链“尾部”和一个亲水性的磷酸基团“头部”组成,在水中可形成脂质双分子层。同时,磷脂也可被用作乳化剂和表面活性剂,以及参与细胞膜的组装和脂蛋白转运等过程。在药物递送系统中的磷脂可通过以下机制改善药物吸收,如改变药物释放、促进淋巴转运、降低药物毒副作用、促进经皮渗透,以及作为增溶剂、表面活性剂、抗氧剂、渗透促进剂等[20]。
在本研究中,磷脂作为联合乳化剂可以通过对药物的增溶作用显著改善黄芩素SMEDDS 的储存稳定性,抑制储存过程中药物的析出。同时,由于磷脂的亲水性头部由带负电荷的磷酸基团组成,含磷脂的SMEDDS 乳化后其乳滴显示出更高的表面电荷,有利于减少微乳液中乳滴的积聚和相分离,提高自微乳的胶体稳定性和稀释稳定性。同时,磷脂可在磷脂酶的作用下水解产生游离脂肪酸,而游离脂肪酸被小肠上皮细胞吸收后可以再合成为甘油三酸酯,并与磷脂、胆固醇、载脂蛋白等合成肠道脂蛋白。在药物淋巴转运的过程中,药物可通过与这些脂蛋白的疏水性核心结合而被摄入肠道淋巴系统。因此,磷脂及其水解产生的脂肪酸可以通过促进脂蛋白的生成来促进药物的淋巴转运。此外,磷脂作为细胞膜的重要组成部分,可提高肠上皮细胞膜的流动性,从而增加药物或载体的膜渗透性。因此,磷脂作为联合乳化剂不仅可以通过提高药物及乳滴的渗透性改善药物的胃肠吸收,还可以通过增强药物的淋巴转运提高药物的生物利用度。
综上所述,本研究表明磷脂可以通过一系列的机制提高自微乳的储存稳定性、生物利用度和淋巴转运。同时,与黄芩素原料药(pH 1.0 和pH 6.8 的释放介质中24 h 累积释放度仅能达到60%和40%[14])相比,BA-PC-SMEDDS 的释药速度和程度显著增加,BA-PC-SMEDDS 的Cmax也为原料药的5.7 倍,相对生物利用度更高达470%[14]。这也表明BA-PC-SMEDDS 可以显著改善黄芩素的体内外释放特征,有利于药物的口服吸收。虽然与文献报道的BAPC-SMEDDS 相比,本研究中BA-PC-SMEDDS 的Cmax仅 为BAPC-SMEDDS的74%,淋巴转运也略低于BAPC-SMEDDS[14]。但本研究表明处方中使用磷脂作为联合乳化剂对于难以形成磷脂复合物的难溶性药物的自微乳制备,仍然具有重要的学术价值与实际借鉴意义。

