LRRK2调节纹状体神经元多巴胺受体1含量及机制
杨 璇 刘小鹏 彭 宇 甄 然 宋彬彬 李 阔 于 佳
富亮氨酸重复激酶2(leucine-rich repeat kinase 2,LRRK2)突变是PD最为常见的遗传因素,LRRK2突变所致的PD发病年龄晚,在临床表现上与特发性PD更为接近[1]。因此,对LRRK2生理病理功能机制的解释对于阐释帕金森病发病机制至关重要。LRRK2表达异常可导致小鼠运动功能障碍,但是其中的具体机制目前仍不明确[2]。本实验将利用LRRK2基因敲除小鼠、LRRK2 G2019S突变基因敲入小鼠和R1441C突变基因敲入小鼠,明确LRRK2的表达或功能异常对纹状体神经元多巴胺受体1(dopamine receptor 1,D1R)含量的影响,并探讨LRRK2调节纹状体神经元中D1R的机制,为丰富人们对LRRK2参与帕金森病发病机制的认识提供理论依据。
材料与方法
1.实验动物:LRRK2基因敲除小鼠、LRRK2 G2019S突变基因敲入小鼠和R1441C突变基因敲入小鼠及野生型对照组,饲养在美国国立卫生院老年病研究所,根据实验动物相关管理规定进行操作和处理[3~5]。
2.主要试剂:大鼠单克隆D1R抗体购自美国Sigma公司,兔单克隆抗体NeuN购自英国Abcam公司,山羊多克隆组织蛋白酶D(cathepsin D)抗体购自美国R&D Systems公司,驴血清购自美国Jackson Immuno Research公司,牛血清白蛋白购自美国Sigma公司,荧光二抗、抗荧光淬灭封片剂(含DAPI)购自美国Invitrogen公司。
3.免疫荧光染色:小鼠进行腹腔麻醉,沿胸旁正中线切开皮肤、剪断肋骨、暴露心脏。在心尖处剪开左心室,插入灌流针至左心室,剪开右心耳。先用PBS灌流,冲净血液后用4%多聚甲醛固定液灌流。取脑后继续固定过夜,再放入30%蔗糖溶液中进行脱水。沿鼠脑冠状面做冰冻切片,厚度为40μm,将切片浸泡于PBS置于4℃保存。配制PBST(含0.3% Triton X-100)缓冲液,用封闭液(含10%驴血清和1%牛血清白蛋白的PBST)孵育脑片1h,然后4℃一抗孵育过夜,清洗3遍;荧光二抗室温下孵育脑片1h,PBS清洗3遍。将脑片铺展于载玻片上,并用抗荧光淬灭封片剂(含DAPI)封片,晾干后,在激光共聚焦显微镜(LSM 800,德国Zeiss公司)下观察拍照。

结 果
LRRK2基因敲除或G2019S和R1441突变导致纹状体中多巴胺受体D1R含量下降(图1)。本实验利用LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠,应用免疫荧光染色的方法检测了12月龄小鼠纹状体中D1R表达情况。结果发现,LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体中D1R荧光强度均显著下降。
LRRK2通过调节溶酶体影响纹状体神经元多巴胺受体D1R含量(图2)。笔者利用cathepsin D免疫荧光染色标记溶酶体。观察发现,在12月龄野生型小鼠纹状体神经元内cathepsin D阳性的点状结构数目较少,而在12月龄LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元内cathepsin D阳性点状结构数目显著增加,在LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元内cathepsin D阳性点状结构直径增大。且经定量分析,在LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元内溶酶体所占据的总面积显著增加。同时笔者还发现,在野生型小鼠、LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元中cathepsin D与D1R共定位,也就表明在LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元溶酶体中D1R增加。
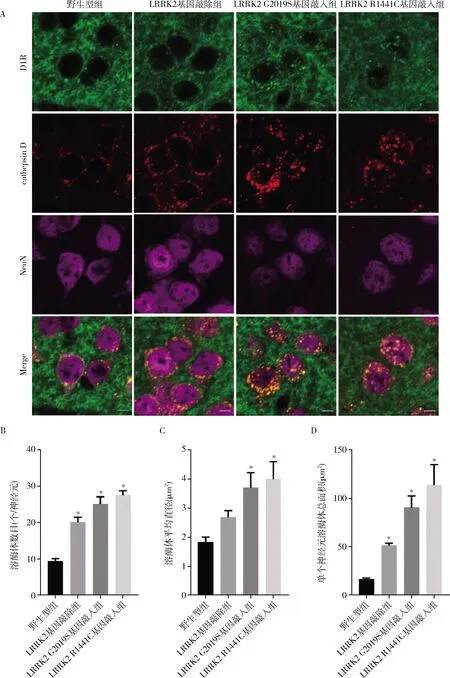
图2 12月龄野生型、LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元中D1R和溶酶体标志物cathepsin D共定位情况
讨 论
目前已经证实了超过40个与PD发病相关的LRRK2突变,目前研究最多的突变位点有9个,分别是位于ROC结构域的R1441C、R1441G、R1441H、R1514Q突变[6]。位于COR结构域的Y1699C突变,位于激酶结构域的I2012T、G2019S突变以及位于WD40结构域的G2385R突变[7,8]。
研究者建立了多个LRRK2转基因小鼠模型以研究LRRK2在神经系统中的功能。Melrose等[9]建立了过表达野生型LRRK2或G2019S突变的转基因小鼠模型,并利用HPLC法检测发现野生型或G2019S转基因小鼠纹状体内多巴胺含量与非转基因小鼠比较无明显的改变,但是利用微透析法检测发现野生型或G2019S转基因小鼠纹状体细胞外多巴胺含量明显降低。Chen等[10]研究发现,12~16月龄的G2019S转基因小鼠表现为明显的运动障碍,而L-DOPA能够有效地改善该运动障碍。Maekawa等[11]利用HPLC法检测到在10周龄的I2020T突变转基因小鼠纹状体内多巴胺以及其代谢物DOPAC和HVA的含量均显著下降,且变现为明显的运动功能障碍。以上证据表明,LRRK2与多巴胺神经传递以及小鼠神经运动功能密切相关。
多巴胺受体D1R与帕金森病的关系已被人们广泛研究。多巴胺与多巴胺受体D1R结合,诱发胞内信号通路发生改变,从而介导多巴胺调控的神经运动功能[12]。其中最为经典的就是cAMP/PKA信号通路。D1R通过和Gαs偶联激活腺苷酸环化酶,促使细胞内cAMP合成增加,从而激活PKA并磷酸化多个底物蛋白。PKA能够导致多个离子通道蛋白磷酸化状态发生改变,如AMPA、GABAA、NMDA以及L、N和P型钙离子通道,影响谷氨酸以及GABA等神经递质的释放,从而调节运动功能[13]。
Rassu等[14]研究发现,过表达野生型和突变型(G2019S和R1441C)LRRK2的SH-SY5Y细胞膜上的D1R含量明显升高。但这一实验主要是在细胞系中进行,且仅检测了外源性D1R含量的改变,而未检测小鼠脑内D1R含量。在本实验中,笔者检测发现LRRK2表达缺失或G2019S和R1441突变均可导致纹状体中多巴胺受体D1R含量下调,据此可以推断LRRK2可调节纹状体神经元中D1R的含量。而LRRK2是通过何种细胞生物通路影响D1R的含量这一科学问题尚未明确。有研究表明,LRRK2可以通过调节Rab7的活性影响次级内体的功能,进而影响细胞降解功能[15]。
本研究中笔者利用cathepsin D免疫荧光染色标记溶酶体,结果发现12月龄LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元内溶酶体数目均显著增加,在LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元内溶酶体直径增大。且经定量分析,在LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元内溶酶体所占据的总面积显著增加,这一结果表明LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元内的蛋白降解过程显著增强。同时,LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元内与cathepsin D共定位的D1R也显著增加,表明在LRRK2基因敲除小鼠、LRRK2 G2019S和R1441C基因敲入小鼠纹状体神经元内发生降解的D1R增加。
综上所述,本实验发现,LRRK2表达缺失或LRRK2 G2019S和R1441C突变均导致小鼠纹状体中D1R含量下降,明确了LRRK2表达缺失或基因突变所致功能异常可以影响纹状体中D1R的含量。LRRK2表达缺失、LRRK2 G2019S和R1441C突变可能通过促进小鼠纹状体神经元蛋白降解,促使进入溶酶体的D1R增加,D1R降解加强,从而使得纹状体神经元D1R含量下降。本研究结果有利于人们深入理解LRRK2的病理生理功能,并为LRRK2参与的帕金森病病理过程提供潜在的干预靶点。

