非注射用中成药说明书内容质量评价与完善建议
周旭,肖辉,王艳萍,聂鹤云,吴勇奇,陈双龙,朱卫丰
江西中医药大学循证医学研究中心,江西 南昌 330004
据统计,2014 年中成药工业总产值达6107 亿元,近10 年年增长率均超10%;2016 年药店销售的中成药占所有药品近半总份额(47.2%)[1-2]。但伴随规模不断扩增,中成药规范化使用和管理问题日益突出。有调查表明,93%中成药处方由西医师开出,94.9%的西医师曾开出中成药处方,但大部分西医师不了解中成药药性和配伍禁忌、辨证论治,仅凭模糊感觉用药,导致疗效降低、加重患者经济负担,甚至引发严重的安全问题[3]。造成该困境的主要原因之一是当前缺乏内容完整清晰、证据充足的中成药说明书指导西医师临床用药。
目前已有研究调查中药注射剂说明书的内容缺陷问题,发现普遍存在功能主治表述不规范、药物相互作用不明确和特殊人群用药方法不清楚等[4-6]。非注射用中成药说明书的内容质量尚不清楚。因注射和非注射用中成药在药理特点、治疗对象及应用范围等方面差异显著,故不能简单将注射剂说明书评价结果扩展至非注射剂。本研究随机抽取846 份非注射用中成药说明书,评价和总结各类说明书内容缺陷的发生率和可能原因,旨在为促进非注射用中成药规范化管理提供依据。
1 资料与方法
1.1 数据来源
检索和收集《中华人民共和国卫生部药品标准.中药成方制剂》、《国家基本药物目录:2018 年版》[7]和《国家基本医疗保险、工伤保险和生育保险药品目录(2017 年版)》[8]收录的所有上市非注射用中成药,共计5196 种。
1.2 抽样方法
本研究样本量估算公式为n=(U1-α/2/δ)2×P×(1-P),式中α为Ⅰ类错误概率,δ为容许误差,P为主要结局样本率。取α=0.05,δ=3%,P 参考周伟龙等[9]对本研究主要关注的安全性内容缺项率的调查结果,取值0.192,计算出最小样本量为663 份。对所有中成药进行顺序编号,采用Excel2016 为每种中成药产生随机数字,按随机数字排序后筛选前1000种中成药。筛选中主要排除不同生产厂家/商品名的同种中成药,仅保留首次出现的品种。若筛选结果未达到最小样本量,则进一步扩大筛选样本。
1.3 说明书获取途径
通过网络数据库和实地收集结合的方式获取说明书原文。检索关键词包括“说明书”“使用说明”“包装”。检索网络数据库包括国家食品药品监督管理总局(http://www.nmpa.gov.cn)、药智网(http://www.yaozh.com)和各说明书对应的药企官网,若上述数据未收录说明书原文,则辅以百度图片搜索引擎、中国知识资源总库(CNKI)、中国学术期刊数据库(万方数据)、中文科技期刊数据库(维普网)和中国生物医学文献数据库检索;若仍无法获得,则从江西中医药大学附属医院药房获取说明书实物。因说明书质量评价标准基于2006 年国家食品药品监督管理总局发布的《中药、天然药物处方药说明书格式内容书写要求及撰写指导原则》(以下简称《指导原则》)[10]和《中成药非处方药说明书规范细则》[11],故只纳入2006 年后发布的非注射用中成药说明书。
1.4 评价方法
1.4.1 评价内容
处方药评价内容包括《指导原则》要求列出的25个项目,其中【核准日期】和【修订日期】分开评价,非必需项目【警示语】和【特殊药品、外用药品标识】未纳入评价;对非处方药,从【注意事项】提取孕妇及哺乳期妇女、儿童和老年3 种特殊人群用药信息,与处方药合并评价。对非处方药的评价不涉及《中成药非处方药说明书规范细则》不要求列出的【临床试验】【药理毒理】和【药代动力学】3 项。
1.4.2 评价指标
①完全缺项:某项目完全无内容。②位置错误:因《指导原则》要求处方药说明书单列【孕妇及哺乳期妇女用药】【儿童用药】和【老年用药】3 项,若未按要求单列,如列入【注意事项】则评为“位置错误”。③内容无效:指某项目虽有内容但对指导用药无实质意义,如【不良反应】和【禁忌】项中仅说明“尚不明确”“请遵医嘱”等;并计算缺项+无效数/率。④内容不全:某项目未提供《指导原则》要求的所有信息,如【成份】中未列全部药物组成,或缺辅料。
1.5 质量控制
用Microsoft Access 2016 软件建立说明书内容数据库和表单,首先预提取和评价20 份说明书,根据提取结果修改完善数据库设计。然后由2 名评价员(肖辉和王艳萍)进行独立、重复的说明书数据提取和质量评价。若提取或评价结果有不一致之处,由二者讨论解决,若无法达成一致则由项目负责人裁定。
1.6 统计学方法
采用SPSS23.0 统计软件进行分析。对每个项目各评价指标进行频数和百分比的描述性统计。统计仅处方药需提供的项目时,在分母中剔除非处方药数。由一名评价员(聂鹤云)进行统计分析,另一名评价员(吴勇奇)验证结果。
2 结果与分析
2.1 抽样结果
随机排序并筛选前1000 种药品,筛除同种药品后,最终获得846 种非注射用中成药。其中处方药599种、非处方药247 种。通过网络数据库获得电子图片版说明书829 份,实地获取说明书17 份。
2.2 完全缺项率
处方药说明书项目中,几乎所有说明书(99.5%)均无【药代动力学】,其次为【临床试验】(93.0%缺项)和【药理毒理】(69.4%缺项)。处方药和非处方药均需列出的项目中,【药物相互作用】缺项率最高,达67.6%;其次为【老年用药】【儿童用药】【孕妇及哺乳期妇女用药】【核准日期】和【修改日期】,分别为57.0%、51.8%、42.7%、25.5%和16.9%;另有少量说明书无【规格】(0.8%)、【贮藏】(0.5%)和【包装】(0.2%)项目。其余项目均无缺项。详见图1。

图1 846 种非注射用中成药说明书内容完全缺项情况
2.3 内容无效
进一步分析说明书内容对指导用药是否无效,【不良反应】和【禁忌】内容无效率最高,分别为72.1%和56.1%;无效表述主要为“尚不明确”。29.9%说明书【药物相互作用】除“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师”外无实质内容。【注意事项】无效率为25.2%,主要表述为“尚不明确”“在医生指导下服用”和“请遵医嘱”。3 种特殊人群【老年用药】【儿童用药】【孕妇及哺乳期妇女用药】内容无效率分别为25.5%、25.4%和25.1%,主要表述为“遵医嘱”和“尚不明确”。另有0.2%说明书中【药代动力学】【药理毒理】内容无效。
合并计算完全缺项和内容无效总数后,缺项+无效率从高到低依次为:【药代动力学】(99.8%)、【药物相互作用】(97.5%)、【临床试验】(93.0%)、【老年用药】(82.0%)、【儿童用药】(77.1%)、【不良反应】(72.1%)、【药理毒理】(69.8%)、【孕妇及哺乳期妇女用药】(67.7%)、【禁忌】(56.1%)、【核准日期】(25.5%)、【注意事项】(25.2%)、【修改日期】(16.9%)。详见表1。
2.4 位置错误
599 份处方药说明书中,分别有339 份(56.6%)、243 份(40.6%)和239 份(39.9%)错将“孕妇及哺乳期妇女用药”“儿童用药”和“老年用药”内容写入【注意事项】中。
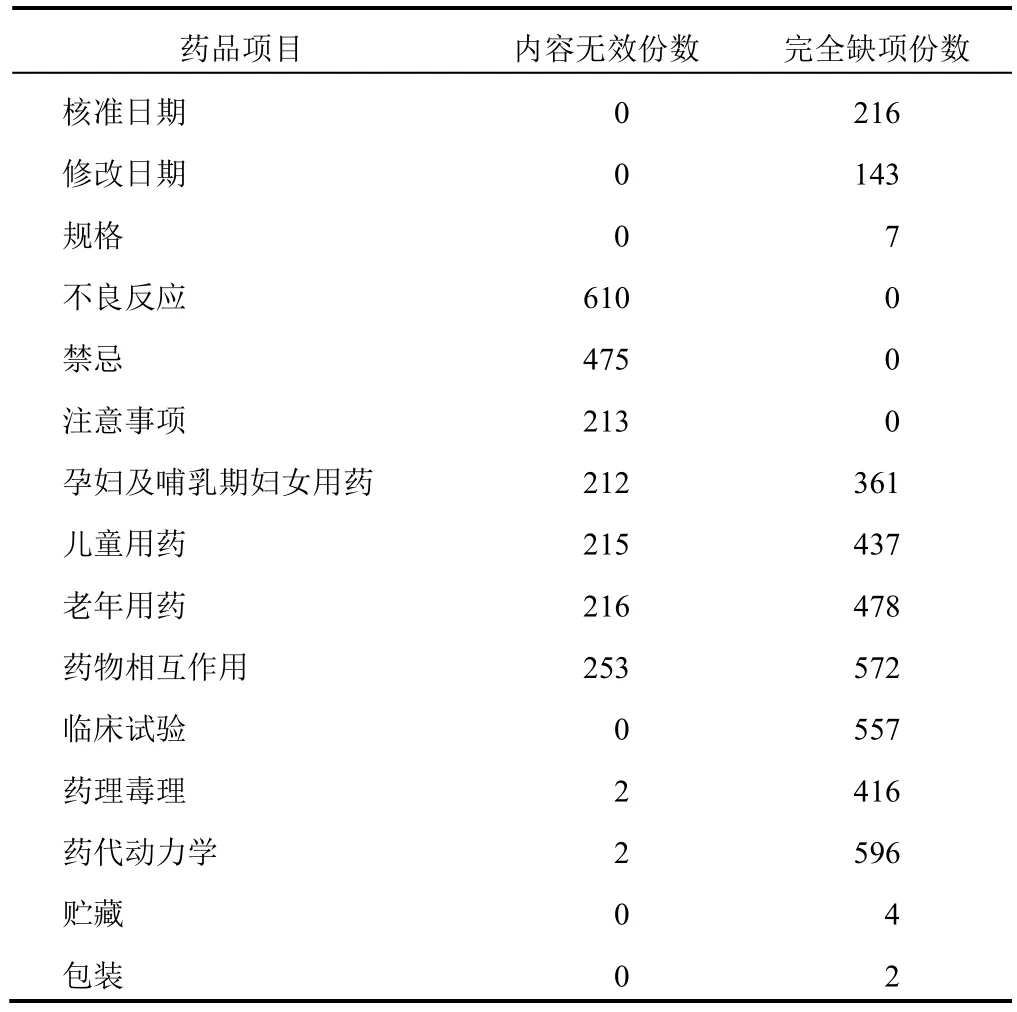
表1 846 种非注射用中成药说明书内容无效和缺项情况
2.5 内容不全
基本信息类项目的内容不全情况为:①《指导原则》规定【成份】中应列出所有处方组成和辅料(国家一级保密方除外),本研究纳入的846 种中成药有4 种为国家保密方,其余842 种中成药的说明书中631份(74.9%)缺辅料内容、55 份(6.5%)未列出全部处方组成且缺辅料内容。②《指导原则》规定【性状】应描述药品外形、颜色、气、味,但38.9%说明书缺气,10.3%缺味,4.3%缺气和味,0.7%同时缺外形、气和味。③57.1%说明书【包装】项目中缺包装材料内容。④【生产企业】项目中,13.8%说明书缺网址,6.7%缺注册地址,22.7%同时缺注册地址和网址。
用药指导项目的内容不全情况为:①16 份(1.9%)说明书【功能主治】缺少以中医辨证用药角度描述的“功能”内容。②《指导原则》规定【用法】需至少包含给药途径、方式和时间等基本内容,【用量】需提供剂量和疗程内容,纳入说明书【用法】中23 份(2.8%)缺给药方式、14 份(1.7%)缺给药途径、223 份(26.4%)同时缺给药方式和时间、83 份(9.8%)同时缺给药途径和时间,【用量】项目中81.3%说明书缺疗程内容。
此外,183 份有【药理毒理】内容的说明书中,170 份(92.9%)缺毒理内容。见表2。
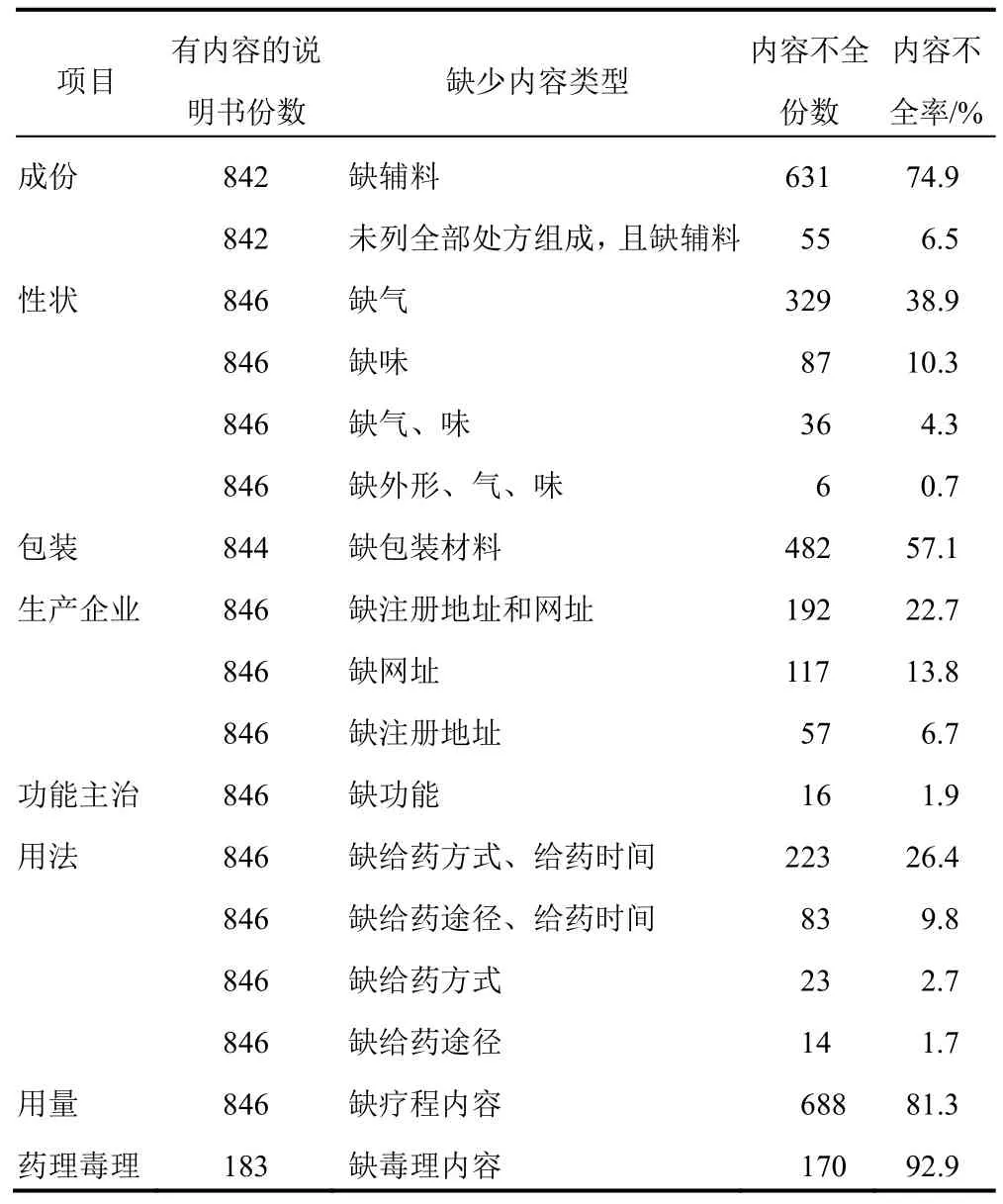
表2 846 种非注射用中成药说明书内容不全情况
3 讨论
3.1 说明书存在问题
本研究显示,当前非注射用中成药说明书的不足之处主要有四方面。①缺乏安全性信息:集中表现在【不良反应】【禁忌】和【药物相互作用】等完全缺项率高或仅填充“尚不明确”“请遵医嘱”和“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师”等无效信息,对医师和患者的合理用药均无实质指导作用[9,12-13]。②处方药缺乏药理毒理和临床研究信息:【药代动力学】【临床试验】和【药物相互作用】缺项+无效率在90%以上,【药理毒理】【老年用药】【儿童用药】和【孕妇及哺乳期妇女用药】缺项+无效率均大于60%。③处方药特殊人群用药信息位置混乱:《指导原则》明确规定了处方药说明书需单列【孕妇及哺乳期妇女用药】【儿童用药】和【老年用药】项目,但仍有约半数处方药说明书将相关内容写进【注意事项】项目中。④部分项目信息不全:【成份】【性状】【包装】【功能主治】【用法】【用量】【药理毒理】【生产企业】等均有一定比例说明书未提供完整信息。
3.2 说明书存在问题的原因
导致非注射用中成药说明书内容欠完善的主要原因为当前政策法规尚未严格规定说明书编撰和内容来源标准。因历史原因,早期非注射用中成药上市无需严格开展疗效和安全性评价,故《指导原则》允许对【孕妇及哺乳期妇女用药】【儿童用药】【老年用药】【药物相互作用】【临床试验】【药理毒理】和【药代动力学】7 项标示“如未进行该项相关研究,可不列此项”及对【不良反应】【禁忌】和【注意事项】3 项标示“尚不明确”。因规定宽松,药企无需耗费大量资金开展相关临床研究,导致说明书无可引之证。但这些说明书内容是医生和患者获取循证医学证据的主要来源,缺项可能直接造成对症不准确、特殊人群用量错误和引发不良反应等问题。
对于【不良反应】等安全性项目,即使有第三方证据,药企也可能因利益冲突或信息滞后而未能及时更新说明书内容。如2014 年张小巧[14]报告了21 例脑心通胶囊相关不良反应,包括11 例胃痛、6 例恶心呕吐、3 例食欲不振和1 例嗜睡,但该药2015 年更新的说明书中【不良反应】仍为“尚不明确”;2009 年张碧华等[15]报告17 例西黄丸相关皮疹、瘙痒、过敏等不良反应,但2016 年版的西黄丸说明书中【不良反应】也为“尚不明确”。
3.3 说明书修改完善建议
尽管注射和非注射用处方中成药说明书制定均以《指导原则》为标准,但与现有注射剂说明书的调查结果比较[16],本研究结果中非注射用中成药说明书【药物相互作用】【药理毒理】【老年用药】【儿童用药】【孕妇及哺乳期妇女用药】等项目完全缺项率高于注射剂说明书。该差异的根本原因是药监部门更重视中药注射剂的临床证据生产和不良事件监测,并出台了规范中药注射剂说明书内容的系列政策法规。因此,非注射用中成药说明书内容的进一步规范也需依靠药监部门的法规政策建设。基于本研究结果,笔者从法规政策层面提出以下非注射用中成药说明书的修订完善建议。
第一,建议药监部门全面制定非注射用中成药说明书各项目报告规范,要求药企提供当前可得最佳证据信息,并定期更新。证据可源自研究文献和药监部门监测数据等。对于大多数中成药,当前药理毒理和临床研究水平不足以支撑中成药说明书的全部内容。因此,若当前尚无相关证据,可由药监部门责令药企出资、由权威第三方评价机构开展上市后药理毒理和临床研究评价。
第二,因非处方药发生安全性问题的可能性小,当前法规政策对非处方药要求相对宽松。但非处方药使用体量庞大,不良反应真实发生数未必少,故医生患者仍有从说明书中获得详尽药理机制、疗效和安全性信息的需求。因此,建议同处方药一样,要求非处方药将【不良反应】【禁忌】【注意事项】【特殊人群用药】【临床试验】【药理毒理】等安全性项目内容作为强制修订完善内容。此外,因绝大部分中成药成分复杂,无法开展药代动力学研究,【药代动力学】项目不符合中成药特色,可不做要求。
第三,虽然国家食品药品监督管理总局在2017年连续发布《中成药规格表述技术指导原则》和《中成药通用名称命名技术指导原则》等中成药说明书内容规范法规文件,但本研究结果显示,目前非注射用中成药说明书的多项基本信息仍存在内容不全情况。尤其是部分说明书【成份】未列出所有主料和辅料、【功能主治】缺乏从中医角度描述药品功能等问题可能影响正确用药。《指导原则》对上述项目的编制细节已有详细规定,故内容不全的原因是药企未按规定严格执行。因此,建议药监部门加强对说明书细节信息的审核,督促药企补充完善所有细节信息。
4 结语
现有非注射用中成药说明书制定标准已落后于中成药快速发展现状,进一步完善势在必行。新标准的制定可借鉴化学药品经验,重视对高级别证据的要求,并充分考虑中医药诊疗特点和我国实际医疗和社会环境,实行种类和风险的分类分级管理,逐步推进完善和执行。完善说明书内容将促进提高非注射用中成药的疗效和安全性,助推我国构建中西医并重、中西药并用的大健康服务体系。

