口服间变性淋巴瘤激酶抑制剂X-396对脓毒症病死率和血浆炎症因子表达影响的实验研究
杜 娟,文大林,唐 昊,张华才,陆红祥,蒋建新
(陆军军医大学大坪医院战创伤医学中心,创伤、烧伤与复合伤国家重点实验室,重庆 400042)
脓毒症是感染、烧/创伤、休克等危重患者常见的严重并发症之一,进一步可发展为脓毒症休克、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。脓毒症具有高发生率和高病死率的特点,是当今严重战创伤和危重病患者的主要死因[1-4]。脓毒症的发病机制是病原微生物入侵,引发天然免疫细胞释放免疫化学物质,从而触发促炎或抗炎反应,引起器官功能的障碍,甚至死亡。因此,利用药物抑制的方法,调控脓毒症中主要免疫反应的关键炎症调节因子,可能成为一种有效的治疗脓毒症的手段。
有研究报道,某些抗肿瘤的药物对脓毒症的治疗有较好的效果。2017年,Zeng等[5]通过多种人、鼠的细胞研究结果,发现间变性淋巴瘤激酶(ALK)可直接结合表皮生长因子受体(epithelial growth factor receptor,EGFR),进而通过蛋白激酶B(AKT)活化干扰素基因刺激蛋白(stimulator of interferon genes,STING)通路,而ALK的特异性抑制剂—色瑞替尼,可以抑制由STING通路产生的干扰素(interferons,IFNs)介导的免疫应答,从而降低脓毒症小鼠的病死率,提示色瑞替尼是一种潜在的有效治疗脓毒症的药物。
本研究拟采用的X-396,又名恩萨替尼(Ensartinib),是新开发的一种间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、细胞间质-上皮细胞转化因子(cellular-mesenchymal to epithelial transition factor,c-Met)等的多靶点二代抑制剂,它是一种于氨基吡啶嗪的小分子,对ALK具有潜在抑制能力[6-8]。因此,本文拟探讨X-396对脓毒症小鼠的保护作用,为临床治疗脓毒症提供新的治疗思路,并奠定研究基础。
材料与方法
1 主要试剂与仪器
X-396(Ensartinib,恩萨替尼,贝达药业股份有限公司); 肿瘤坏死因子-α(TNF-α)ELISA试剂盒(DTA00D,美国R&D公司); 干扰素-β(INF-β)ELISA试剂盒(DIFNB0,美国R&D公司); 白介素-7(IL-7)ELISA试剂盒; 小动物气体麻醉机(VMR,美国Matrx公司); 独立通气笼(IVC)动物饲养系统(上海天焕科技发展有限公司)。
2 动物模型建立与分组
SPF级C57小鼠157只,体重20~25g,购自北京华阜康生物科技股份有限公司[动物许可证:SCXK(京)2014-0004]。在超净台中进行模型的建立,术中严格无菌操作。切开腹部,找出盲肠端,尽量使粪便分布均匀,盲肠充盈度为厚度0.35~0.4cm,结扎盲肠端1cm长度,结扎后用16G针垂直穿透盲肠1孔,随后将盲肠放回腹腔。缝合腹部切口。之后将模型动物放回IVC动物饲养系统,2只/笼,给予充分食物及饮水,相对湿度40%~70%,光照12h明暗交替,室温20~23℃。按照随机数字法分为对照组和治疗组。治疗组按照给药方式和给药剂量分为:口服组1(10mg/kg)、口服组2(20mg/kg)、腹腔组(10mg/kg)、静脉组(10mg/kg)。实验前禁食12h,不禁水。治疗组于伤后2、24、48、72h,4、5、6、7d根据不同的分组方式每天给予X-396药物1次,对照组以灌胃的方式口服等量对照溶剂。
3 主要检测指标
3.1病死率:模型制作后,伤后0~48h,每2h观察一次动物死亡情况并记录; 伤后48~96h,每3h观察一次动物死亡情况并记录;伤后5~7d,每12h观察1次动物死亡情况并记录。
3.2肺、肾、肝组织HE染色:伤后第3天,分别取对照组和口服组1(X-396 10mg/kg)的小鼠左肺、左肾、肝右叶,依次进行4%多聚甲醛固定,脱水包埋,切片进行HE染色后,光镜下观察各组织病理变化情况。
3.3细胞因子检测:静脉采集30例健康人外周血2mL。将每例血标本分成2组,分别为脂多糖(LPS)刺激组(1mL)、LPS刺激+X-396组(1mL)。刺激浓度LPS 为100ng/mL,X-396 为10μM,37°C,刺激16h。刺激结束后经1 000rpm,离心10min。吸取上层血浆,分装为60μL/管保存于-80°C。应用二喹啉甲酸(BCA)法测定外周血总蛋白含量(具体步骤参照试剂盒说明书),应用双抗体夹心ELISA试剂盒检测TNF-α、INF-β、IL-7浓度。
4 统计学分析
结 果
1 口服10mg/kg的X-396对脓毒症有明显保护作用
口服药物X-396对小鼠CLP模型病死率具有显著保护效果(P<0.01)。两组在12h内均无动物死亡,口服组1病死率在24h~7d的各个时间点均显著低于对照组,说明X-396能够显著降低脓毒症小鼠的病死率。两组的死亡高峰均集中在24~48h。见表1、图1。
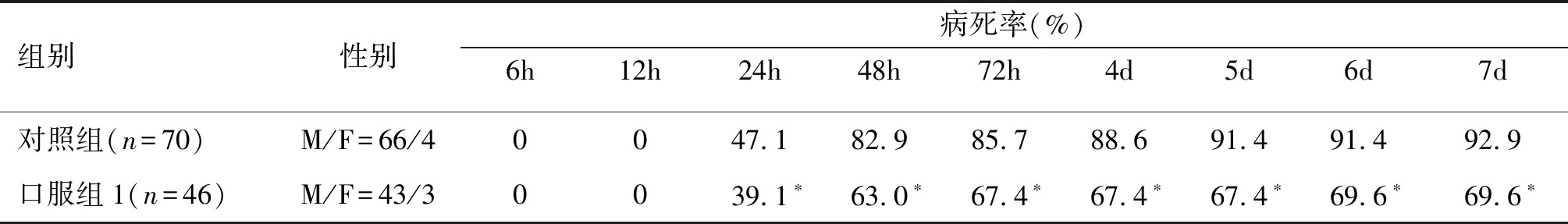
表1 对照组和X-396组病死率比较
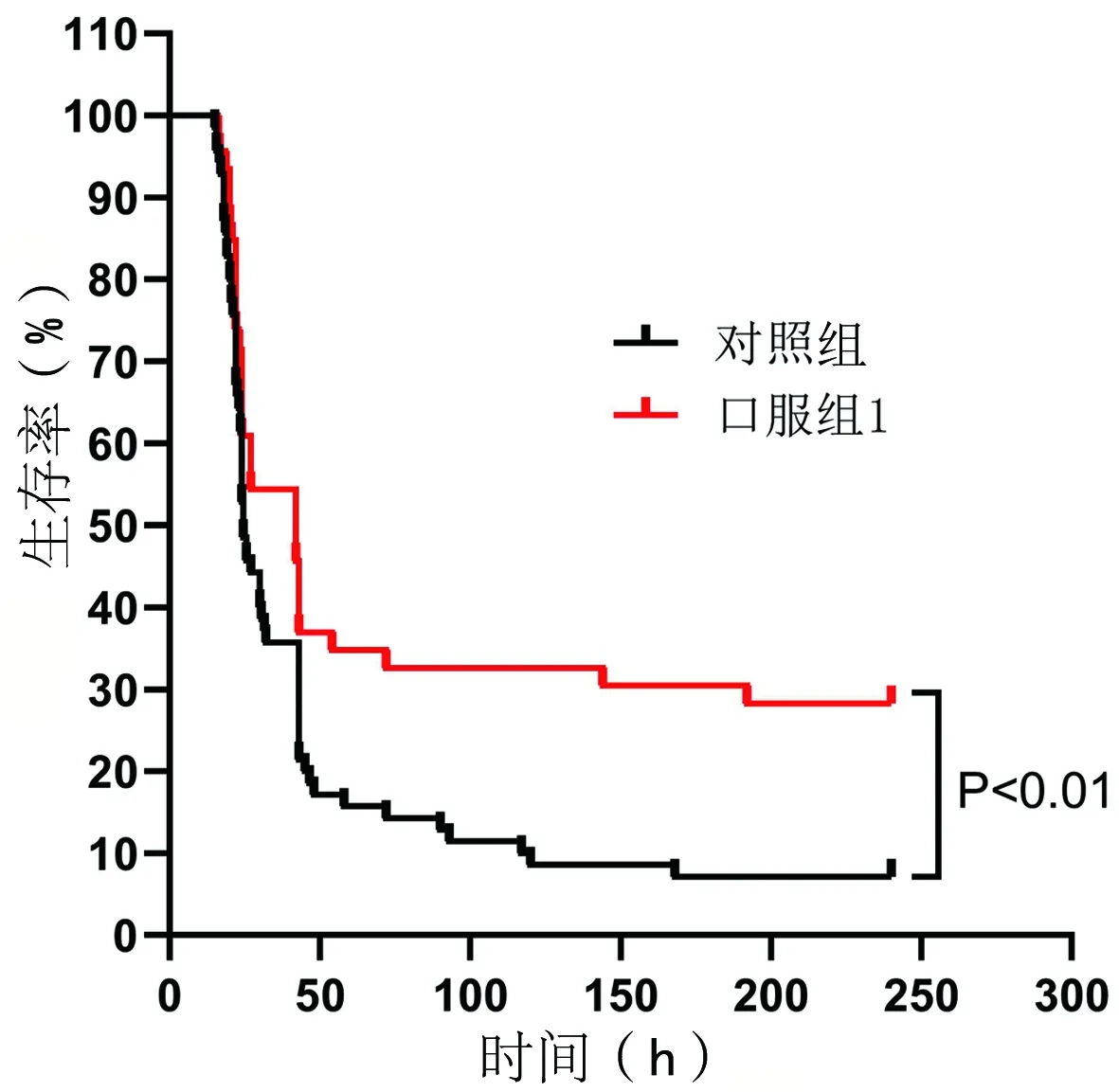
图1 对照组和口服组Kaplan-Meier生存曲线
口服X-396的给药途径,对小鼠病死率的保护效果最佳。在CLP模型的基础上,笔者进行了3种给药途径的比较,结果表明:口服组1的病死率在24h~7d的各个时间点均显著低于对照组; 腹腔组的死亡高峰集中在24h和48h两个时间点,各时间点的病死率与对照组差异不明显; 静脉组在24h就出现死亡高峰,且4d的病死率达到100%。结果表明,口服X-396是降低小鼠脓毒症病死率的最佳途径。见表2、图2。
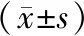
表2 10mg/kg剂量下不同给药途径病死率比较
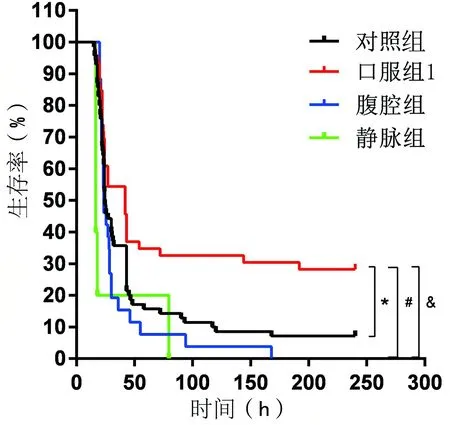
*P<0.05; #P<0.05; &P<0.05
10mg/kg和20mg/kg的给药剂量相比,二者差异不明显。在前期的研究基础之上,笔者分别对两组CLP小鼠模型进行10mg/kg和20mg/kg的口服X-396治疗,实验结果表明,两种剂量对CLP小鼠的病死率均有保护效应,在24h~7d的各个时间点均显著低于对照组。但两组之间的保护效果差异并不明显,提示口服X-396的较佳计量为10mg/kg。见表3、图3。

表3 不同给药剂量病死率比较
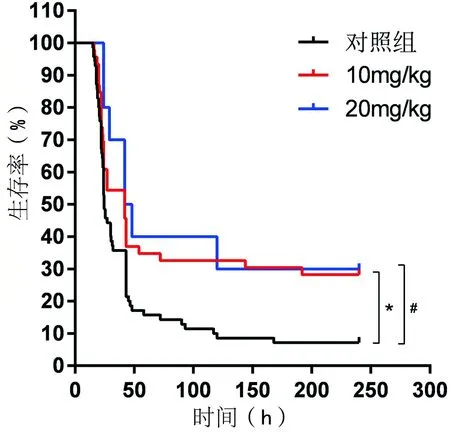
*P<0.05,#P<0.05
2 X-396处理对各组织病理变化的影响
肺组织病理切片显示,对照组为中度炎症及弥漫性肺水肿,肺间隔明显增宽,X-396组为轻度炎症及轻度肺水肿。肾脏病理切片显示:与对照组比较,X-396组炎症反应和肾小管水肿有所减轻; 肝脏病理切片显示:对照组肝小叶、肝窦结构消失,肝细胞肿胀,伴有肝细胞变性坏死,X-396组肝组织结构正常,部分干细胞轻度肿胀,肝小叶结构可见。见图4。
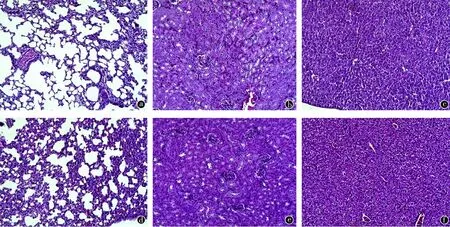
图4 治疗组与对照组肺、肾、肝病理切片比较(HE×200)。a.X-396口服组1第3天的肺轻度炎症和水肿; b.对照组第3天的肺间隔明显增宽,水肿增加; c.X-396口服组1第3天的肾脏肾小管轻度水肿; d.对照组第3天的肾脏肾小管明显水肿; e.X-396口服组1第3天的肝脏肝组织结构正常; f.对照组第3天的肝脏肝窦结构消失,肝细胞肿胀
3 X-396处理后人外周血肿瘤坏死因子-α(TNF-α)、干扰素-β(INF-β)、白介素-7(IL-7)水平检测
(1)TNF-α水平:经X-396处理后,外周血TNF-α的表达水平较单纯LPS处理组明显降低[(1091.6±240.2)pg/mLvs. (1590.0±638.5)pg/mL,P<0.01,图5a]。(2)INF-β水平:X-396处理后,外周血INF-β的表达较单纯LPS处理组明显降低[(29.0±8.2)pg/mLvs. (41.8±12.8)pg/mL,P<0.05,图5b]。(3)IL-7水平:经X-396处理后,外周血IL-7的表达水平较单纯LPS处理组明显降低[(5.04±1.11)pg/mLvs. (6.72±1.79)pg/mL,P<0.05,图5c]。提示X-396可以显著降低炎症反应水平,从而对脓毒症起保护作用。

*P<0.05
讨 论
脓毒症的发病机制主要是由于微生物——特别是革兰氏阴性菌入侵机体,刺激机体产生一系列模式识别受体(spattern recognition receptors,PRR),从而激活了自身的天然免疫系统。不同的天然免疫细胞释放多种化学物质如细胞因子、炎症趋化因子、生长因子,这些物质进一步触发促炎和抗炎的免疫反应,而促炎和抗炎的失衡又会导致器官功能障碍、器官损害,甚至死亡[9]。因此,寻找调控脓毒症中主要免疫反应的关键炎症调节因子,探寻维持天然免疫反应平衡的途径,对脓毒症的治疗至关重要。
前期研究发现ALK是天然免疫蛋白STING的上游调节因子,利用ALK的抑制剂色瑞替尼可以抑制ALK-STING通路的活化,从而抑制宿主对炎症的过度反应,提高对脓毒症的抗性[5,10]。本研究在体实验结果提示,X-396可以降低脓毒症小鼠模型的病死率,故推测X-396可能通过抑制ALK-STING通路的活化,纠正了宿主对感染的过度反应,使小鼠对脓毒症和感染性休克具有更强的抵抗力,提示ALK抑制剂有望成为治疗人类脓毒症的有效手段。
IFN-β、TNF-α以及IL-7均是脓毒症感染的下游炎症因子,IL-7是一种具有免疫效应的淋巴因子,能促进干扰素、肿瘤坏死因子等促炎细胞因子的分泌[11]。TNF-α由包括巨噬细胞在内的多种细胞产生,是一个重要多效细胞因子,在调节免疫反应中可作为促炎因子,启动一系列促炎反应,系统内高水平的TNF-α可导致脓毒症休克[12]。INF-β是一种由天然免疫细胞产生的细胞因子,属于I型干扰素蛋白家族成员,在细菌感染和LPS刺激模型中,I型干扰素蛋白可促进脓毒症休克的发展进程。有研究报道,TNF-β的表达可以增强促炎反应,并扩大LPS引起的内毒素休克[13]。在脓毒症体外实验中,笔者发现,经过ALK的抑制剂处理之后,各促炎因子表达水平明显降低,提示过度的免疫反应得到调节。各组织的病理结果也显示,经过X-396处理后,脓毒症小鼠的肺脏、肾脏、肝脏组织的炎症情况得到明显改善,因此,利用药物阻断ALK-STING信号通路,可能调节了脓毒症的过度炎症反应。
综上所述,本研究发现抑制ALK的活化可以抑制STING通路及其下游促炎因子的过度表达,控制炎症瀑布放大效应,从而降低脓毒症的病死率。但ALK是否直接作用于STING,以及ALK下游的关键调节网络尚未阐明,本研究仅为进一步研究ALK的调控机制及临床应用奠定一定的研究基础。