黑木耳菌株农艺性状评价与遗传差异分析
宋吉玲,陆 娜,闫 静,亢学平,黄小苏,周小华
(1 杭州市农业科学研究院,浙江 杭州 310024;2 延边朝鲜族自治州农业科学院,吉林 延吉 133001;3 桐庐县农业技术推广中心,浙江 桐庐 311500)
黑木耳隶属木耳目木耳科木耳属,俗称云耳、细木耳[1],其子实体富含蛋白质、粗纤维、碳水化合物及人体必需氨基酸,具有降血脂[2]、抗炎[3]、抗病毒[4]、抗肿瘤[5]、抗氧化和延缓衰老[6]等多种功效。
黑木耳作为我国三大食用菌栽培品种之一,其年产量仅次于平菇和香菇[7]。随着“北耳南扩”[8]产业的发展,浙江、福建等南方地区袋栽黑木耳“全日光间歇喷雾栽培模式”得到了快速发展,形成了一定的产业规模[9]。而南方市场上的黑木耳菌株大多是从东北引进的,同名异物和同物异名的现象频发,同时由于菌种扩繁的不规范,常常造成菌种质量、产量和抗性差的情况出现,严重制约了黑木耳产业的可持续发展。而且由于南北气候条件差异较大,北方选育的黑木耳品种不一定适应南方高热高湿的气候条件,经常会出现耳片大、颜色偏黄、产量低的现象。因此为了更好地鉴别黑木耳种质资源之间的遗传差异,并筛选出适合南方地区栽培的优质高产黑木耳菌株,从分子生物学和传统农艺性状方面对不同来源的黑木耳菌株进行评价分析就显得尤为重要[10-13]。目前关于黑木耳品种筛选评价方面的研究报道较多,杜萍等[14]通过对16个黑木耳菌株的菌丝生长速度、长势、栽培农艺性状和产量进行测定,筛选出6个优质高产黑木耳菌株;郭晓帆等[15]通过比较5个黑木耳菌株在母种、原种和栽培种培养基上的菌丝生长情况、栽培及产量性状等,筛选出朵型好、颜色黑,出耳快、齐,产量高的优质菌株Au29;郑素月等[16]对北方地区19个黑木耳菌株的菌丝和出耳性状进行比较分析,筛选出适宜河北地区栽培的4个优质高产黑木耳菌株(野森一代、黑丹一代、黑山和黑耳厚)。以上研究多注重从子实体商品性和产量方面对黑木耳菌株进行评价分析,而对菌丝生长情况、子实体农艺性状与产量之间相关性的研究相对较少。为此,本研究通过ISSR技术对15个黑木耳菌株的亲缘关系进行分析,同时结合菌丝生长速度、产量和子实体农艺性状,筛选出适合南方地区栽培的优质高产黑木耳菌株,并对其农艺性状与产量间的相关性进行分析,旨在为优质黑木耳种源选育和精准化栽培提供参考。
1 材料与方法
1.1 供试菌株
供试菌株共15个,均为杭州市农业科学研究院选育、收集、保藏的菌株,详细情况见表1。
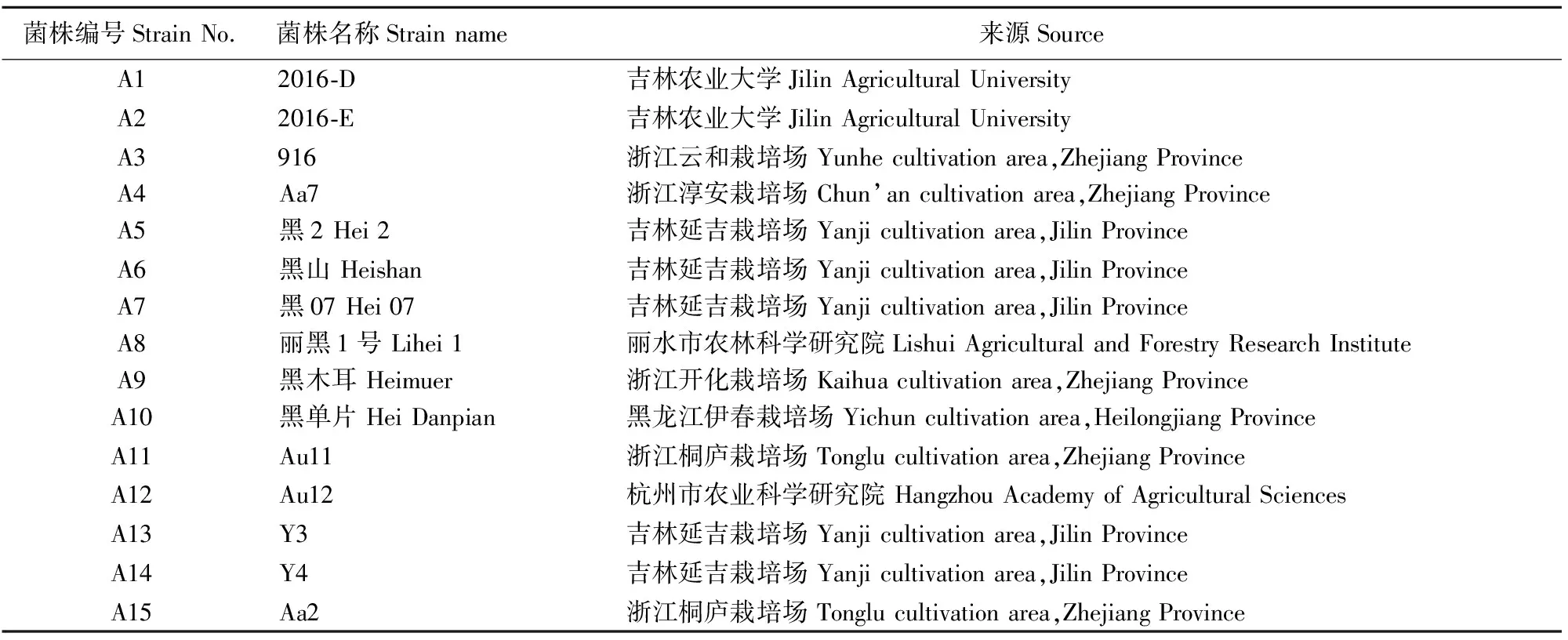
表1 15个供试黑木耳菌株的信息
1.2 培养基及培养方法
母种培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水1 000 mL。
原种培养基:木屑83%,麸皮15%,石灰1%,石膏1%,含水量为55%~60%。
栽培种培养基:木屑88%,麸皮10%,石灰1%,石膏1%,含水量约为60%。
按栽培黑木耳的常规方法生产菌棒,使用15 cm×55 cm×0.05 mm的聚乙烯栽培袋装袋,每个菌株接种150棒,设3个重复,菌棒接种后置于25 ℃条件下培养,待菌丝成熟后按常规方法进行出耳管理。
1.3 ISSR引物
从美国哥伦比亚大学(UBC)公布的100条ISSR通用引物中筛选出多态性高、扩增条带清晰、重复性好的11条引物,委托杭州擎科生物公司合成。引物信息详见有2。
1.4 黑木耳菌丝体的培养
从PDA平板上培养3 d的菌落边缘取2 mm×2 mm的菌丝块,接种于100 mL PDA液体培养基中,25 ℃浅层静置培养10 d,收集菌丝,无菌水漂洗2次,无菌滤纸吸干水分,-80 ℃保存备用。
1.5 黑木耳遗传差异分析
1.5.1 黑木耳基因组DNA的提取及检测 供试15个黑木耳菌株基因组DNA参照新型快速植物基因组DNA提取试剂(BioTeke,北京)的说明提取,提取后测定DNA的浓度,并经1.5%琼脂糖凝胶电泳检测,于-20 ℃保存备用[17]。
1.5.2 ISSR多态性分析 ISSR-PCR扩增反应在TC-XP型PCR仪(博日科技有限公司Bioer,杭州)上进行。ISSR-PCR扩增体系为:2×TSINGKE PCR Master(blue)预混体系10 μL,ISSR引物1 μL,DNA模板(20 ng/μL)3 μL,用ddH2O补齐到20 μL。反应条件:94 ℃预变性5 min;94 ℃ 30 s,适当温度退火(退火温度视引物而定,具体见表2)30 s,72 ℃ 90 s,35个循环;72 ℃ 7 min,16 ℃保存。PCR扩增产物用1.5%琼脂糖凝胶(EB染色)电泳检测,150 V电泳30 min。采用Chemi Doc XRS imaging system(Bio-Rad,Hercules,CA,USA)对扩增图谱进行拍照,有ISSR谱带标记为1,无ISSR谱带标记为0,构建初始数据矩阵。用NTSYSpc 2.1软件计算遗传相关系数,采用平均连锁法(UPGMA)进行聚类分析,得到聚类图谱。

表2 11条ISSR引物序列及退火温度
1.6 黑木耳农艺性状的观测
记录不同黑木耳菌株菌丝生长速度、菌丝长势、现耳芽时间、出耳整齐度、耳片形状、耳脉情况、耳片颜色等性状,并测定耳片长度、宽度、厚度和产量等指标[18]。其中菌丝生长速度每隔5 d测量1次,记录菌丝长势,计算平均生长速度。菌丝平均生长速度(cm/d)=菌丝生长长度(cm)/菌丝生长天数(d)。耳片性状选取第1潮30~50个鲜耳进行测定。耳片大小用游标卡尺“十”字形测量耳片直径,子实体颜色深浅度为黑色、黄褐色、灰褐色。
1.7 数据处理
试验数据以“平均值±标准差”表示。利用SPSS 17.0软件对试验数据进行单因素方差分析(ANOVA)和LSD检验。P<0.05和P<0.01分别为差异显著和极显著。采用Pearson相关性分析法[19]分析菌丝生长情况、子实体农艺性状与产量之间的相关性。
2 结果与分析
2.1 15个黑木耳菌株的ISSR多态性分析
利用ISSR引物对供试的15个黑木耳菌株基因进行PCR扩增,ISSR-PCR扩增图谱显示,11条ISSR引物在15个黑木耳菌株间扩增出了71条清晰、稳定的多态性片段,片段长度为200~2 000 bp。引物UBC807的ISSR-PCR扩增结果如图1所示,其他引物扩增图略。

M.DNA Marker;A1~A15.黑木耳菌株编号,见表1
2.2 15个黑木耳菌株的聚类分析
从聚类结果(图2)可以看出,A13与A14和A15之间的遗传相似水平高于0.90,A14与A15相似系数达0.97,初步确认A14和A15为同一菌株,而A13与A14和A15菌株的亲缘关系较近。在相似系数为0.50时可将15个黑木耳菌株分为2个类群。第一类群包括A1、A2、A3、A5、A6、A7、A10、A11、A12、A13、A14、A15共12个菌株;第二类群包括A4、A8和A9共3个菌株。15个黑木耳菌株的遗传相似系数变异范围为0.50~0.97,表明黑木耳遗传差异较大,遗传背景十分丰富。
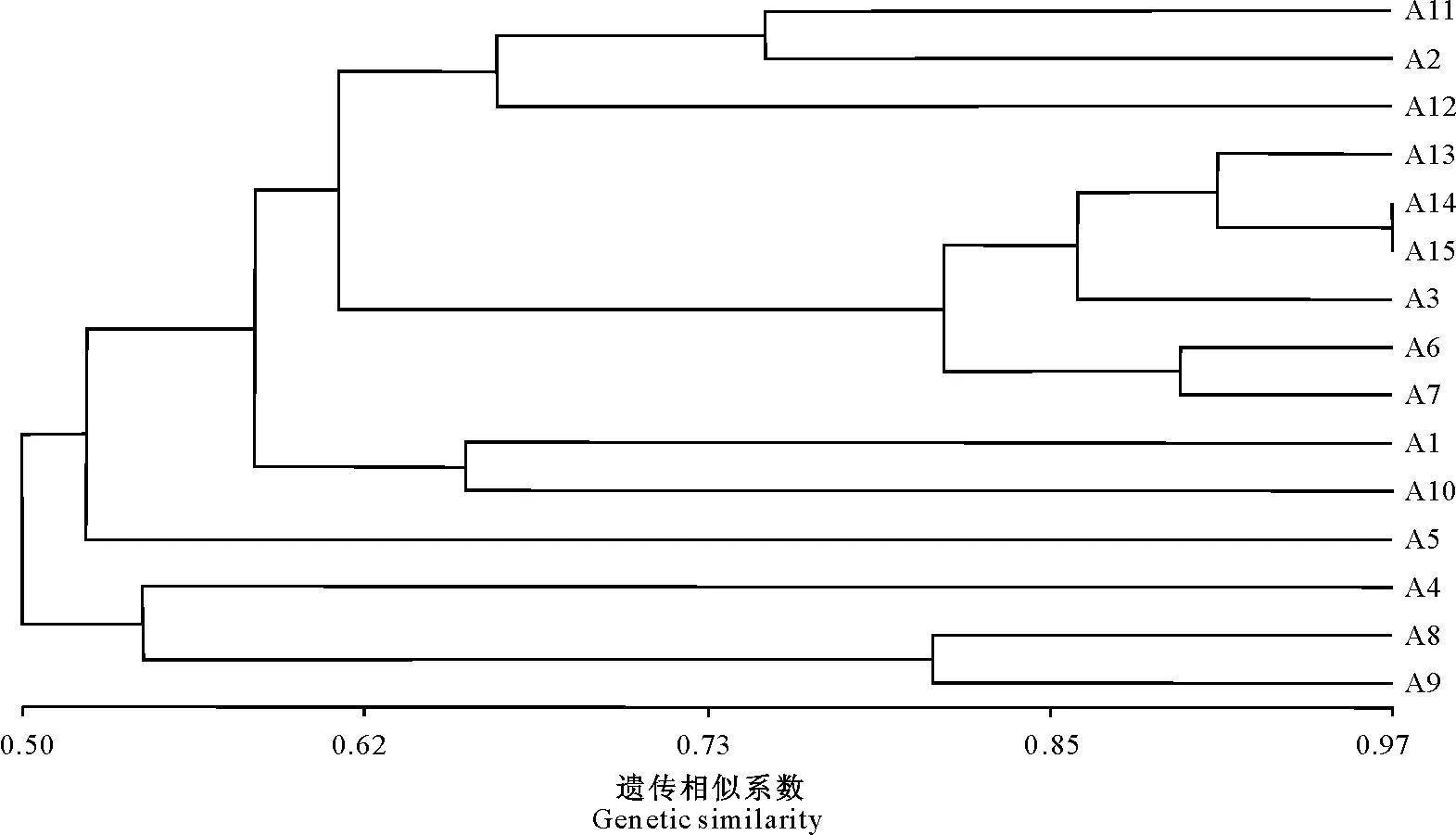
图2 15个黑木耳菌株的聚类分析结果
2.3 15个黑木耳菌株菌丝的生长情况
由表3可知,不同黑木耳菌株母种菌丝长势差异不明显,除A7菌株菌丝长势稍弱外,其余菌株均长势良好。其中A11、A12、A8和A9菌株菌丝生长较快,平均生长速度分别为0.258,0.247,0.247和0.243 cm/d;其次为A6、A14、A1、A15、A13、A10、A2、A4、A3和A7菌株;生长最慢的为A5菌株,平均生长速度为0.190 cm/d。15个黑木耳菌株整体抗杂性均表现较好,无污染现象发生。
由表3还可知,不同黑木耳菌株栽培种长势差异不明显,整体表现菌丝洁白、浓密、整齐。其中A4、A5、A3和A10菌株菌丝生长较快,平均生长速度分别为0.449,0.447,0.442和0.439 cm/d;其次为菌株A6、A7、A2、A14、A12、A1、A15、A11、A13和A9菌株;生长最慢的为A8菌株,平均生长速度仅为0.372 cm/d,与其他菌株存在显著差异。
2.4 15个黑木耳菌株的产量
由表3可知,15个黑木耳菌株中,A6、A5、A3和A4的产量较高,分别为87.55,83.24,82.36和79.45 g/棒;其次为A8、A9、A15、A10、A13和A14;A11、A12、A1、A7和A2的产量较低,分别为59.36,58.18,57.53,53.26和49.30 g/棒。因此从产量性状来看,可以淘汰产量较低的A11、A12、A1、A2和A7菌株。
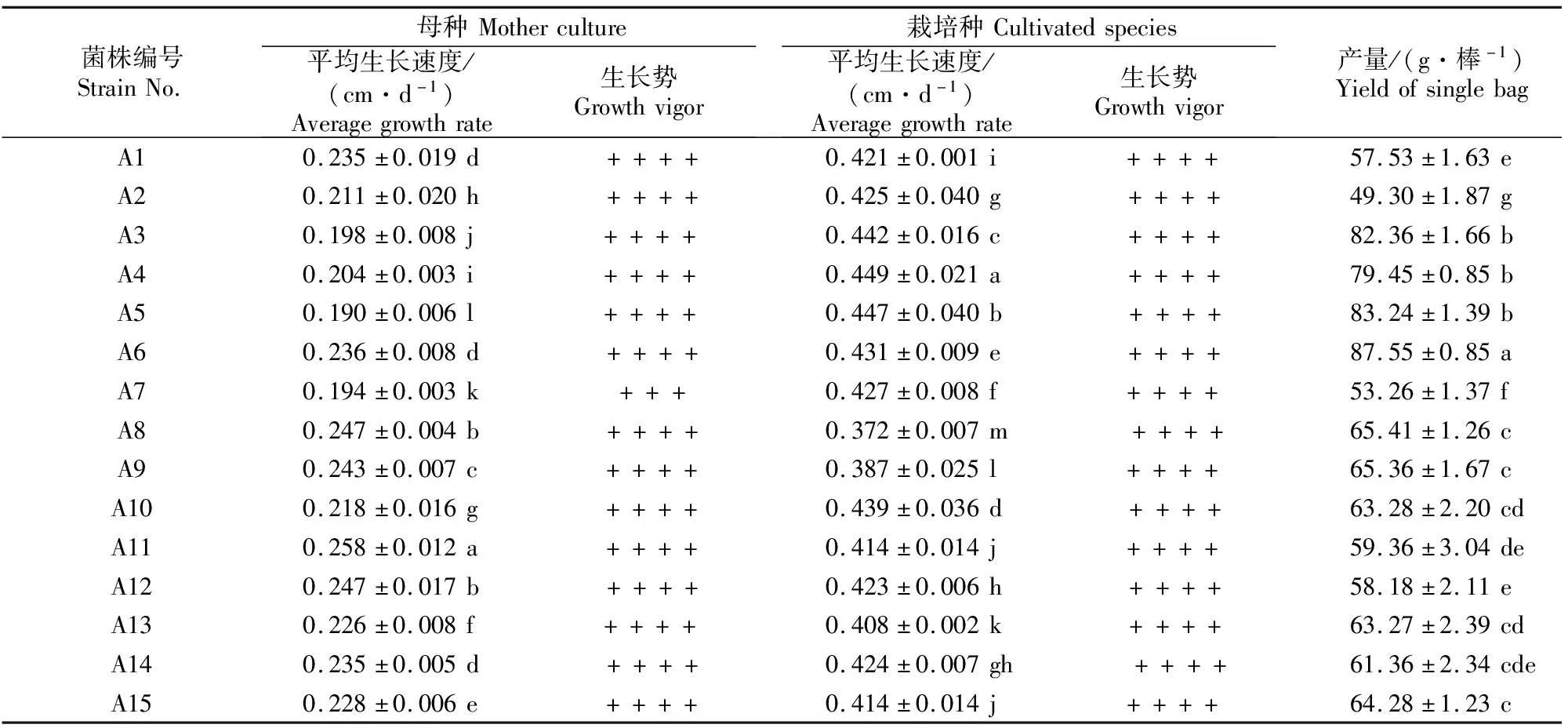
表3 15个黑木耳菌株的菌丝生长及产量情况
2.5 15个黑木耳菌株的农艺性状
由表4可知,各参试菌株打孔后现耳芽时间为20~36 d,其中A3、A4、A5、A6、A7、A8、A9、A10和A11菌株现耳芽时间最短,为20~25 d;A12和A13菌株现耳芽时间较短,均为30 d;A1、A2、A14和A15菌株现耳芽时间较长,分别为36,35,31和32 d,菌棒易脱水,培养中后期菌棒变软、长青苔、污染,因此应淘汰这4个菌株。
由表4还可知,在15个供试菌株中,耳片形状多以单片为主,少量朵状;6个菌株的耳片颜色为黑色,7个菌株为黄褐色,2个菌株为灰褐色;耳片长度为5.236~6.139 cm,宽度为4.068~4.608 cm,厚度为1.722~2.262 mm。在耳片厚度方面,A1和A6菌株耳片厚(厚度>2.0 mm),A5、A9、A10、A14和A15菌株耳片薄(厚度<1.8 mm);在耳片大小方面,A1、A3、A4、A6、A8和A9菌株耳片小(长×宽<5.40 cm×4.35 cm),A5和A14菌株耳片大(长×宽>6.0 cm×4.5 cm),其余菌株耳片大小比较适中。出耳整齐度也是影响黑木耳产量和质量的一个重要因素[20],由表4可知,除A1、A13、A14和A15菌株出耳不整齐外,其余菌株表现良好。
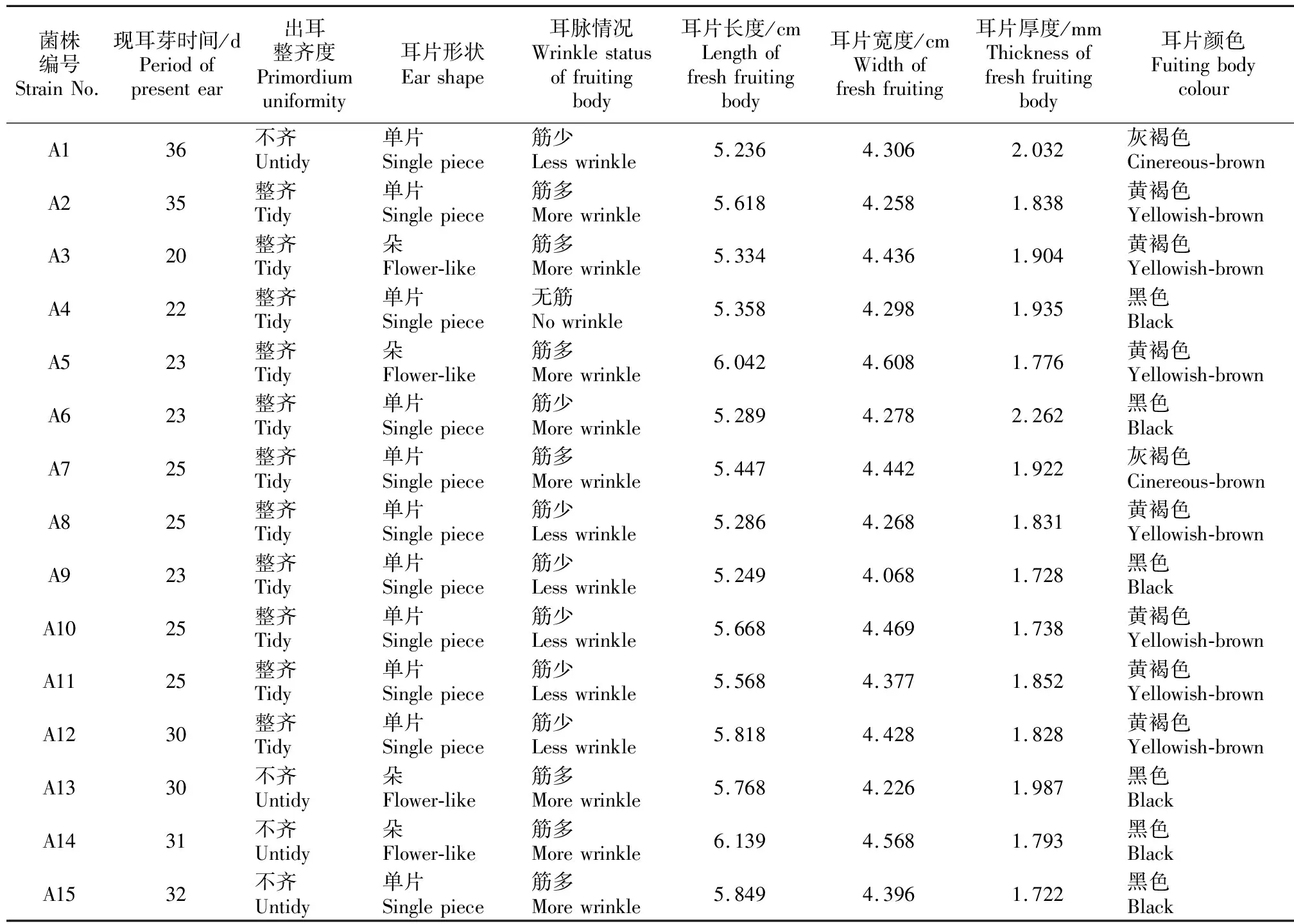
表4 15个黑木耳菌株的农艺性状分析
综合分析菌株的农艺性状可知,15个供试菌株中,A6菌株出耳快、齐,耳片颜色黑、小,产量高,适宜作为推广品种使用;A13菌株出耳不整齐,A9和A10菌株耳片薄,A1、A2、A14和A15菌株现耳芽时间长、菌棒易污染,因此这些菌株应被淘汰;在产量性状表现较好的A3、A4、A5和A8菌株中,A3、A5耳片为黄褐色、筋多,A4菌株耳片稍薄,A8耳片黄褐色、薄,因此这4个菌株不太适合栽培推广,但可作为与抗性强、商品性优良的品种进行杂交育种的亲本材料使用。
2.6 黑木耳产量与栽培及农艺性状的相关性分析
通过Pearson相关性分析发现,黑木耳产量与耳片厚度、栽培种菌丝平均生长速度具有正相关性,相关系数分别为0.347和0.383;与现耳芽时间则表现出显著负相关性,相关系数为―0.698;与耳片长度、耳片宽度和母种菌丝平均生长速度的相关性不大。

表5 黑木耳产量与栽培及农艺性状的相关性
3 讨 论
随着分子生物学技术的快速发展,分子标记技术广泛应用于作物遗传多样性研究中,而ISSR作为一种操作简单、快捷、高效的检测手段,常常用于食用菌遗传多态性分析和种内菌株亲缘关系的区分。任广明等[21]运用ISSR分子标记技术对黑龙江伊春地区的23个黑木耳主栽品种进行遗传差异分析,发现23个黑木耳菌株在相似系数为0.8时聚为3个类群,遗传背景差异不大,亲缘关系较近。而徐安然等[22]利用SSR标记对来源于全国不同地区的72份黑木耳栽培种和野生种菌株进行遗传多样性分析及分子身份证的构建,发现其遗传差异比较大,同时也发现有同物异名的现象存在。李辉平等[23]应用ISSR技术对21个栽培黑木耳进行了遗传多样性研究,结果表明我国栽培黑木耳的遗传背景十分丰富,遗传多样性很高。姚方杰等[24]基于毛木耳全基因组开发的SSR标记对27份毛木耳菌株的遗传多样性进行分析,结果表明供试菌株遗传相似系数为0.618~0.971,说明毛木耳种质资源具有丰富的遗传多样性。本研究利用ISSR分子标记技术对15个黑木耳菌株基因组DNA扩增片段进行聚类分析,发现利用ISSR分子标记技术能够将黑木耳菌株区分开来,并将15个菌株聚为2个类群,一类为来自浙江地区的菌株,另一类以东北地区菌株为主,但并未发现黑木耳菌株农艺性状与地域分布之间存在相关性。这与李黎等[25]的研究结果不同,可能与目前我国各地相互引种、菌种来源不明确有关。
农艺性状作为评价种质资源是否优良的一个重要指标,在栽培试验过程中,研究者多是以子实体商品性和产量为主要评价内容。杜萍等[14]、郭晓帆等[15]及郑素月等[16]从菌丝长势、产量、子实体商品性等方面对黑木耳菌株进行农艺性状的比较分析,筛选出适宜栽培的优良菌株。金鑫等[26]从菌丝长势、子实体农艺性状、多糖和麦角甾醇等方面筛选出适宜西南地区栽培的黑木耳品种。孙靖轩[27]通过对70个亲本菌株的产量、熟性、朵型和鲜耳腹面颜色比较分析筛选出亲缘关系较远、性状具有互补性的优良亲本黑29和黑威9号。本研究通过对黑木耳菌株的菌丝生长、子实体农艺性状和产量等指标进行综合评价分析,筛选出适合南方地区栽培的优质高产A6(黑山)菌株和适宜作为育种材料使用的A3(916)、A4(Aa7)、A5(黑2)和A8(丽黑1号)菌株。同时,本试验通过Pearson相关性分析发现,现耳芽时间与产量之间存在显著负相关关系,即现耳芽时间越短产量越高;栽培种生长速度、耳片厚度与产量之间存在一定程度的正相关性,而母种菌丝生长速度与产量之间相关性不大,因此现耳芽时间和栽培种菌丝平均生长速度可以作为衡量菌株是否高产的评价指标。在研究过程中还发现,出耳整齐度与产量之间存在一定的相关性,但两者之间具体有何种关系,还有待进一步研究。

