围护结构霉菌种类识别及生长风险研究*
同济大学 陈玉卿 高 军上海建科集团股份有限公司 章重洋 李景广
0 引言
霉菌生长是建筑围护结构的一种常见现象,世界卫生组织(WHO)的研究表明,全球约20%的房屋都存在霉菌生长问题[1]。我国建筑霉菌污染状况远高于其他国家,调查结果表明,全国超过80%的居民建筑均有不同程度的霉菌存在[2]。霉菌生长不仅会影响建筑的美观,损坏建筑结构特性,还会对室内环境和人员健康造成巨大危害[3]。美国医学研究所(IOM)的研究报告指出,室内表面的霉菌会释放挥发性有机物(微生物VOC或MVOC),这些悬浮的霉菌产物如被室内人员吸入,可引起咳嗽、哮喘等呼吸道疾病[4-5]。世界卫生组织在潮湿与霉菌危害的研究报告中指出,在美国存在潮湿和霉菌问题的家庭中,呼吸道疾病的患病率增加约30%~70%[1]。王晗等人基于横断面调查方法,发现住宅室内潮湿和霉菌问题与儿童哮喘及过敏性疾病存在显著的相关性,其中“霉点”与鼻炎之间的相关性尤为显著[6]。此外,霉菌生长还会严重影响室内空气质量,导致病态建筑综合征等疾病的发生[7]。
鉴于围护结构霉菌生长的普遍性和危害性,从20世纪60—70年代以来,国内外学者针对其生长风险预测展开了大量的研究。Ayerst[8]和Smith等人[9]基于琼脂培养法研究了温度和湿度对霉菌生长速率的影响,并给出了曲霉属菌(Aspergillus)及青霉属菌(Penicillium)等菌属生长速率随温湿度变化的等值线簇。Johansson等人以木材、石膏等建筑材料为培养基,确定了不同建材表面霉菌生长的临界含水量[10-12]。基于大量此类霉菌培养实验的结果,诸多学者开发了不同的霉菌生长预测模型,其中一些主流的生长模型如表1所示。综合分析各生长模型,可以看出多数模型均考虑了温度、相对湿度、培养基和暴露时间等影响霉菌生长的主要因素。其中,应用较为广泛的包括VTT模型和WUFI等值线模型。然而,VTT模型和WUFI等值线模型均未考虑具体菌属对围护结构霉菌生长风险的影响。而Clarke等人的研究表明,不同菌属霉菌生长所需的温湿度范围差异较大[13]。此外,VTT模型未考虑各类建材表面霉菌生长的差异性,而WUFI等值线模型也只是简单地将建材分为两大类,在实际使用中也会出现建材分类模糊,造成预测不便或预测结果与现实不符等问题。因此,对围护结构中出现的菌属进行鉴定和分析,同时建立合理的方式表征建材影响,对合理预测霉菌生长风险具有现实意义。此外,对霉菌种类的识别还有助于霉菌相关疾病的诊断和预防。
本文以上海市某居民小区为研究对象,对其中存在发霉现象的建筑围护结构进行霉菌采集,通过DNA高通量测序技术对霉菌种类进行识别,从而确定建筑围护结构中所出现的霉菌菌属。基于菌属识别结果,选择文献中对应菌属的培养数据,构建出基于文献数据的霉菌生长预测温度-湿度-生长速率等值线模型;再基于Sautour提出的最佳温度状态下霉菌生长速率与相对湿度的函数关系式[24],对上述等值线模型进行进一步修正;通过定义长霉因子来表征材料特性对霉菌生长的影响。最后,基于此模型对上海市典型围护结构的霉菌生长风险进行分析,并将结果与Sedlbauer提出的等值线模型进行对比。
1 围护结构霉菌种类识别
围护结构霉菌种类识别研究的对象为上海市某居民小区,对其中存在发霉现象的建筑围护结构进行霉菌样品采集和鉴定分析。霉菌样品现场采集的主要方法有擦拭取样、黏合取样、接触平皿取样和体积取样等,其中体积取样是在建筑材料表面进行霉菌取样的最常见方法[25]。本文采用体积取样法,以主要霉点为中心从发霉墙体表面取2 mm×2 mm的样品块(如图1所示),针对每个发霉部位取3个样品块作为1个完整样品,用塑封袋封装;标记样品编号并记录建筑年代信息;利用干冰将采集样品冷藏带回。本文共调查发霉建筑住户29户,采集霉菌样品29例,按照建筑年代分别对其进行编号,其中F、E和N分别代表50年代建筑、1979—1985年建筑及1989—1995年建筑,F、E和N类建筑霉菌样品数分别为8例、10例和11例。

图1 霉菌体积取样
本文采用DNA高通量测序技术对霉菌种类进行识别,该技术是基于特定DNA序列的分离,从而靶向特定的表型以获取微生物特征的一种生物学鉴定技术。其中霉菌的鉴定是基于真菌rDNA ITS测序技术,由于ITS序列在绝大多数真菌中表现出序列多态性,而在种内相对一致,种间差异明显,因此广泛用于真菌鉴定。通过提取霉菌样品DNA,再利用PCR(聚合酶链式反应,是一项DNA体外合成放大技术)技术扩增出真菌的ITS区序列,将所得序列与数据库进行比对,从而确定真菌种类。与传统的培养法识别相比,DNA测序技术不但能够快速灵敏地完成鉴定工作,还能够提高微生物鉴别的准确性[25-26]。
图2为29例霉菌样品种类识别的结果。可以看出,各样品霉菌识别的结果大致可分为以下几类:1)样品为某单一菌属占主导。如样品F006、F007、E003、E007、N001、N010中,芽枝霉属菌(Cladosporium)的相对丰度均接近100%;样品F003中,青霉属菌(Penicillium)的相对丰度接近100%;E008和N011中,曲霉属菌(Aspergillus)的相对丰度接近100%。2)样品表现为2种菌属主导。如样品E004和E005中,枝霉属菌和青霉属菌的相对丰度各占约40%~50%。3)样品中菌属成分复杂。为了便于后续建立霉菌生长风险预测模型,本文以某菌属在所有样品中出现次数不少于1/3且单个样品中相对丰度不低于10%作为标准,得出建筑围护结构生长的主要霉菌种类为芽枝霉属菌、青霉属菌和曲霉属菌。
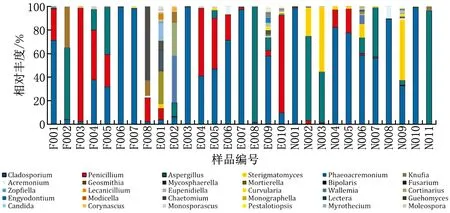
图2 霉菌种类识别结果
图3显示了不同年代建筑中3种主要菌属的平均相对丰度结果。可以看出,在3类建筑中,3种主要菌属的总相对丰度均为65%左右,其中芽枝霉属菌的相对丰度均较大,超过30%。对于F和E类建筑,芽枝霉属菌、青霉属菌和曲霉属菌的相对丰度分布类似,3种菌属分别约占35%、20%和10%。而对于N类建筑,3种菌属分别占46.5%、3.7%和16.2%。
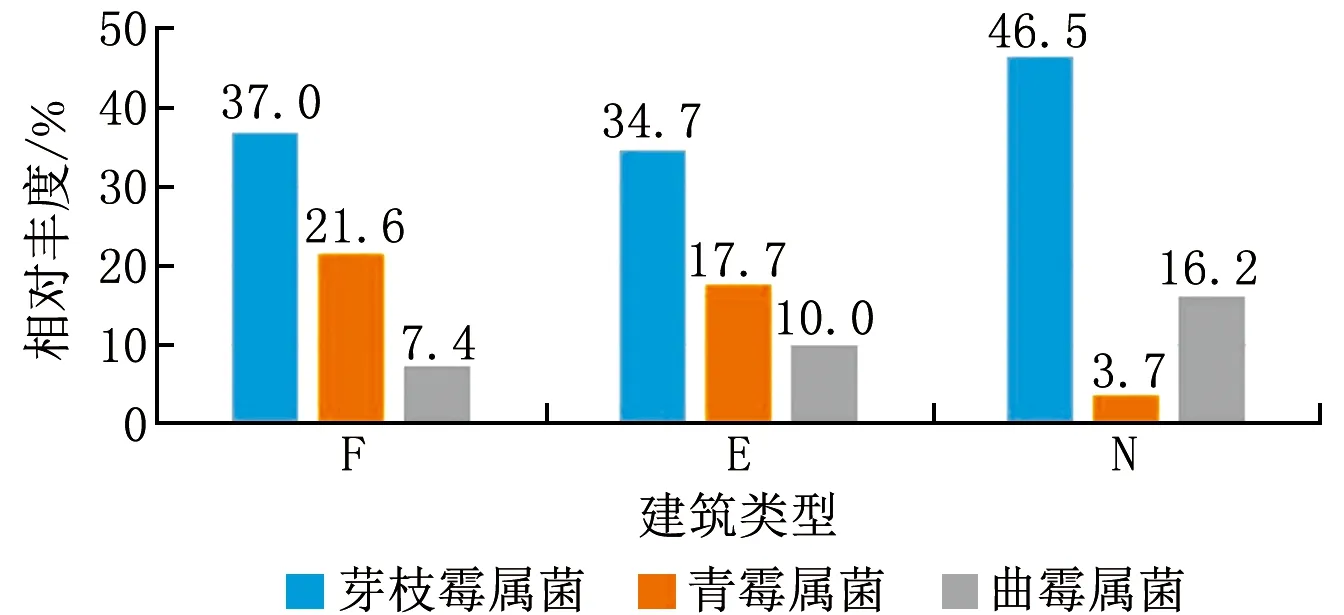
图3 3类建筑中3种主要菌属的平均相对丰度分布
2 霉菌生长风险预测等值线模型
等值线模型是霉菌生长预测的一种常用模型,其原理为:基于不同温湿度状态点下的霉菌培养数据,得出各生长速率下温湿度状态点集,形成用于霉菌生长预测的温度-湿度-生长速率等值线簇。Sedlbauer基于文献中霉菌培养数据开发的等值线模型已被纳入围护结构热湿评价软件WUFI,是目前霉菌风险评估中应用较为广泛的模型之一[18]。然而该模型存在以下不足:1) 未对围护结构中所出现的具体菌属进行识别分析,因此所采用的培养数据缺乏针对性;2) 由于该模型仅基于实验数据通过包络方法得到一系列等值线,因此对于等值线间及实验数据不涉及的温湿度区域,该模型未能给出很好的解释;3) 该模型通过将建筑材料分为两大类来考虑材料特性对霉菌生长的影响,这样的分类过于粗糙,无法表征材料特性。因此,本文首先基于围护结构霉菌识别结果选择相应的霉菌培养数据,对等值线模型进行修正;再基于最佳温度状态下霉菌生长速率与相对湿度的函数关系,对等值线间及实验数据未涉及的温湿度区域的霉菌生长进行预测分析;最后通过定义长霉因子以表征建材特性对霉菌生长的影响。
2.1 基于文献数据的等值线模型
霉菌生长可以通过多种方式来衡量,例如菌落直径、菌体干重的增加、不同类型孢子的产生速率等。先前研究表明,菌落直径的线性增长可以较好地描述不同温湿度下霉菌生长的情况。Ayerst[8]和Smith等人[9]以琼脂作为培养基,针对温度0~40 ℃、相对湿度70%~100%环境下的霉菌生长情况进行了大量的实验研究。根据霉菌识别结果,本文选择芽枝霉属菌、青霉属菌和曲霉属菌的代表性菌种(如表2所示)的培养数据作为基础,进行模型修正。

表2 3种菌属的代表性菌种
霉菌生长温度-湿度-生长速率等值线构建采用数学包络法,即在确定某一生长速率μ下的等值线时,为了防止其中任意一种霉菌的生长,以所有单个菌种温湿度等值线的最低包络线作为该生长速率下的等值线,记为LIMμ。Sedlbauer的研究表明,利用双曲余弦函数的半曲线可以较好地包络各类霉菌生长的温湿度状态实验结果(如式(1)所示)。同时,实验结果显示,不同生长速率下的霉菌生长等值线具有近似平行的特性。因此,为便于建模和模型使用,近似认为各生长速率下的等值线均相互平行。
LIMμ:φ=acosh(b(θ-θopt))+c
(1)
式中a、b、c为拟合系数;θ和θopt分别为环境温度和霉菌生长最佳温度。
对于芽枝霉属菌、青霉属菌和曲霉属菌,其θopt在20~35 ℃之间,本研究中取综合θopt等于30 ℃。由此得到生长速率μ分别为0.1、0.5、1、2、3、4 mm/d时所对应的等值线,如图4所示。表3为各生长速率下LIMμ的表达式。可以看出,对于不同菌属,其生长所需的温湿度范围在属间存在较大差异:在温度方面,芽枝霉属菌、青霉属菌生长所需的最佳温度为20~25 ℃,而曲霉属菌生长所需的最佳温度约为25~30 ℃。因此,从图4可以看出,LIMμ在0~20 ℃时的边界主要受到芽枝属菌和青霉属菌的限制(阴影区域1)。在相对湿度方面,曲霉属菌生长所需的最低相对湿度小于另外2种菌属,因此,曲霉属菌对LIMμ低湿边界的影响较大(阴影区域2)。图5为根据霉菌识别结果和文献中培养数据所得的等值线模型最终结果。
2.2 生长速率修正
上述基于文献数据的等值线模型在解释等值线间及实验数据未涉及的温湿度区域的霉菌生长情况时存在困难,即:1) 温湿度状态点处于μ>4 mm/d和μ<0.1 mm/d时,无法根据既有等值线给出相应的生长速率;2) 各等值线间温湿度状态点所对应的生长速率,只能通过简单的线性插值求取,而显然图5中的等值线并非线性分布,因此插值法的合理性也值得商榷。为了解决这些问题,本文基于最佳温度状态下霉菌生长速率与相对湿度的函数关系式(如式(2)所示),对上述实验数据模型进行进一步修正。
(2)
式中μopt为霉菌生长的最大速率;φopt、φmax、φmin分别为霉菌生长所需的最佳、最大和最小相对湿度。
基于表3中的关系式,可计算出当温度θ=θopt=30 ℃时,各生长速率所对应的相对湿度,如表4所示。
基于式(2)对表4数据进行拟合,拟合结果如图6所示,得到φopt、φmax、φmin分别为97.5%、97.3%、74.2%,μopt为9.016 mm/d。可以看出,在相对湿度达到最佳值之前,生长速率随着相对湿度增大而增大,增速逐渐增大,根据拟合结果,最大生长速率可达9.016 mm/d。而当相对湿度达到某个极限值后,霉菌生长速率不再增大,反而会下降,这一结果可以解释为当相对湿度接近100%时,霉菌生长会受到阻碍,这与实际研究结果相符。需要
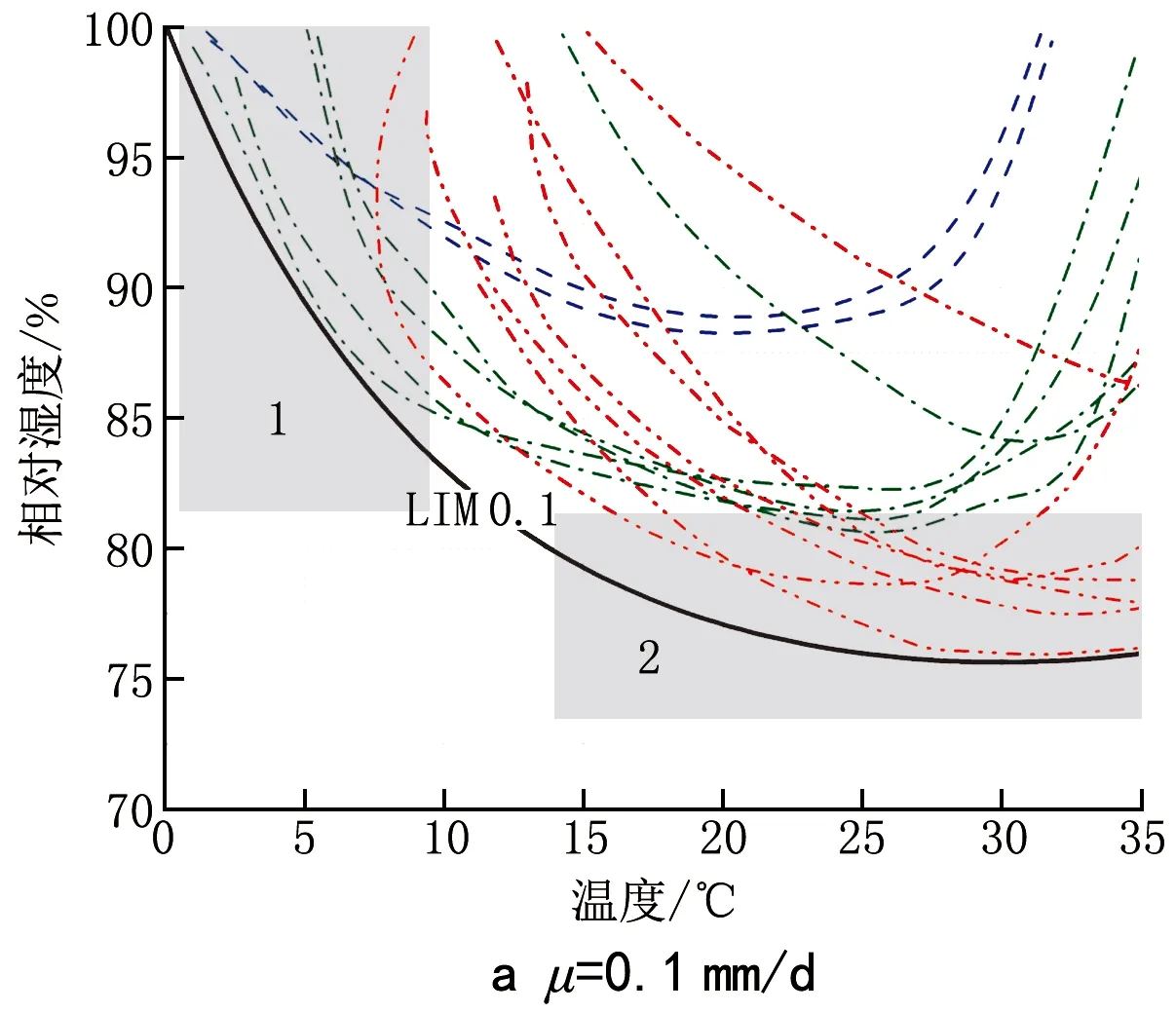
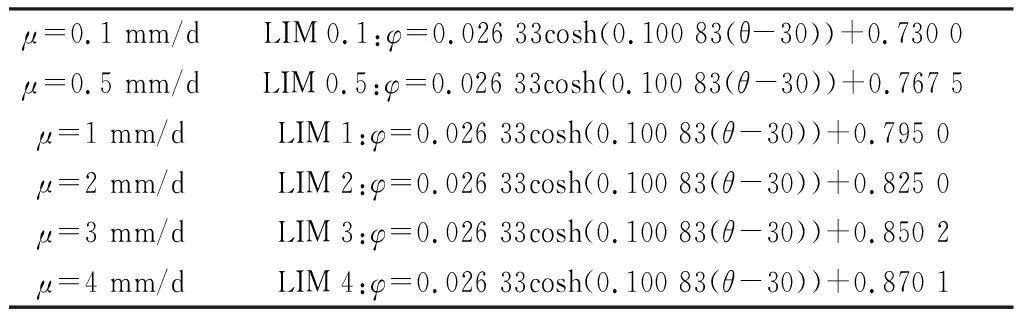
表3 各生长速率下等值线表达式
图5 基于文献数据的等值线模型
表4 最佳温度状态下各生长速率对应的相对湿度
说明的是,由于上述拟合参数是基于3个菌属综合数据所得,因此与单个菌属的拟合数据可能会存在一定偏差。但在解释整体的霉菌生长风险时,可以认为这样的拟合结果是可以接受的。
图6 生长速率拟合结果
基于拟合曲线,即可反解出最佳温度θopt状态下,对应于各生长速率的相对湿度,从而确定出修正后的等值线模型,如图7所示。其中,反解出的LIM 0可以视作霉菌生长的临界曲线,即当温湿度状态点在该曲线上方时,可能存在霉菌生长风险。LIM 0曲线为:φ=0.026 33cosh(0.100 83(θ-30))+0.715 3。在实际应用中,以某时间节点下的温湿度状态点作为输入参数,根据式(1)可求出与该温湿度状态点位于同一条等值线上(θ=θopt)的相对湿度;将该相对湿度作为式(2)的输入参数,即可求得对应的该时间节点下的生长速率;将逐时生长速率对时间求和,即可求出某个时间段内霉菌生长的指标参数,以此作为霉菌生长风险的评价依据。
图7 生长速率修正后的等值线模型
2.3 材料特性修正
上述等值线模型是基于最佳培养基(麦芽琼脂)下的霉菌培养数据所得,而在实际情况中,建筑材料所含营养物质相对较少,因此其表面的霉菌生长往往需要更高的温湿度水平。Johansson以常见建材为培养基,研究了在10 ℃和22 ℃下霉菌生长所需的临界相对湿度φcrit,如表5所示[27]。可以看出,相比于图7中的临界相对湿度,建材表面同等温度下的临界相对湿度更高。因此,为区别不同材料对于霉菌生长的影响程度,定义在某一温度下最佳培养基上霉菌生长的临界相对湿度与某一建材表面霉菌生长的临界相对湿度之比为该建材在该温度下的长霉因子Rm,θ,即
(3)
由此可以得到常见建材的长霉因子,如表5所示。可以看出,材料长霉因子根据温度不同稍有差异,但总体上差距不大。因此,可通过将最佳培养基上求得的霉菌生长速率乘以相应的长霉因子定性分析各材料间霉菌生长风险的差异。

表5 10 ℃和22 ℃时各建材表面霉菌生长的临界相对湿度[27]及长霉因子
2.4 模型误差分析
本霉菌生长预测模型基于霉菌现场采集鉴定实验结果及霉菌培养实验数据建立,同时进行了生长速率及建材种类的修正。相比于Sedlbauer提出的等值线模型,本模型更加符合我国建筑围护结构霉菌生长的实际情况,同时也提高了在等值线间温湿度状态点、不同建材表面霉菌生长等方面评价的精度和合理性。但由于在建模过程中做了相应的简化,因此本模型在以下方面存在误差:
1) 本模型主要考虑了影响霉菌生长的四大主要因素——温度、湿度、培养基及暴露时间。对于一些次要因素如pH值、光照强度等,由于其对霉菌生长的影响程度较小[18],因此本模型未予以考虑。由于最佳培养基情况下这些次要因素往往处于最理想情况,而围护结构表面的实际情况往往达不到最理想情况,因此对于这些方面的忽略使本模型具备一定的安全(无霉菌生长)余量。
2) 由于霉菌培养实验数据是基于特定的稳态温湿度工况,而实际情况下温湿度状态是动态变化的,因此本研究忽略了温湿度状态变化对霉菌生长速率的具体影响。Johansson的研究表明,温湿度状态的动态变化会在一定程度上降低霉菌生长的速率[27]。因此,这一因素的忽略同样使模型具备一定的安全余量。
3) 各材料的长霉因子是基于特定温度状态,从而定性表征不同材料对霉菌生长的影响程度,因此据其计算所得的霉菌生长量可能与实际结果存在差异,但在比较不同材料表面霉菌生长的程度时,可以认为通过该因子所得结果是有效的。如果想要定量描述某材料表面霉菌的生长量,还需要进行培养实验。
综合来说,由于忽略了部分在建模时处于最理想情况的次要因素,本模型在霉菌生长风险预测时还是相对保守的,即具备一定的安全余量。如果需要定量描述动态温湿度边界下各类建材表面霉菌生长的情况,还需要进行相应的培养分析。
3 典型围护结构霉菌生长风险分析
基于上述修正模型,对上海市典型围护结构内表面的霉菌生长风险进行分析。图8显示了一典型的外保温结构,主体材料为混凝土,保温材料为EPS,外饰层和连接层为砂浆。为分析室内相对湿度对围护结构霉菌生长风险的影响,室内全年温湿度变化简化为正弦变化[28],平均相对湿度分别设置为60%、65%、70%和75%,全年相对湿度波动范围设置为20%;平均温度为20 ℃,全年温度波动范围设置为4 ℃。围护结构热湿耦合计算采用WUFI Pro软件,由此得到墙体内表面的全年逐时温湿度数据。以此数据作为输入值,基于修正后的霉菌模型计算全年霉菌生长指数。
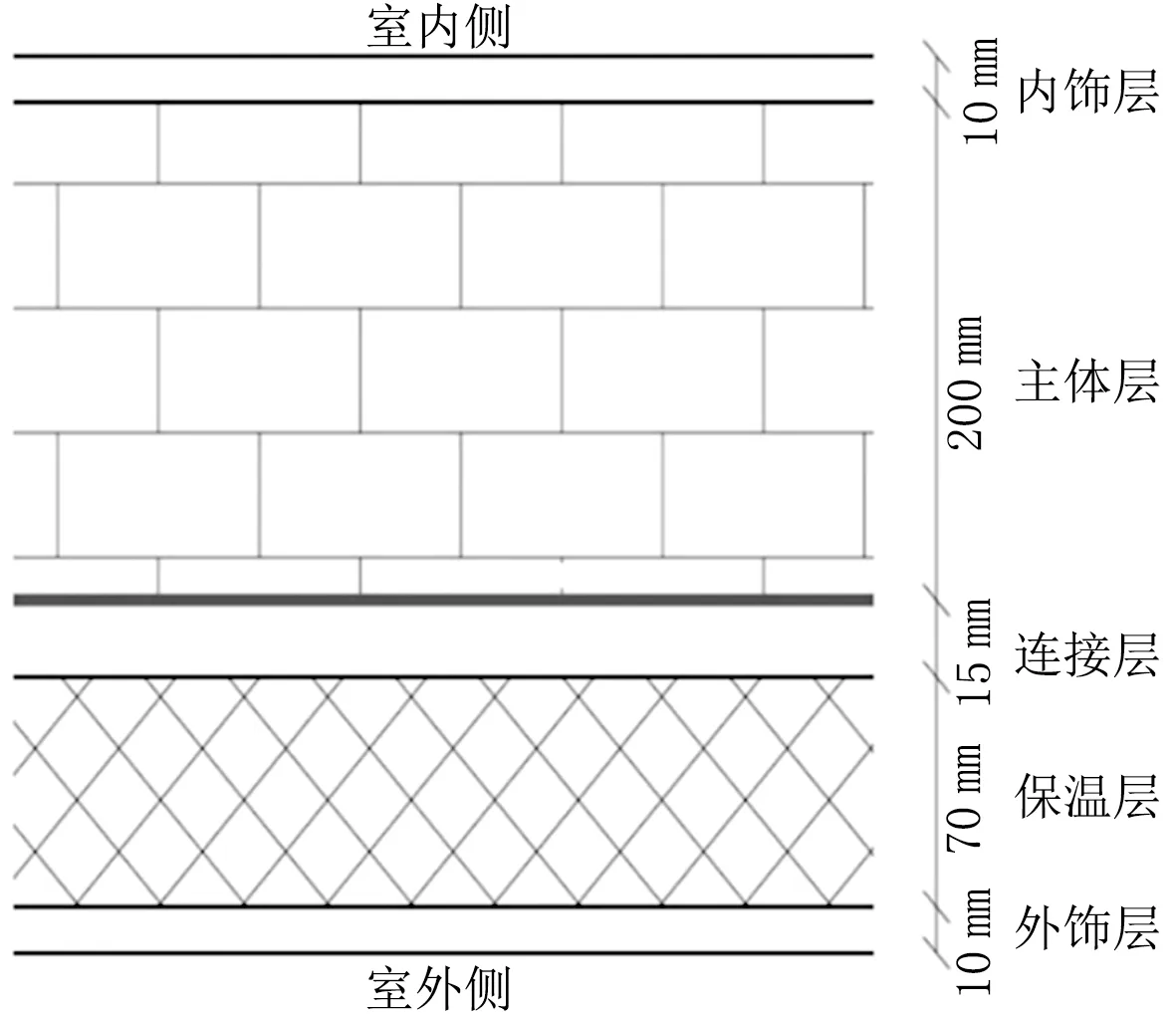
图8 典型外保温围护结构
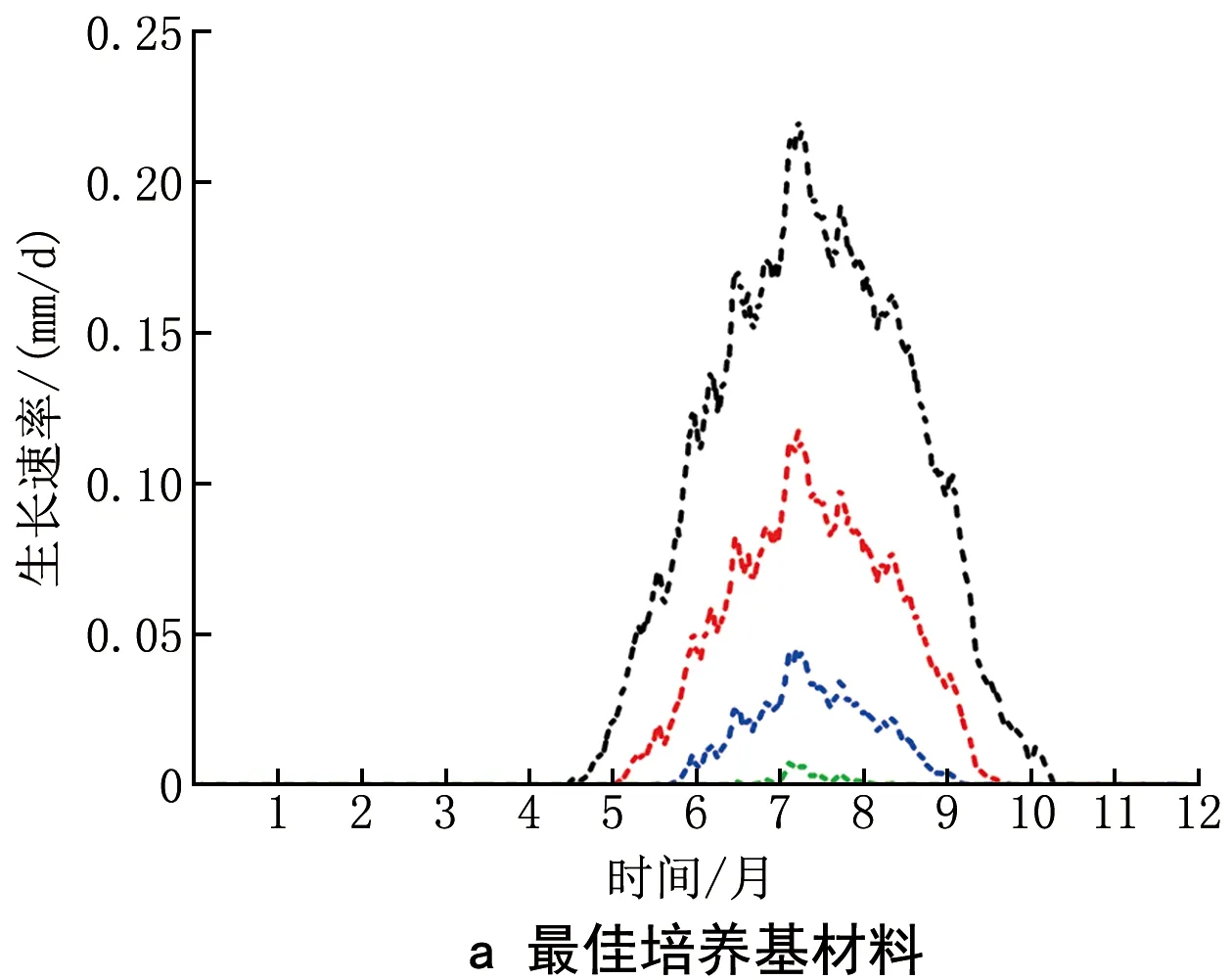
为了研究不同工况下围护结构内表面材料对霉菌生长的影响,分别选择内表面材料为最佳培养基材料及常见的灰泥材料。图9给出了不同室内工况下2种围护结构材料内表面霉菌生长速率逐时值。可以看出,在上海地区,夏季室内温度较高,此时若室内相对湿度也同样处于较高水平,则容易引发霉菌快速生长,且霉菌生长速率随着室内相对湿度增大而增大。同时,材料属性对霉菌生长的影响也较为明显,对于平均相对湿度为75%的情况,当内表面材料为最佳培养基材料时,最大生长速率约为0.23 mm/d。而当内表面材料为灰泥材料时,最大生长速率约为0.18 mm/d。
由此得出结论,当夏季室内相对湿度越高,且围护结构内表面材料的长霉因子越大时,围护结构的霉菌生长风险也越大。因此,控制夏季室内相对湿度及选择长霉因子小的内表面材料是防止墙体内表面霉菌生长的2个可行措施。
为了比较修正后的模型与Sedlbauer模型在评价霉菌生长风险方面的差异性,利用二者对室内相对湿度为75%工况下的围护结构霉菌生长风险进行计算分析。图10显示了2种模型对于不同内表面材料年霉菌生长量计算结果的对比(即对图9中一年的逐时霉菌生长率进行求和)。可以看出,Sedlbauer模型中2类建材年霉菌生长总量相差超过100 mm。而从本文提出的模型来看,对于不同的饰面材料,如灰泥、刨花板和胶合板等,其年霉菌生长总量相差较小。这说明,利用修正后的模型可以更好地反映出不同饰面材料霉菌生长风险的大小,即提高霉菌生长风险评价的精度,避免由于材料选择导致霉菌生长风险的高估或低估。
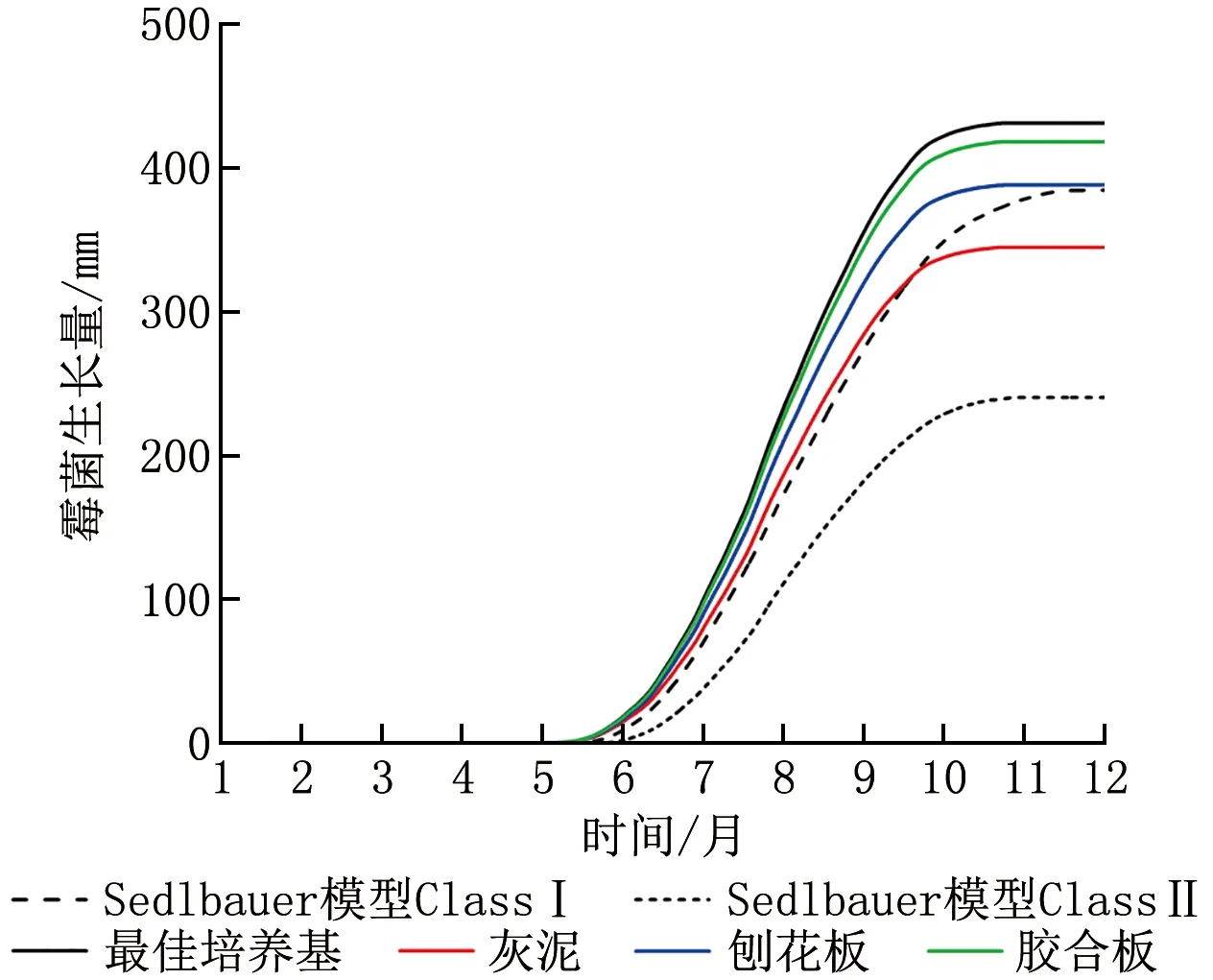
图10 相对湿度75%工况下不同材料霉菌年生长量Sedlbauer模型与修正模型比较
4 结论与展望
本文通过现场采集和DNA高通量测序技术,对围护结构中出现的霉菌进行了识别。在此基础上,基于文献中培养数据、最佳温度下霉菌生长速率与相对湿度函数关系及常用建材表面霉菌生长临界相对湿度对等值线模型进行了修正。利用修正后的模型对上海市典型围护结构在不同室内相对湿度水平下的霉菌生长风险进行了评估,并将评估结果与Sedlbauer等值线模型进行了比较。研究得到的主要结论有:
1) 建筑围护结构生长的主要霉菌种类为芽枝霉属菌、青霉属菌和曲霉属菌;对于不同年代的建筑,上述3类菌属相对丰度分布稍有不同,但总体占比均约为65%。
2) 基于文献数据和生长速率拟合,得到了修正后的等值线模型,该模型以某时刻的温湿度数据作为输入条件,求取任意时间节点的霉菌生长速率,再对时间进行积分,求取对应时间段的生长总量,作为霉菌生长风险评价的指标。其中,霉菌生长的温湿度边界为:LIM 0:φ=0.026 33cosh(0.100 83(θ-30))+0.715 3。
3) 为表征不同建材对于霉菌生长的影响,定义了长霉因子。同一材料不同温度下的长霉因子稍有不同,但差异不大。给出了常用建材的长霉因子。
4) 对于上海地区典型的外保温围护结构,其内表面的霉菌生长风险随夏季室内相对湿度增大而增大,因此控制夏季室内相对湿度及选择长霉因子小的内表面材料是防止霉菌生长的2种可行手段。此外,模型对比结果显示,通过提出长霉因子,可以提高霉菌生长风险评估的精度。

