黏蛋白MUC1、MUC4和MUC6在胰腺癌中的表达及预后意义
钟国栋 ,兰婷,李国平张声陈余朋陈林莺
(1福建医科大学附属第一医院病理科,福州 350000;2福建中医药大学附属第二人民医院病理科,福州 350000;3福建医科大学口腔医学院,福州 350000;4福建省癌症和神经退行性疾病转化研究重点实验室,福州 350000)
胰腺癌(pancreatic adenocarcinoma, PAAD)是常见的消化道恶性肿瘤之一,手术为主的综合治疗是其主要的治疗手段[1]。除了广泛应用于临床的传统预后预测因子如组织学分型、分级和TNM分期[2],新近的基因组学方法用以识别本质分子特征等手段也被推荐用于改善PAAD患者的风险预测[3,4]。尽管对PAAD的诊疗有了很大的进展,但其癌症相关疾病死亡率仍高居第四位,即使是仍处于疾病早期的患者。因此,寻找新的预后预测因子是PAAD防治的重要内容,其中操作简单而费用低廉的免疫组化方法仍是临床推荐的常用手段。
黏蛋白(mucins, MUCs)是一组包含21个家族成员的高分子量糖蛋白,富含丝氨酸和苏氨酸残基的核心肽主链和通过O-糖苷键连接的寡糖残基结构域。MUCs主要分为分泌型和膜结合型,正常情况下分布在消化道表面提供粘膜保护,介导细胞分化、粘附、信号转导和免疫反应,异常的MUCs与肿瘤发生发展有关[5,6]。近年来,MUCs表达组合作为潜在生物标记引起人们的关注[7-9],世界卫生组织(WHO)综合MUC1、MUC2、MUC5AC和MUC6表达用于胰腺导管内乳头状病变的鉴别诊断,Sierzega等人发现根据MUC3、MUC5AC和MUC6的表达情况可以区分胰腺良恶性病变。但是,MUCs表达组合对PAAD预后意义研究甚少。
MUCs家 族 中,MUC1、MUC4和MUC6与PAAD及其前体病变的进展有关[10,11]。MUC1是一种跨膜蛋白,正常情况下表达于正常腺体和管腔上皮细胞的顶端,异常表达与包括PAAD在内的多种肿瘤的发生有关[12,13]。全长MUC1形成异二聚体,其N端和C端介导不同的生理功能,在癌细胞中,C端在胞外蛋白酶的作用下从N端游离,当癌细胞失去极性,C端在整个细胞膜和胞质内重新分布,这种分布方式与非小细胞肺癌预后不良相关[14,15],但与PAAD临床病理特征及预后的关系不太明确。跨膜蛋白MUC4是含有独特表皮生长因子样结构域的黏蛋白,与PAAD预后不良有关[17,18],MUC6是分泌型凝胶形成蛋白,与肿瘤细胞分化相关,可抑制肿瘤细胞的侵袭和转移[19,20],这3种黏蛋白的异常表达是否能进一步分层PAAD预后作用及其潜在的分子机制目前均不明确。
因此,本研究对公共TCGA数据库中MUC1、MUC4和MUC6的mRNA表达以及PAAD临床队列中免疫组织化学方法检测的蛋白表达进行分析,首先分别探讨MUCs异常表达与PAAD临床病理特征和预后的关系,接着进一步分析三者的组合表达对PAAD预后分层作用,最后根据转录水平筛选出显著差异表达基因(DEGs),并通过基因本体(GO)分析对差异表达进行富集。
材料和方法
1 研究对象
PAAD临床资料及mRNA数据下载自癌症基因组图谱(TCGA,https://cancergenome.nih.gov/)数据库,最后纳入171例PAAD患者和4个正常组织标本。临床样本收集自2006年至2016年在福建医科大学第一附属医院连续诊断并接受手术切除的168例患者,排除11例未能获得适当IHC染色的病例。复习所有HE切片,组织学诊断和分级根据WHO标准,同时评估淋巴血管侵犯(LVI)和神经侵犯(NI)。其他信息包括年龄、肿瘤大小、pN分期和pT分期摘自医院病历系统。OS定义为从最初诊断到死亡的时间间隔,两组数据均排除术后1个月内死亡的患者。本研究获得福建医科大学第一附属医院机构研究伦理委员会批准。
2 组织芯片构建及免疫组织化学染色
每个病例获得两个直径2.5 mm的肿瘤组织和一个正常组织构建组织芯片,连续4 μm切片,其中一张行HE染色以确认肿瘤存在[21]。免疫组织化学染色(IHC)根据产品说明书进行,抗MUC1/DF3(EP85)、MUC4(8G7)和MUC6(MRQ20)单克隆抗体均购自中国北京中山生物技术有限公司。组织芯片经脱蜡、水化和抗原修复(EDTA pH 8.0,37°C 30 min)后,用Dako EnVision FLEX+检测系统(Dako,丹麦)和DAB检测试剂盒(Ventana,美国)进行染色。所有切片均经苏木素复染。
3 免疫组织化学染色结果评价
MUC1的表达分为极性(MUC1P)和非极性表达(MUC1D)[14,15],MUC1P表达指局限于管腔上皮细胞顶端水平的染色且MUC1D阳性细胞<10%或阴性着色;MUC1D表达指阳性细胞>10% ,染色分布在整个细胞表面或细胞质内。以阳性肿瘤细胞的百分比乘以染色强度来确定MUC4和MUC6的染色评分,阳性细胞百分率记为0%~100%,而染色强度分级为0到3,计算染色评分的平均数作为阈值来定义MUC4和MUC6的高表达或低表达。
4 差异表达基因鉴定与基因本体分析
利用TCGA数据库进行基因本体富集(GO)分析,根据MUC1、MUC4和MUC6表达水平的中位数,将PAAD患者分为高表达组和低表达组,用R语言的Limma软件包分析各组间的差异表达基因(DEGs),LogFC>1且adjustP<0.05的DEGs是显著上调基因,而LogFC<-1且adjustP<0.05的DEGs是显著下调基因,Venn软件在线聚类,并将差异基因集作为一个整体进行GO分析。
5 统计分析
使用SPSS.V.18统计软件包进行,Fisher精确检验分析MUC1、MUC4和MUC6表达与年龄、性别、肿瘤部位、组织学分级、pN分期、pT分期、LVI和NI的相关性,Kaplan-Meier和多变量Cox回归分析评估生存数据。P<0.05为差异具有显著性。
结 果
1 病例资料
TCGA数据171例PDDA患者中,93例男性和78例女性,平均年龄为64.54±10.86岁(35-88岁),TNMⅠ~Ⅱ、Ⅲ~Ⅳ期161例,Ⅲ~Ⅳ期7例,3例状态不明,平均随访时间47.14±39.01个月(2.58~228.01个月)。临床队列中,96名男性和61名女性,平均年龄为59.6±11.03岁(范围为28-86岁),TNMⅠ~Ⅱ期133例,Ⅲ~Ⅳ期24例,随访135例,其中114例死于PDDA,平均随访时间18.83±14.60个月(2~71个月)(表1)。
2 MUC1、MUC4和MUC6在胰腺癌中的表达
在正常组织中,MUC1阳性染色局限于管腔上皮细胞顶端水平(图1A),MUC4呈阴性表达,MUC6呈局灶性胞质阳性染色(图1)。对于PAAD癌组织,MUC1阳性着色分布于管腔侧、胞质内或整个细胞表面(图1B、C),MUC4(图1E、F)和MUC6(图1H、I)呈局灶性或弥漫性胞质染色。
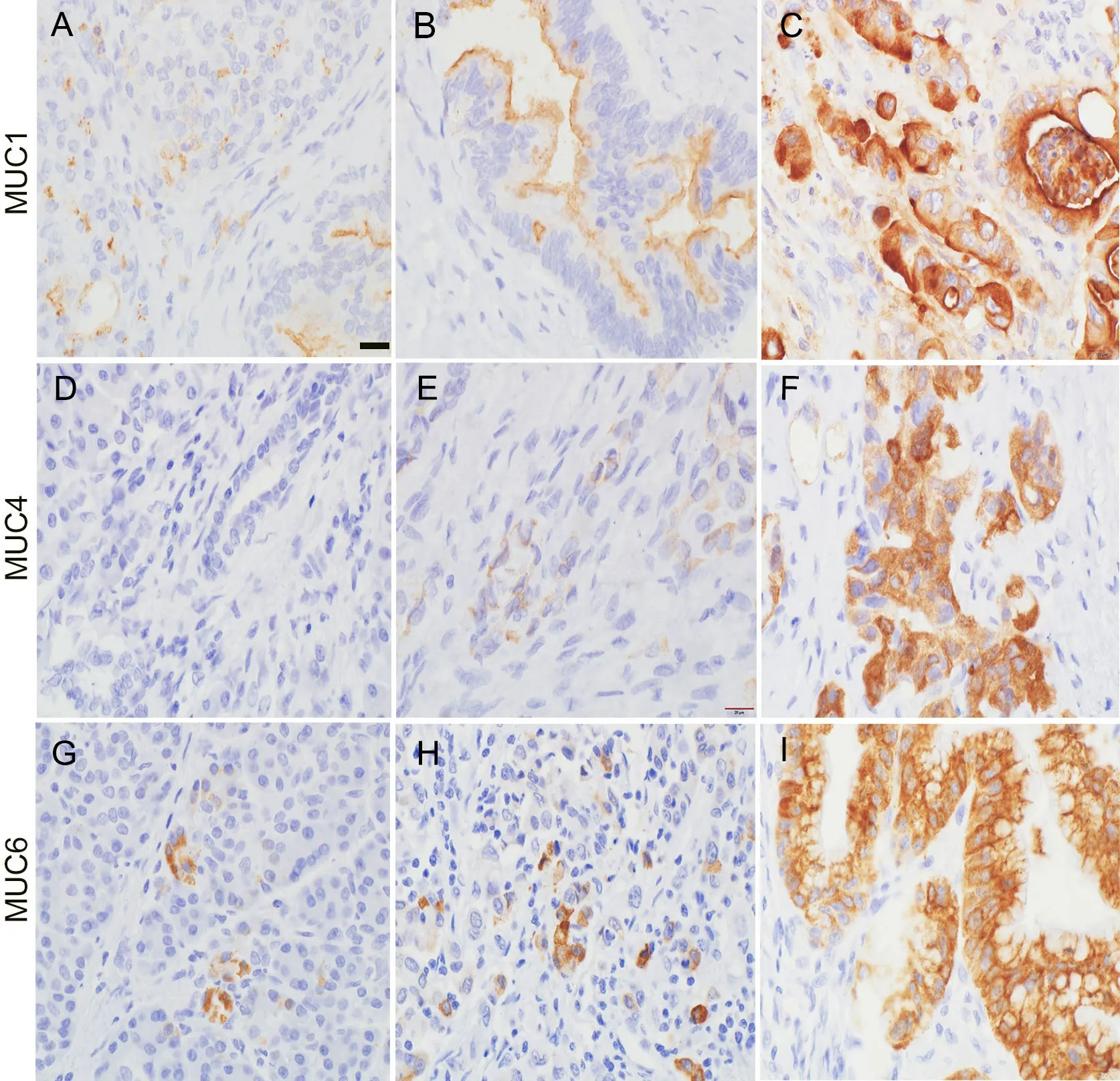
图1 胰腺癌和癌旁组织中MUC1、MUC4和MUC6表达的免疫组织化学检测。A,癌旁组织中MUC1免疫阳性染色局限于管腔上皮细胞顶端水平;B,分化好的胰腺癌MUC1免疫阳性着色;C,差分化胰腺癌MUC1免疫阳性着色;D.在癌旁组织MUC4呈阴性表达;E,胰腺癌MUC4呈局灶性胞质染色;F,胰腺癌MUC4呈弥漫性胞质染色;G,癌旁组织MUC6呈局灶性胞质染色;H,差分化胰腺癌MUC6呈局灶性胞质染色;I,分化好的胰腺癌MUC6 呈弥漫性胞质染色。比例尺,20 μmFig. 1 Immunohistochemical examination of expressions of MUC1, MUC4 and MUC6 in the pancreatic adenocarcinoma and the paired paracancerous tissue. A, polarized staining of MUC1 in pancreatic adenocarcinoma; B, polarized staining of MUC1 in well differentiated tissues of pancreatic adenocarcinoma; C, depolarized staining of MUC1 in poorly differentiated tissues of pancreatic adenocarcinoma; D, negative staining of MUC4 in the paired paracancerous tissue; E, focal positive cytoplasmic staining of MUC4 in pancreatic adenocarcinoma; F, diffuse cytoplasmic staining of MUC4 in pancreatic adenocarcinoma; G, focal cytoplasmic positive staining of MUC6 in the paired paracancerous tissue; H, focal cytoplasmic staining of MUC6 in poorly differentiated tissues in pancreatic adenocarcinoma; I, diffuse cytoplasmic staining of MUC6 in well differentiated tissues of pancreatic adenocarcinoma. Scare bar, 20 μm
在TCGA数据中,癌组织MUC1和MUC4 mRNA水平比正常组织显著升高(分别P=0.0082和0.043,图2A,C),MUC6表达也升高但差异无显著性(P=0.088,图2E)。临床队列癌组织中,87(55.4%)例MUC1呈非极性表达(图2B),83(52.9%)例MUC4C呈阳性表达(图2D),121(77.1%)例MUC6呈阳性表达(图2F),均显著高于相邻正常组织(P<0.0001),正常组织中1例MUC1呈非极性表达,0例MUC4和26例MUC6呈阳性表达。
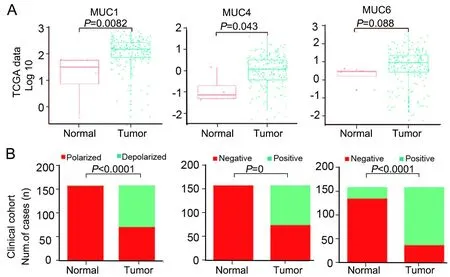
图2 胰腺癌组织和正常组织中MUC1、MUC4和MUC6的表达比较。A,基于TCGA数据的 MUC1、MUC2和MUC4 mRNA表达比较;B,基于临床队列的MUC1、MUC2和MUC4蛋白表达比较Fig. 2 Comparison of MUC1, MUC4 and MUC6 expression between normal and tumor tissues. A, TCGA data-based comparison of mRNA expression of MUC1, MUC2 and MUC4; B, clinical cohort-based comparison of protein expression of MUC1, MUC2 and MUC4.
3 胰腺癌组织中MUC1,MUC4和MUC6蛋白表达与临床病理特征的关系
Fisher精确检验分析显示:在PAAD中,87例呈MUC1非极性表达,MUC1异常表达与组织学分级和淋巴结受累显著正相关,52例呈MUC4高表达,MUC4的表达与临床病理特征无关,103例呈MUC6高表达,MUC6高表达与组织学分级和LVI显著负相关(表1)。

表1 MUC1、MUC4和MUC6表达与胰腺癌临床病理特征的关系Tab. 1 Relationship between MUCs expression and patients’ clinicopathological demographics
4 胰腺癌组织中MUC1、MUC4和MUC6的表达与预后的关系
TCGA数据中,以mRNA水平的中位数作为阈值,MUC4高表达与患者预后呈负相关,MUC1及MUC6 mRNA水平与预后无明显相关性(图3A)。对于临床队列,Kaplan-Meier分析显示,MUC1极性表达和MUC4低表达的患者的OS显著延长,而MUC6的表达与患者的生存率无关(图3B)。
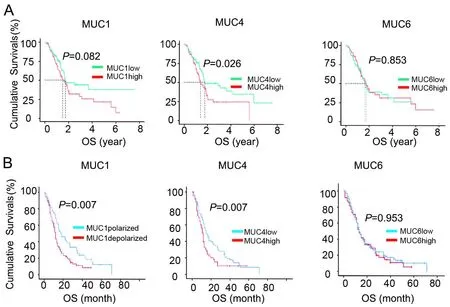
图3 MUC1、MUC4和MUC6的表达与胰腺癌患者总生存率关系的Kaplan-Meier分析。A,基于TCGA数据的MUC1、MUC4和MUC6 mRNA表达水平与胰腺癌患者总生存率关系分析;B,基于临床队列的MUC1、MUC4和MUC6蛋白表达水平与胰腺癌患者总生存率关系分析Fig. 3 Kaplan-Meier analysis for relationship of expression of MUC1, MUC2 and MUC4 with overall survival rate of patients with pancreatic adenocarcinoma. A, TCGA data-based analysis for relationship of mRNA levels of MUC1, MUC2 and MUC4 with overall survival rate of patients with pancreatic adenocarcinoma; B, clinical cohort-based analysis for relationship of protein expression levels of MUC1, MUC2 and MUC4 with overall survival rate of patients with pancreatic adenocarcinoma
将临床队列中患者的年龄、性别、肿瘤部位、pT分期、组织学分级、pN分期、NI、LVI、MUC1、MUC4和MUC6表达在内的多变量进行Cox回归分析显示:MUC4状态是PAAD患者预后独立不利因素(HR=1.705;95% CI,1.144~2.541;P=0.009)(表2)。
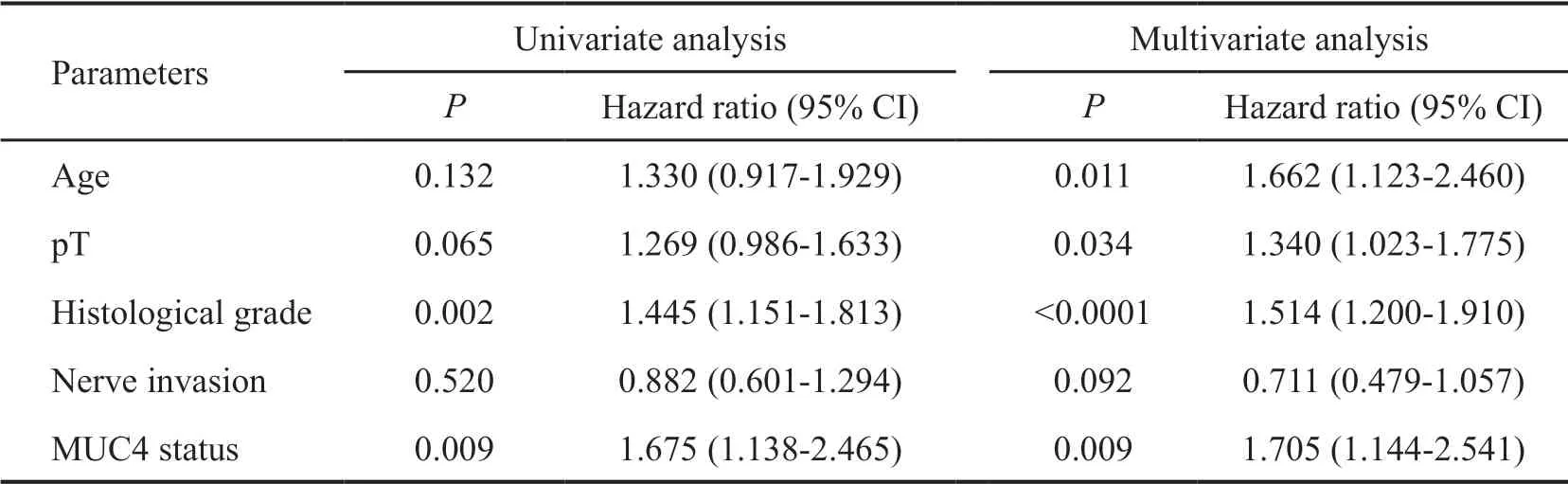
表2 胰腺癌患者总生率的单因素和多因素分析Tab. 2 Univariate and multivariate Cox regression analysis of overall survival of patients with pancreatic adenocarcinoma
Kaplan-Meier生存分析显示,在mRNA水平上,仅MUC1与MUC4而非MUC6组合有预后分层趋势(图4A),然而,结合MUC1蛋白的表达模式,MUC1/MUC4和MUC1/MUC6组合均显示预后趋势(图4B)。进一步分层分析显示,MUC1(极性)MUC4(低)表达患者的OS明显长于MUC1(非极性)MUC4(低)表达者(Logrank=5.388,P=0.020)和MUC1(非极性)MUC4(高)表达者(Logrank=14.612,P<0.0001),在MUC1表达相同的情况下,MUC6高表达的患者比MUC6低表达的患者有更好的OS(Logrank=5.138,P=0.023)。值得注意的是,无论是mRNA还是蛋白表达水平,MUC1、MUC4和MUC6组合都对PAAD预后具有分层意义(P值分别是0.023和0.001,图4)。
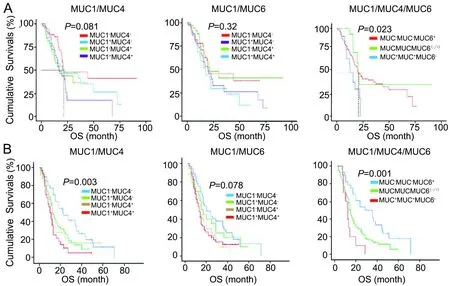
图4 MUC1、MUC4和MUC6组合表达与胰腺癌患者总生存率关系的Kaplan-Meier分析。A、C、E:mRNA水平;B、D、F:蛋白水平。A,及与TCGA数据的MUC1、MUC4和MUC6 mRNA组合表达与与胰腺癌患者总生存率关系分析;B,基于临床队列的MUC1、MUC4和MUC6 mRNA组合表达与与胰腺癌患者总生存率关系分析;MUC1-,MUC1低表达或极性表达;MUC1+,MUC1高表达或非极性表达;MUC4-,MUC4低;MUC4+,MUC4高;MUC6-,MUC6低表达;MUC6+,MUC6高表达Fig. 4 Kaplan-Meier analysis of the relationship between the combined expression of MUC1, MUC4 and MUC6 and the overall survival rate of patients with pancreatic adenocarcinoma. A, TCGA data-based analysis of the relationship between the combined mRNA expression of MUC1, MUC4 and MUC6 and the overall survival rate of patients with pancreatic adenocarcinoma; B, clinical cohort-based analysis of the relationship between the combined protein expression of MUC1, MUC4 and MUC6 and the overall survival rate of patients with pancreatic adenocarcinoma; MUC1-, MUC1 low or polarized expression; MUC1+, MUC1 high or depolarized expression; MUC4-, MUC4 low; MUC4+, MUC4 high; MUC6-, MUC6 low; MUC6+, MUC6 high
5 胰腺癌中MUC1、MUC4和MUC6显著差异表达基因及基因本体富集分析
与MUC1、MUC4和MUC6显著相关的差异表达基因(DEG)分别有3199、644和422个(图5A),其中分别有1123、238和397个基因表达上调和2076、406和25个基因表达下调,与MUC1和MUC4同时相关的基因有27个,但无基因与MUC1、MUC4和MUC6同时相关(图5B,C)。
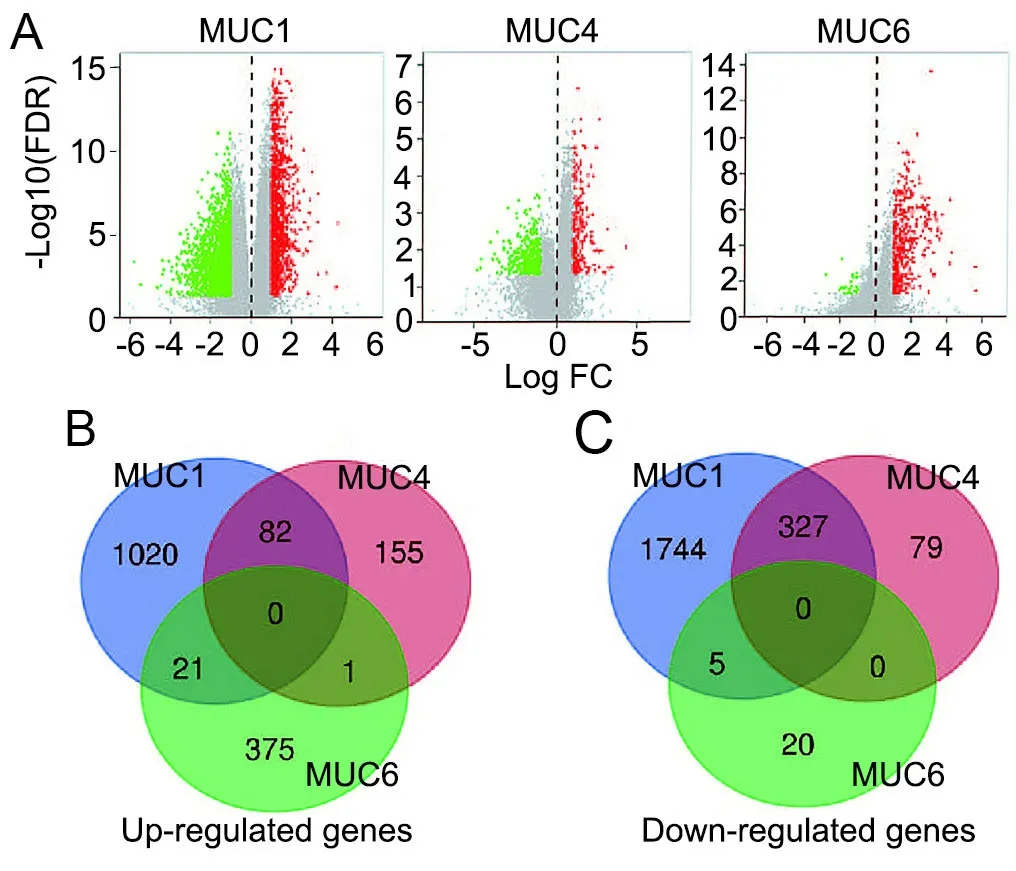
图5 TCGA数据库中与MUC1、MUC4和MUC6相关的差异表达基因及其Venn diagrams分析。A,DEGs火山图,红色点表示上调,绿色点表示下调;B,上调DEGs的交集;C,下调DEGs的交集Fig. 5 Differentially expressed genes associated with MUC1, MUC4 and MUC6 identified from TCGA database and analysis by Venn diagrams. A, volcano plots representing DEGs, data points in red represent up-regulated genes, and green represent down-regulated genes; B, intersection of up-regulated DEGs; C, intersection of down-regulated DEGs
GO富集分析表明,DEGs的生物学功能主要富集在膜电位调节和免疫应答等方面,对于细胞成分,DEGs主要与T细胞受体复合物、离子通道和转运体复合物以及质膜信号受体复合物等相关,而分子功能主要体现在离子通道活性及抗原结合等方面(P<4×10-12,图6)。

图6 MUC1、MUC4和MUC6相关的差异表达基因本体富集分析Fig. 6 Gene ontology enriched analysis for differentially expressed genes of MUC1, MUC4 and MUC6
讨 论
本研究利用TCGA数据和临床样本分析MUC1、MUC4和MUC6在PAAD中的表达及其预后意义,研究发现这3种黏蛋白的联合表达对PAAD有预后分层作用,从mRNA和蛋白表达水平探讨了MUC1、MUC4和MUC6联合表达对PAAD患者的预后意义,并通过差异基因富集分析发现,与该三种黏蛋白相关的DEGs的生物学功能主要富集在膜电位调节、免疫应答和质膜信号受体等方面,在PAAD的发展过程中可能发挥叠加效应或功能互补作用。
本研究从mRNA和蛋白表达水平进一步证实MUC1、MUC4和MUC6在PAAD癌组织中存在异常表达。已有的研究对MUC1的免疫组化评分采取染色强度、阳性细胞百分比或两者相结合的方式进行评分,导致不同研究之间的阈值存在显著不同[8,16,22],而本研究采取极性或非极性表达模式的替代评分方法,发现55.4%的PAAD患者的细胞浆和细胞膜出现异常MUC1染色,并且这种着色与更高的组织学级别、更多淋巴结受累和预后差密切相关,与已有的研究结果一致[13]。尽管在正常胰腺组织中可检测到MUC4 mRNA,但MUC4蛋白在正常组织中不表达,在癌组织中表达显著升高。我们发现,MUC4在PAAD中的表达率为52.9%,介于32%与82%之间[17,18],是PAAD独立的预后因子,但与PAAD临床病理学特征无显著相关性。MUC6是胃幽门腺黏蛋白,据报道在胰腺上皮内肿瘤中表达上调而在PAAD中表达下调[11,23,24]。与之相反,我们的研究发现与正常组织相比,癌组织中MUC6在RNA转录水平表达上调,在蛋白水平显著过表达,这与Pillai等研究结果相似[25],MUC6高表达在分化良好的肿瘤细胞和更少的淋巴血管浸润中更常见。
尽管单个的MUCs表达被认为是PAAD的预后因素,但其临床应用仍然受到限制,部分原因可能是由于不同研究结果之间的差异[26,27]。最近,有研究建议使用2个或3个MUCs组合来分层癌症患者的预后,应用MUC4、MUC16和MUC20组合和MUC14和MUC15组合分别可以进一步分层人类多种恶性肿瘤和胃癌的作用[28,29]。本研究发现联合应用MUC1、MUC4或MUC6特别是蛋白表达组合可以分层PAAD患者预后作用,特别是联合MUC1、MUC4和MUC6三者的表达组合对PAAD预后有显著的分层意义,这三种黏蛋白组合有望成为PAAD患者重要的预后指标,从而优化临床对患者的术后管理。
MUC1和MUC4均属于膜结合蛋白,通过抑制细胞与细胞或抑制细胞与细胞外基质间的相互作用从而促进胰腺癌细胞的侵袭潜能[30,31],而MUC6可能通过阻碍肿瘤细胞侵袭胰管基底膜从而发挥保护因子的作用[19]。本研究的结果也证实了这一观点,我们发现,尽管单独的MUC6状态与预后无显著相关性,但在MUC1表达相同的情况下,MUC6高表达的患者比MUC6低表达的患者有更长的总生存期。通过差异表达基因富集分析发现,MUC1、MUC4和MUC6主要通过与胞膜致癌信号受体相互作用或参与诱导离子通道和转运蛋白异常或通过创造空间位阻掩盖肿瘤相关表位以防止免疫细胞对肿瘤细胞的特异性和非特异性杀伤效应而影响PAAD疾病进程[33-36]。3种黏蛋白的显著相关差异表达基因之间没有交集,但是MUC1和MUC4之间有一些重叠,提示在疾病进展中的叠加效应或功能互补,然而,其精确的分子间及与下游级联分子间相互作用还需要进一步研究确定。
总之,我们的研究表明,MUC1、MUC4和MUC6在PAAD肿瘤组织中表达异常,MUC1蛋白非极化表达和MUC4高表达提示PAAD患者预后不佳,MUC1、MUC4和MUC6组合对PAAD预后具有分层意义,3种黏蛋白可能通过叠加效应或功能互补促进PAAD疾病进程,不仅有望成为PAAD患者重要的预后指标,而且为进一步研究其潜在的分子机制提供线索。

