颅骨及脑组织CT MR显示差异对脑肿瘤放疗剂量学影响的研究*
李泳衡 巩贯忠 苏亚 王俪臻 侯传珂 卢洁 尹勇
脑转移瘤(brain metastases,BM)为常见恶性肿瘤,严重影响患者的生存时间及生存质量。放射治疗作为脑转移瘤的主要治疗方式,疗效显著、应用广泛。BM精确放疗中,CT模拟定位是其主要的定位手段。CT图像自身携带的电子密度信息是计算脑转移瘤放疗剂量的主要依据[1]。然而,CT 成像的硬化效应和部分容积效应严重影响着组织CT值的估算及显示,在颅脑CT 成像的颅骨及脑组织边缘显示中尤为明显,可能为脑转移瘤放疗剂量计算带来较大的不确定性[2]。磁共振成像(magnetic resonance imaging,MRI)对软组织分辨率高的优势可以精确显示颅骨及脑组织的范围,将有利于提高脑转移瘤放疗剂量的计算精度。因此,本研究通过分析基于CT/MR 确定的颅骨和脑组织的差异,量化这种显示差异对BM放疗剂量计算的影响。
1 材料与方法
1.1 病例资料
分析山东省肿瘤医院2018年10月至2020年2月行放射治疗的BM患者60例,其中男性31例,女性29例,年龄34~76岁,中位年龄54.5岁。原发病灶经影像、临床实验室及病理检查确定,分别为肺癌38例,乳腺癌11例,胃癌、结肠癌、肾癌各2例,卵巢癌、黑色素瘤、肝癌、宫颈癌、淋巴瘤各1例。另外经过统计,局脑放疗中单发转移灶17 例,多发转移灶23例。全脑放疗中单发转移灶3 例,多发转移灶17例。全脑照射后局部加量的有17 例,无局部加量的有3例。所有研究对象均已签订知情同意书。
1.2 方法
1.2.1 CT模拟定位 所有患者均采取仰卧位,应用头颈热塑面罩固定,在Brilliance大孔径CT定位机(购自荷兰Philips公司)上进行CT模拟定位,扫描范围为头顶至枕骨大孔下缘,扫描层厚为3 mm,层间距为3 mm。
1.2.2 MR 模拟定位 使用GE 3.0 T 超导型MR 扫描仪(Discovery 750 w,购自美国GE Healthcare 公司)进行MR 模拟定位,6 通道头颅线圈(6 ch Neuro Flex),所有患者行三维T1WI扫描,扫描参数:TR=5 160 ms,TE=11.5 ms,矩阵=256×256,FOV=256 mm×256 mm,层厚=3 mm,层间距为0。造影剂采用顺磁性对比剂Gd-DTPA,剂量为0.2 mL/kg,注射速率为2 mL/s,注射结束后3~5 min内完成扫描。
1.2.3 肿瘤靶区及危及器官勾画 将CT及MR图像传入Eclipse 15.5治疗计划系统(美国Varian公司)中,首先将CT和MR图像刚性配准,然后以MR图像为依据在CT图像上勾画大体肿瘤靶区(gross tumor volume,GTV),计划靶区(planning target volume,PTV),脑干、眼球、晶状体、视神经等危及器官(organs at risk,OARs)。
在CT图像上用阈值法进行颅骨(CT值>150 HU)及脑组织(CT值0~100 HU)的勾画,命名为Skull-CT和Brain-CT;在MR图像上勾画的颅骨命名为Skull-MR,并在MR图像上确定不包含和包含脑膜的脑组织Brain-MR-1、Brain-MR-2。Skull-CT和Skull-MR相减获得Skull-sub。全脑放疗患者Brain-MR-1/Brain-MR-2分别外扩3 mm得到PTVBrain-MR-1及PTVBrain-MR-2。每例患者均由同一临床医师勾画。
1.2.4 计划设计 接受局部放疗的40 例患者,制定5~7 野的调强放射治疗(intensity-modulated radia⁃tion therapy,IMRT)计划,处方剂量为60 Gy,2 Gy/次×30次;而接受全脑放疗的20例患者,采用2野对穿的三维适形放射治疗(three-dimensional conformal radi⁃ation therapy,3D-CRT)计划,处方剂量为30 Gy,3 Gy/次×10 次。剂量权重:脑干>靶区>其他危及器官。处方剂量要求覆盖95%以上的靶区,最大剂量少于处方剂量的110%。危及器官的剂量限制,脑干最大剂量<54 Gy,眼球最大剂量<55 Gy,晶体最大剂量<8 Gy,视神经最大剂量<50 Gy[3]。剂量计算采用AAA_15.512算法,计算网格设定为2.5 mm×2.5 mm。
1.2.5 剂量学比较 放疗计划均以模拟定位CT图像为依据进行放疗剂量计算,获得Plan1;复制CT图像,将Skull-sub 赋予CT 值20 HU,得到CT2 图像,再将Plan1 复制到CT2 图像上进行放疗剂量的再次计算,获得Plan2。比较两次计划的剂量学差异。具体研究流程,见图1。
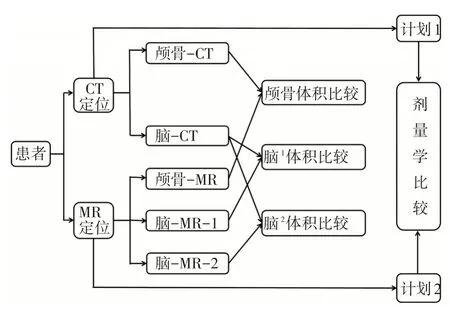
图1 研究流程图
1.2.6 剂量学评价指标 通过剂量体积直方图(dose volume histogram,DVH)对2个计划的剂量学指标进行比较,包括颅骨的最大剂量Skull-Dmax及平均剂量Skull-Dmean,脑干、眼球、晶状体、视神经的最大剂量Dmax,PTV 的D1%、D2%、D3%、D4%、D5%、D50%、D98%、D99%、适形度指数(conformity index,CI)[4]、均匀性指数(ho⁃mogeneity index,HI)[5]和处方剂量的靶区覆盖度(局部放疗为V60Gy[%],全脑放疗为V30Gy[%])。
Dx%是指X%的体积接受的剂量,VxGy[%]是指接受XGy及以上的体积占总体积的百分比。CI=(Vt,ref/Vt)×(Vt,ref/Vref),式中,Vt为靶区体积;Vt,ref为处方剂量线包绕的靶区体积;Vref为处方剂量线包绕的所有区域体积。HI=(D2%-D98%)/D50%,式中,D2%、D98%和D50%分别表示PTV的2%、98%和50%体积接受的剂量。CI越接近1适形度越好,HI越接近0均匀性越好。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。两两比较中采用配对t检验,结果以表示。以P<0.05 为差异具有统计学意义。
2 结果
2.1 基于CT/MR确定颅骨及脑组织的体积比较
Skull-MR较Skull-CT体积平均减少约46%;Brain-CT与Brain-MR-1体积基本相当,二者差异平均仅为0.8%;而Brain-CT 较Brain-MR-2的体积平均减少约6.7%;Brain-MR-1较Brain-MR-2体积平均减少约7.5%;差异均具有统计学意义(均P<0.05),见表1,图2。
表1 60例患者颅骨及脑组织体积的配对比较 (cm3,±s)
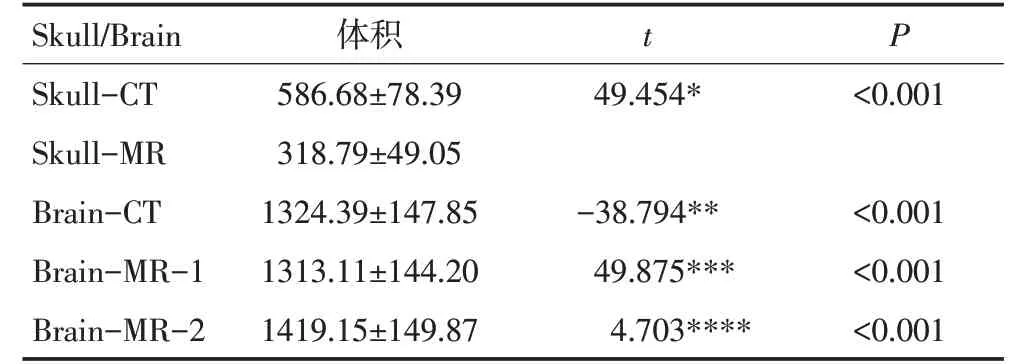
表1 60例患者颅骨及脑组织体积的配对比较 (cm3,±s)
*:表示Skull-CT 与Skull-MR 配对比较;**:表示Brain-CT 与Brain-MR-1配对比较;***:表示Brain-CT 与Brain-MR-2配对比较;****:表示Brain-MR-1与Brain-MR-2配对比较
Skull/Brain Skull-CT Skull-MR Brain-CT Brain-MR-1 Brain-MR-2体积586.68±78.39 318.79±49.05 1324.39±147.85 1313.11±144.20 1419.15±149.87 t 49.454*-38.794**49.875***4.703****P<0.001<0.001<0.001<0.001
2.2 基于CT/MR颅骨显示差异对颅骨的剂量学影响
对于局部放疗的患者,相对于Plan1、Plan2 的Skull-Dmax平均减少约0.4%,Skull-Dmean平均升高约3.5%,差异均具有统计学意义(均P<0.05)。
对于全脑放疗的患者,相对于Plan1,Plan2 的Skull-Dmax平均减少约0.1%,差异无统计学意义(P>0.05);Skull-Dmean平均升高约2.4%,差异具有统计学意义(P<0.05)。
颅骨显示差异对全脑放疗患者颅骨的剂量学影响略低于局部放疗患者,见表2。
2.3 基于CT/MR颅骨显示差异对PTV的剂量学影响
对于局部放疗的患者,相对于Plan1,Plan2 中PTV 的D1%、D2%、D3%、D4%、D5%、D50%、D98%、D99%、CI 及靶区覆盖度的变化率平均<0.16%,差异均无统计学意义(P>0.05),而HI平均升高约1.5%,差异具有统计学意义(P<0.05)。
对于全脑放疗的患者,相对于Plan1,Plan2中PTV的D1%、D2%、D3%、D4%、D5%的平均变化率小于0.07%,差异均无统计学意义(均P>0.05),而D50%、D98%、D99%、CI以及靶区覆盖度的变化率均在1.1%以内,HI平均减少约6.8%,差异均具有统计学意义(均P<0.05)。
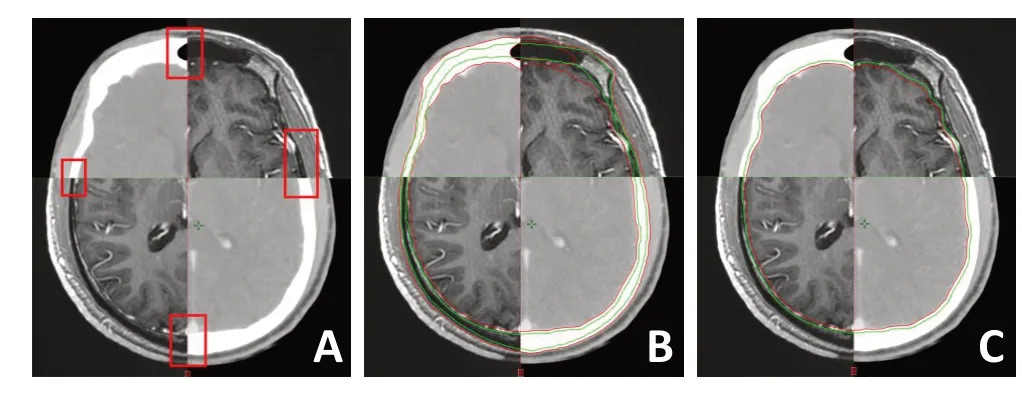
图2 CT/MR配准图像
表2 60例患者颅骨Dmax及Dmean的配对比较 (Gy,±s)
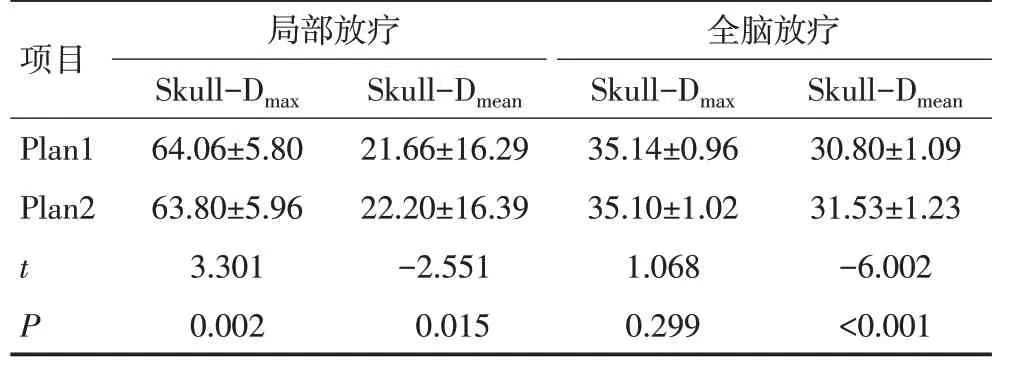
表2 60例患者颅骨Dmax及Dmean的配对比较 (Gy,±s)
项目Plan1 Plan2 t P局部放疗Skull-Dmax 64.06±5.80 63.80±5.96 3.301 0.002 Skull-Dmean 21.66±16.29 22.20±16.39-2.551 0.015全脑放疗Skull-Dmax 35.14±0.96 35.10±1.02 1.068 0.299 Skull-Dmean 30.80±1.09 31.53±1.23-6.002<0.001
颅骨显示差异对全脑放疗患者PTV 的剂量学影响略高于局部放疗患者,见表3。
2.4 基于CT/MR颅骨显示差异对OARs的剂量学影响
对于局部放疗的患者,相对于Plan1,Plan2中脑干的Dmax平均升高约0.8%,差异均无统计学意义(均P>0.05),其他危及器官,左、右眼球,左、右晶状体,左、右视神经的Dmax变化率均小于2%(1%~2%),差异均具有统计学意义(均P<0.05)。
对于全脑放疗的患者,相对于Plan1,Plan2中左、右晶状体的Dmax平均减少约1%和0.9%,差异均无统计学意义(均P>0.05),其他危及器官,脑干,左、右眼球,左、右视神经的Dmax变化率均<0.67%(0.24%~0.67%),差异均具有统计学意义(均P<0.05)。
颅骨显示差异对全脑放疗患者OARs 的剂量学影响略低于局部放疗患者,见表4。
2.5 基于CT/MR确定的脑组织显示差异对全脑放疗PTV的剂量学影响
PTVBrain-CT在Plan1中与PTVBrain-MR-1在Plan2中的比较,D1%、D2%、D3%、D4%、D5%平均减少不超过0.05%,D50%平均升高约0.04%,差异均无统计学意义(均P>0.05);D98%和D99%平均升高约1.5%和2.2%,CI平均升高约1%,HI平均减少约11%,靶区覆盖度平均升高约0.5%,除了CI,其他指标的差异均有统计学意义(P<0.05)。
PTVBrain-CT在Plan1中与PTVBrain-MR-2在Plan2中的比较,D1%平均升高约0.02%,D2%、D3%、D4%、D5%、D50%平均减少不超过0.03%,D98%平均升高约0.08%,D99%平均减少约0.7%,CI 平均减少约0.6%,HI 平均升高约2.4%,靶区覆盖度平均减少约0.2%,差异均无统计学意义(P>0.05)。
PTVBrain-MR-1与PTVBrain-MR-2在Plan2 中的比较结果和PTVBrain-CT在Plan1 中与PTVBrain-MR-2在Plan2 中的比较结果基本一致,见表5。
表3 60例患者PTV剂量指标的配对比较 (Gy,±s)
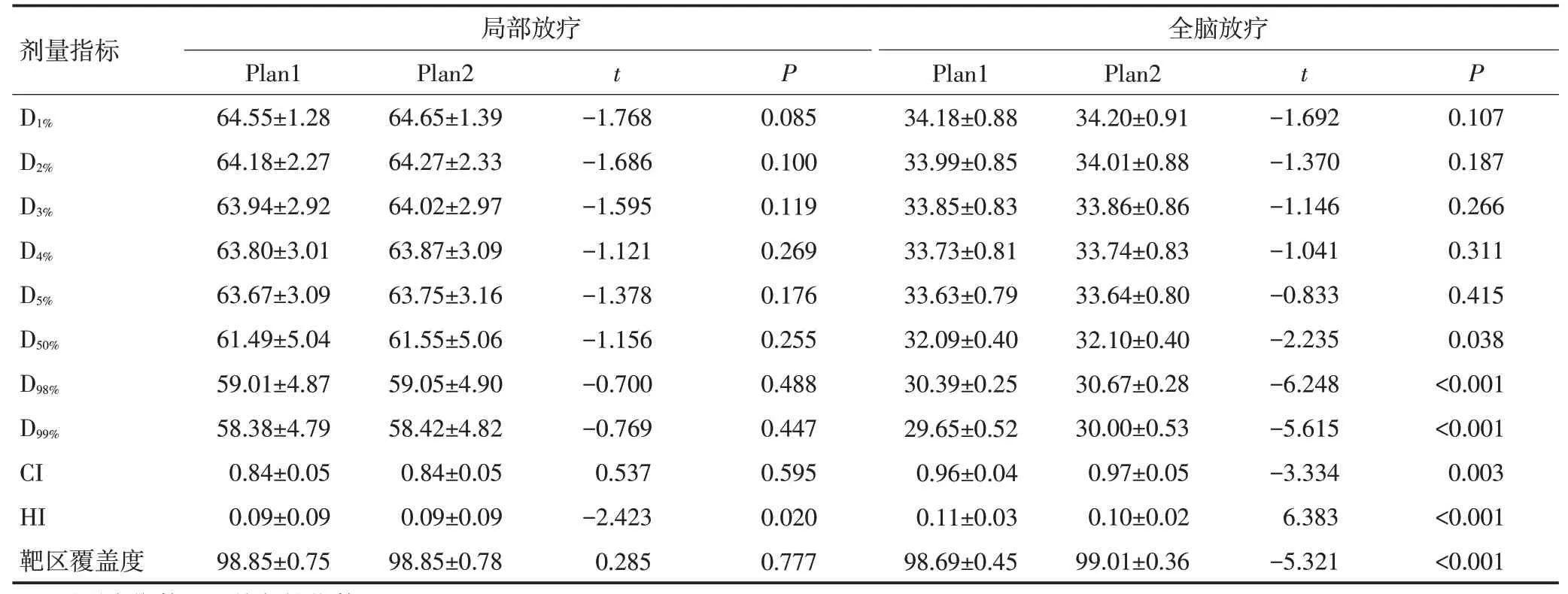
表3 60例患者PTV剂量指标的配对比较 (Gy,±s)
CI:适形度指数;HI:均匀性指数
剂量指标D1%D2%D3%D4%D5%D50%D98%D99%CI HI靶区覆盖度局部放疗Plan1 64.55±1.28 64.18±2.27 63.94±2.92 63.80±3.01 63.67±3.09 61.49±5.04 59.01±4.87 58.38±4.79 0.84±0.05 0.09±0.09 98.85±0.75 Plan2 64.65±1.39 64.27±2.33 64.02±2.97 63.87±3.09 63.75±3.16 61.55±5.06 59.05±4.90 58.42±4.82 0.84±0.05 0.09±0.09 98.85±0.78 t-1.768-1.686-1.595-1.121-1.378-1.156-0.700-0.769 0.537-2.423 0.285 P 0.085 0.100 0.119 0.269 0.176 0.255 0.488 0.447 0.595 0.020 0.777全脑放疗Plan1 34.18±0.88 33.99±0.85 33.85±0.83 33.73±0.81 33.63±0.79 32.09±0.40 30.39±0.25 29.65±0.52 0.96±0.04 0.11±0.03 98.69±0.45 Plan2 34.20±0.91 34.01±0.88 33.86±0.86 33.74±0.83 33.64±0.80 32.10±0.40 30.67±0.28 30.00±0.53 0.97±0.05 0.10±0.02 99.01±0.36 t-1.692-1.370-1.146-1.041-0.833-2.235-6.248-5.615-3.334 6.383-5.321 P 0.107 0.187 0.266 0.311 0.415 0.038<0.001<0.001 0.003<0.001<0.001
表4 60例患者OARs的Dmax配对比较 (Gy,±s)
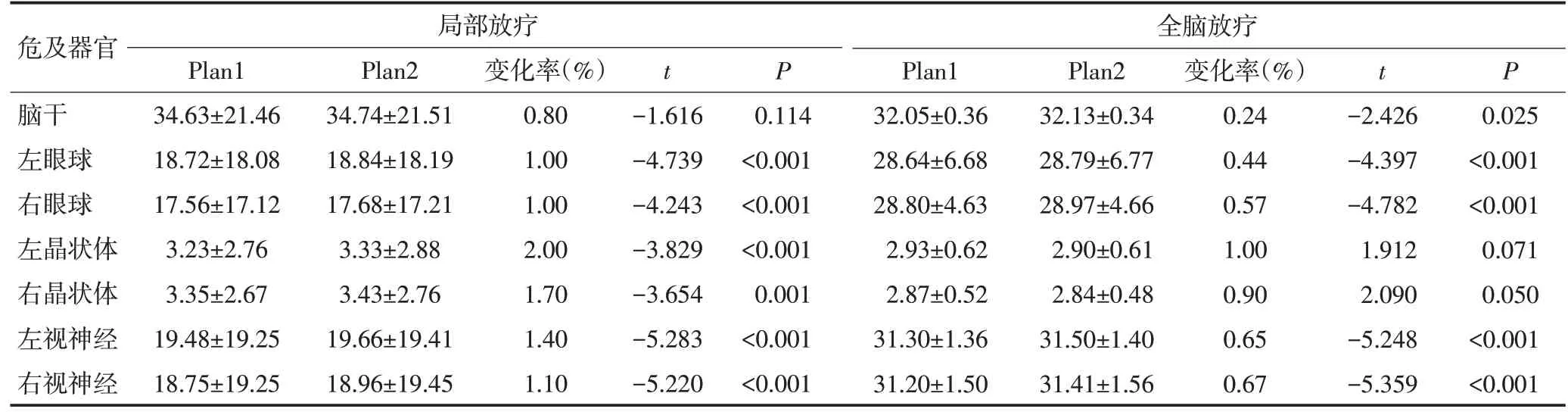
表4 60例患者OARs的Dmax配对比较 (Gy,±s)
危及器官脑干左眼球右眼球左晶状体右晶状体左视神经右视神经局部放疗Plan1 34.63±21.46 18.72±18.08 17.56±17.12 3.23±2.76 3.35±2.67 19.48±19.25 18.75±19.25 Plan2 34.74±21.51 18.84±18.19 17.68±17.21 3.33±2.88 3.43±2.76 19.66±19.41 18.96±19.45变化率(%)0.80 1.00 1.00 2.00 1.70 1.40 1.10 t-1.616-4.739-4.243-3.829-3.654-5.283-5.220 P 0.114<0.001<0.001<0.001 0.001<0.001<0.001全脑放疗Plan1 32.05±0.36 28.64±6.68 28.80±4.63 2.93±0.62 2.87±0.52 31.30±1.36 31.20±1.50 Plan2 32.13±0.34 28.79±6.77 28.97±4.66 2.90±0.61 2.84±0.48 31.50±1.40 31.41±1.56变化率(%)0.24 0.44 0.57 1.00 0.90 0.65 0.67 t-2.426-4.397-4.782 1.912 2.090-5.248-5.359 P 0.025<0.001<0.001 0.071 0.050<0.001<0.001
表5 20例全脑放疗患者PTV剂量指标的配对比较 (Gy,±s)
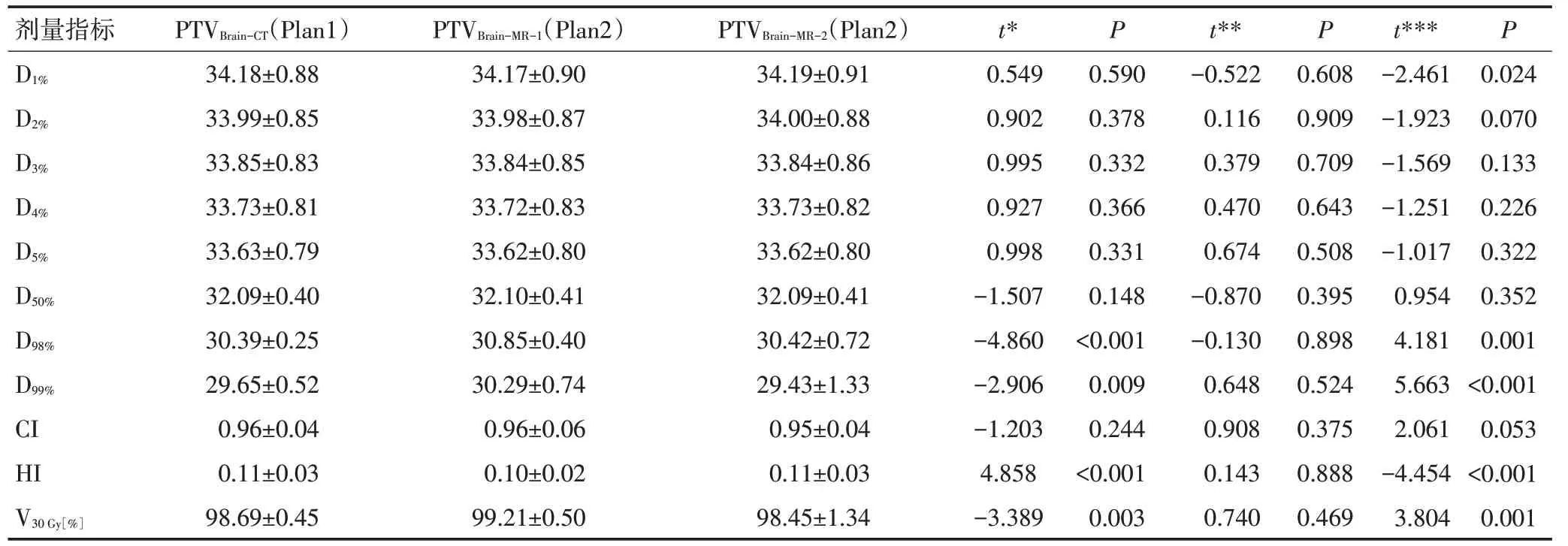
表5 20例全脑放疗患者PTV剂量指标的配对比较 (Gy,±s)
CI:适形度指数;HI:均匀性指数;*:PTVBrain-CT与PTVBrain-MR-1配对比较;**:PTVBrain-CT与PTVBrain-MR-2配对比较;***:PTVBrain-MR-1与PTVBrain-MR-2配对比较
剂量指标D1%D2%D3%D4%D5%D50%D98%D99%CI HI V30 Gy[%]PTVBrain-CT(Plan1)34.18±0.88 33.99±0.85 33.85±0.83 33.73±0.81 33.63±0.79 32.09±0.40 30.39±0.25 29.65±0.52 0.96±0.04 0.11±0.03 98.69±0.45 PTVBrain-MR-1(Plan2)34.17±0.90 33.98±0.87 33.84±0.85 33.72±0.83 33.62±0.80 32.10±0.41 30.85±0.40 30.29±0.74 0.96±0.06 0.10±0.02 99.21±0.50 PTVBrain-MR-2(Plan2)34.19±0.91 34.00±0.88 33.84±0.86 33.73±0.82 33.62±0.80 32.09±0.41 30.42±0.72 29.43±1.33 0.95±0.04 0.11±0.03 98.45±1.34 t*0.549 0.902 0.995 0.927 0.998-1.507-4.860-2.906-1.203 4.858-3.389 P 0.590 0.378 0.332 0.366 0.331 0.148<0.001 0.009 0.244<0.001 0.003 t**-0.522 0.116 0.379 0.470 0.674-0.870-0.130 0.648 0.908 0.143 0.740 P 0.608 0.909 0.709 0.643 0.508 0.395 0.898 0.524 0.375 0.888 0.469 t***-2.461-1.923-1.569-1.251-1.017 0.954 4.181 5.663 2.061-4.454 3.804 P 0.024 0.070 0.133 0.226 0.322 0.352 0.001<0.001 0.053<0.001 0.001
3 讨论
放射治疗对控制BM病灶,延长患者的生存期以及改善生存质量具有重要的意义[6]。CT图像为放射治疗的剂量计算提供骨骼解剖定义和电子密度信息,但使用的连续能谱X射线在穿过颅骨的过程中会出现射线硬化现象,产生杯状伪影,导致CT值及电子密度信息不准确,同时也会掩盖脑等软组织的细节[1-3],这对BM放疗计划设计带来不确定性。
MRI对软组织分辨率高,可以更好地勾画出靠近颅骨的肿瘤靶区以及各种软组织,是颅骨及脑组织病变的主要检查方法,但缺少电子密度信息,无法进行放疗剂量计算[7-11]。因此,应用图像融合,CT/MR的优势得以互补,既能保证靶区的精确覆盖,又能清晰显示更多的组织器官,从而实现精确放疗的目的[7]。采用CT值赋值法进行MR图像放疗计划设计,在放疗中大部分软组织的CT 值在-20~40 HU 之间[12-15]。本研究基于CT/MR 图像确定显示差异区域Skull-sub 并赋予CT 值20 HU,进行放疗剂量的再次计算,以评估BM放疗的剂量学影响。
本研究发现,CT/MR 图像上颅骨的显示差异平均约46%,CT/MR 融合图像上颅骨内外侧约有4 mm的厚度差异,但颅骨的剂量变化率最大仅为3.5%,全脑放疗患者颅骨的剂量学影响略低于局部放疗患者,原因可能是全脑照射的颅骨范围较大,相比局部照射的小范围颅骨影响会更小。另外,PTV的剂量指标除了全脑放疗中HI 平均减少约6.8%,其他指标的变化率均<1.1%,全脑放疗患者PTV的剂量学影响略高于局部放疗患者,原因可能是全脑放疗2 野照射,剂量差异相互补偿较少,且靶区范围较大,处方剂量线与颅骨距离较近,赋予的CT值与真实CT值的差异对放疗剂量的计算也会产生影响,而局部放疗是多野照射(5~7野),多个野之间剂量差异补偿较多,对剂量学影响较小[16]。因此,CT图像对颅骨的显示差异带来的剂量学影响并未超出放疗剂量学的误差要求。
脑组织在CT/MR图像上的显示差异主要在于脑膜,不包含脑膜的Brain-MR-1与Brain-CT的体积差异仅0.8%,说明CT显示的脑未包含脑膜,脑膜被有硬化效应而范围扩大的颅骨所掩盖。因此,PTVBrain-CT在Plan1中与PTVBrain-MR-1在Plan2中的比较,除了HI平均减少约11%,其他剂量指标变化率均<2.2%。而包含脑膜的Brain-MR-2与Brain-CT的体积差异约6.7%,CT/MR融合图像上脑的外侧约有2 mm的厚度差异,说明脑膜的厚度在2 mm 左右。因此,PTVBrain-CT在Plan1 中与PT⁃VBrain-MR-2在Plan2中的比较,除了HI平均升高约2.4%,其他剂量指标的变化率均<0.7%。此外,PTVBrain-MR-1、PT⁃VBrain-MR-2在Plan2中的比较结果和PTVBrain-CT在Plan1中与PTVBrain-MR-2在Plan2中的比较结果基本一致。因此,CT图像对脑组织的显示差异带来的剂量学影响也未超出放疗剂量学的误差要求。MRI是检出脑膜转移瘤的重要方法,疑有脑膜转移时应行增强MRI扫描,而本研究中未见到有明显的脑膜转移者,需加大样本量进一步证实[17-18]。
放疗计划是在靶区给予足够的剂量分布,而靶区周围的正常组织照射最少,以获得最佳治疗效果[5]。本研究中所有患者的靶区覆盖度变化率平均<0.8%,并且均在95%以上,符合临床要求。原因可能是放疗计划中会有一定的剂量容差范围,以保证覆盖整个靶区的范围。OARs 的剂量变化率控制在2%以内。这可能是因为OARs有剂量限制,保证肿瘤靶区与组织器官接受不同的照射剂量,减少OARs的放射损伤[3,6]。全脑放疗患者OARs 的剂量学影响略低于局部放疗患者,原因可能是IMRT为了保证靶区的均匀性及适形性,相对于左右对穿的全脑适形放疗,IMRT 反而会使中间区域的高量增加,降低IMRT 在正常组织保护方面的优势[3]。此外,CI的剂量学影响不显著,而HI剂量学影响较显著,可能由于剂量的限制便于PTV接受处方剂量,剂量差异相互补偿,处方等剂量线与PTV高度重叠,对CI的剂量学影响较小,但靶区的差异,可能对HI的剂量学产生较大影响[5]。
相对于常规CT,双能CT可以直接计算组织的相对电子密度,修正射线硬化伪影,精确定义靶区和关键器官,提高放疗剂量计算的准确性,可能会在图像引导BM放射治疗领域具有较好的应用前景[19-21]。
综上所述,本研究发现颅骨及脑组织在CT/MR上的显示差异显著,虽然未对肿瘤靶区与正常器官的放疗剂量带来显著变化,但对靶区剂量均匀性的影响仍不可忽视。

