金樱子提取液对H2O2诱导HaCaT细胞氧化损伤保护作用研究
刘盈,何嘉祺,颜秋灿,叶菲菲
(中山大学新华学院药学院,广东 广州 510520)
金樱子(RosalaevigataMickx.,RLM)属蔷薇科蔷薇属常绿蔓性灌木,主要药效成分有氨基酸、多糖、黄酮类、三萜类物质及其衍生物等[1-2],其成熟果实可入药,味酸、甘、涩,性平,有补血益精,涩肠止泻之效,可增强免疫力、抗菌消炎、抗病毒、抗氧化、保护肾脏、抗心律失常等药理作用[2-3]。相关研究发现,金樱子果实中的水溶性多糖能够消除阴离子自由基,减轻自由基对细胞膜的破坏引起的溶血[4]。现代对金樱子的化学成分和药理作用研究虽多,其对人体表皮细胞抗衰老的相关研究却甚少。本文以H2O2诱导的人角质形成细胞(HaCaT cell)为模型,研究不同浓度金樱子提取液对HaCaT细胞增殖与凋亡作用的影响,并探讨其抗氧化损伤作用与药物浓度的关系,为今后金樱子在延缓皮肤衰老的研究进程中提供理论参考依据。
1 材料与方法
1.1 材料
1.1.1 细胞 人角质形成细胞(HaCaT cell)细胞株购自美国ATCC公司。
1.1.2 药材 金樱子果实购自广州市大参林药房。
1.1.3 仪器与试剂 旋转蒸发仪(上海市贝仑仪器设备有限公司);超净工作台(青岛海尔公司);5%CO2培养箱(美国Thermo公司);-80 ℃低温冰箱(美国Thermo公司);酶荧光多功能检测仪(美国Biotek公司);细胞培养板(美国Falon公司);荧光显微镜(日本Olympus公司);冷冻干燥机(日本Eyela公司);离心机(Beckman Coulter公司)。CCK-8试剂盒(美国Biosharp公司);Hochest33342试剂(美国Sigma公司);30%H2O2试剂(天津市大茂化学试剂厂);DMEM培养基(美国Gibco公司);10%胎牛血清(德国PAN Biotech公司);PBS粉末(博士德生物),其余试剂均为国产分析纯。
1.2 方法
1.2.1 金樱子提取液的制备 将金樱子干燥果实去核,刮核毛,打粉40目筛。在105 ℃烘箱中干燥10 min得粗粉备用。精密量取金樱子粗粉20 g,置500 mL圆底烧瓶中,加200 mL蒸馏水加热回流1 h。趁热抽滤得滤液1备用;向装有滤渣的烧瓶中加入150 mL蒸馏水,加热回流40 min,趁热抽滤得滤液2。合并滤液1与滤液2,用旋转蒸发仪将提取液浓缩至膏状备用。将浓缩后的提取液用冷冻干燥机进行冻干处理,得到金樱子提取物粉末。
1.2.2 H2O2诱导造模 CCK-8法筛选H2O2浓度的分组为:0、50、100、150、200、250、300 μmol·L-1,每组5个复孔。取培养好的HaCaT细胞,将原培养基吸出后分别加入对应体积的0.03% H2O2溶液和DMEM培养基使每孔体积为200 μL,于37 ℃、5%CO2培养箱内培养作用2 h(损伤造模)。换培养基继续培养24 h,每孔分别加入5 μL CCK-8试剂作用3 h,充分染色后用酶标仪在450 nm波长下检测OD值。细胞存活率通过以下公式计算:
存活率(%)=(OD处理/OD空白)×100%[10]
1.2.3 CCK-8染色法测定细胞增殖水平 以“1.2.2”项下筛选出的H2O2最佳浓度为基础,实验分为空白组、H2O2损伤组、药物预处理组。空白组给予完全培养基;H2O2损伤组加入H2O2溶液使体系终浓度为最佳损伤浓度;药物预处理组分为5个浓度计量组:1、5、10、15、20 μg·mL-1。先按浓度加入金樱子提取物作用预处理2 h,再加入最佳浓度的H2O2溶液作用2 h对HaCaT细胞进行氧化损伤。换培养基终止反应后再在37 ℃、5% CO2培养箱中培育24 h,每孔分别加入5 μL CCK-8试剂作用3 h,充分染色后用酶标仪在450 nm波长下检测OD值。计算每孔中细胞存活率。
1.2.4 Hochest染色观察细胞凋亡 实验分为空白组、H2O2损伤组、药物预处理组(10 μg·mL-1)。通过Hochest33342染色来观察最佳H2O2浓度下氧化损伤后及经过药物预处理HaCaT细胞形态的变化及其凋亡情况。24孔板中的细胞经预处理及培养后,使用PBS缓冲液反复清洗3次,加入Hochest33342试剂染色30 min。使用光学显微镜观察,并拍照。
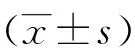
2 结果
2.1 CCK-8染色法筛选H2O2氧化诱导HaCaT细胞最佳浓度 与空白组相比较,H2O2损伤组HaCaT细胞存活率(OD值)均有所下降,H2O2浓度100 μmol·L-1时差异有统计学意义(P<0.05),随着H2O2浓度升高,细胞存活率下降的趋势逐步变小,100 μmol·L-1H2O2为氧化损伤适宜浓度,作为后续实验损伤组中H2O2的加入量,结果见图1。
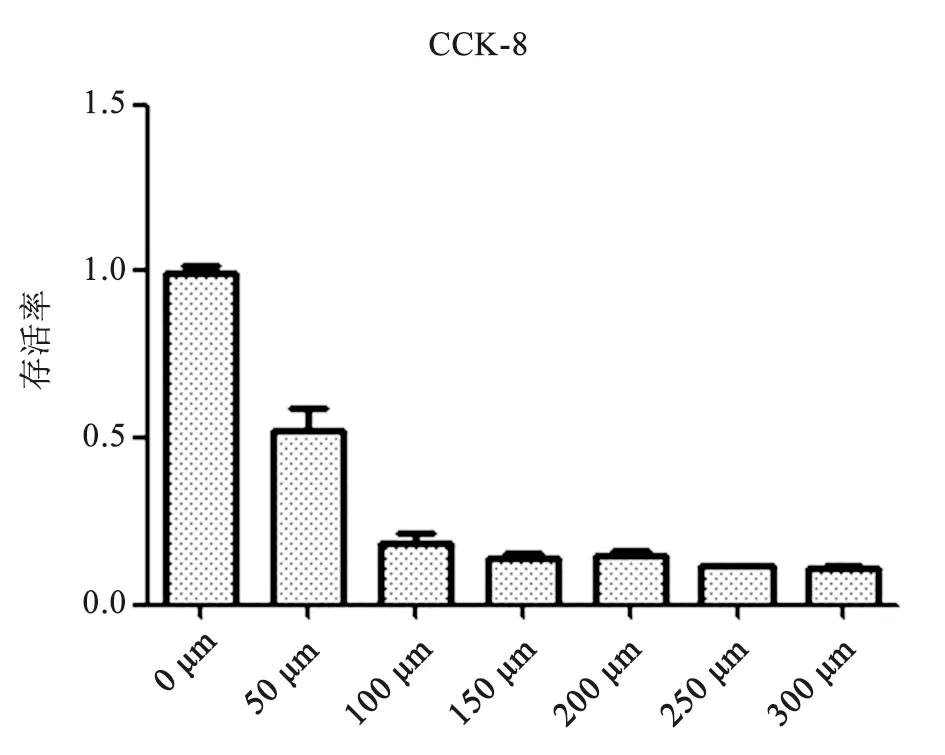
图1 不同浓度H2O2对HaCaT细胞生长的影响
2.2 CCK-8测定细胞增殖水平 与空白组比较,H2O2损伤组HaCaT细胞存活率明显降低,与H2O2损伤组比较,各浓度药物保护组HaCaT细胞存活率明显升高,随金樱子提取液浓度升高,细胞存活率逐渐增大,具有统计学差异(P<0.05),表明金樱子提取液对氧化损伤后的HaCaT细胞有一定的保护作用,结果见图2。
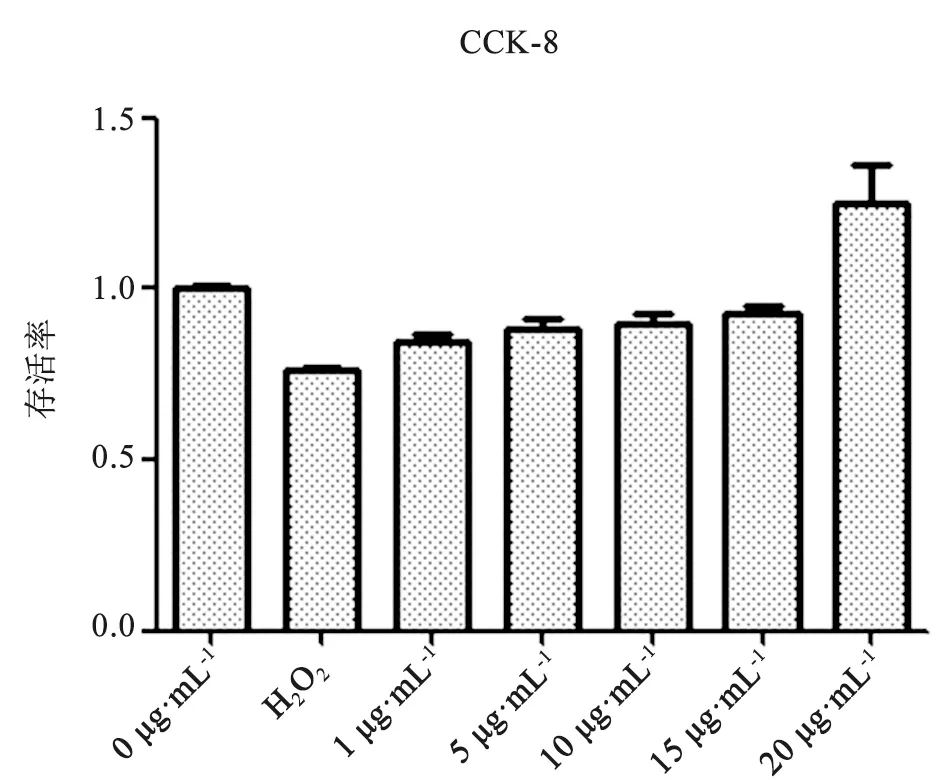
图2 不同浓度金樱子提取物对氧化损伤后细胞存活率的影响
2.3 Hochest染色观察细胞凋亡情况 与空白组比较,H2O2损伤组细胞呈亮蓝色,出现细胞核皱缩,染色质聚集的现象,凋亡细胞数量明显增多,与H2O2损伤组比较,金樱子提取液保护组细胞凋亡数量明显减少,表明金樱子提取液对氧化损伤后的HaCaT细胞凋亡有一定的抑制作用,结果见图3。
A.空白组;B.H2O2处理组;C.金樱子提取物作用组图3 金樱子提取物作用后HaCaT细胞凋亡情况
3 讨论
近年来,随着环境的恶化,皮肤健康问题越来越严重,各种因素都可以致使皮肤衰老,自由基氧化是引发皮肤衰老损伤的重要原因之一[5]。当机体遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive oxygen species,ROS)产生过多,导致氧化系统和抗氧化系统失衡,从而引起组织损伤,ROS 被认为是造成氧化应激的主要原因[6-7],包括氧自由基和非自由基的含氧产物,如羟自由基(-OH)、超氧阴离子(O2-)、脂质过氧化物(ROO-、 RO-与ROOH)及过氧化氢(H2O2)等[8]。金樱子果实中的水溶性多糖和总黄酮均具有良好的抗氧化能力,能消除超氧阴离子自由基,减轻自由基对细胞膜的破坏而引起的溶血[4]。金樱子总黄酮可通过抑制凋亡和炎症反应,防治H2O2的氧化损伤,也可显著改善局部缺血再灌注造成的急性肝肾损伤[9]。H2O2易在机体内产生超氧自由基,从而破坏生物膜,引起DNA突变,破坏蛋白质的结构。有研究表明,H2O2能够诱导细胞凋亡,使用低浓度的H2O2预处理后,细胞的凋亡率明显增加[10]。体外H2O2能诱导并加速细胞因氧化应激损伤所致的衰老进程。因此,本研究以不同浓度的金樱子提取液对HaCaT细胞进行预处理,CCK-8实验结果表明不同浓度金樱子提取液预处理2 h后,其细胞活力(OD值)有显著提高,随浓度升高细胞活力增强,表明金樱子提取液对H2O2诱导的HaCaT细胞具有一定的增殖作用,且在一定浓度范围内作用强度随浓度升高而增大。Hochest染色法检测金樱子提取液对细胞凋亡的影响,结果显示H2O2损伤组较空白组出现更多的细胞出现细胞核皱缩,细胞质聚集等典型的细胞凋亡特征,在药物保护组中细胞凋亡现象明显减少,表明金樱子提取液可以抑制经H2O2氧化损伤造成的HaCaT细胞凋亡。综上所述,金樱子提取液对H2O2诱导的HaCaT细胞氧化应激损伤具有一定的保护作用,其发挥抗氧化作用的机制还有待于进一步研究。

