PARP14在3种抑郁症模型小鼠海马区的表达升高及其与神经炎性反应的关系
李 辰,修建波,许 琪
(中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系 医学分子生物学国家重点实验室,北京 100005)
抑郁症(depressive disorder)是一种发病时表现为情绪低落、兴趣减退和愉悦感丧失等症状的精神疾病[1]。虽然近年来已发现多种抑郁症的治疗手段,但传统的抗抑郁药对大多数患者不能起到很好的效果。PARP14是聚腺苷二磷酸核糖聚合酶(poly-adenosine diphosphate-ribose polymerase, PARP)18个家族成员之一,它可以将ADP核糖从NAD+分子中裂解出并转移到目标蛋白上,实现该蛋白的翻译后单ADP核糖基化修饰。已有临床研究提示一些原批准用于恶性肿瘤治疗的PARP家族抑制剂在抑郁症治疗中的潜力[2],而PARP家族成员在抑郁症中的表达量变化尚未见报道。
除了在DNA损伤修复、抑制癌中发挥作用外[3],PARP14被发现是一类参与炎性反应调控的分子,如调控巨噬细胞炎性反应、促进B细胞生存等[4-5]。而神经炎性反应假说长久以来被认为是导致抑郁症的主要机制之一,抑郁症患者外周和中枢神经系统中具有较高水平的促炎细胞因子,例如白介素1β(IL-1β),肿瘤坏死因子α(TNF-α)等[6]。小胶质细胞作为中枢神经系统中重要的固有先天免疫细胞,其功能异常与抑郁症发生密切相关[7]。本研究旨在探究PARP14与抑郁症的相关性及其在小胶质细胞炎性反应过程中起到的作用。
1 材料与方法
1.1 材料
1.1.1 动物:用于建模的8周雄性C57BL/6J小鼠购于北京维通利华实验动物技术有限公司,饲养于北京协和医学院基础学院实验动物中心。
1.1.2 细胞培养:小鼠永生化小胶质细胞系BV2为本实验室保存。
1.1.3 主要试剂:脂多糖(lipopolysaccharide,LPS)(L8880, Solarbio公司);PARP14抗体及siRNA(sc377150 & sc76057, Santa Cruz公司);GeA-69(HY-108708, MCE公司);细胞培养用胎牛血清(04-001-1ACS, BI公司); DMEM、0.25%胰蛋白酶、青霉素链霉素(CC15019、CC017、CC004,迈晨公司);转染试剂Lipofectamine 2000与Lipofectamine RNA iMAX(11668019 & 13778150, Thermo Fisher Scientific公司);Trizol(15596018, Invitrogen公司);cDNA合成试剂盒(04379012001, Roche公司)。
1.2 方法
1.2.1 抑郁症动物模型的建立:1)慢性束缚模型[chronic restraint(CRS) model]模型建立按照文献[8]执行,将18只小鼠随机分为实验组和对照组,每组9只。将实验组小鼠连续21 d随机时间放入塑料管中(每天4~6 h)进行建模,对照组无处理,建模结束后进行行为学测试及样本收集;CRS建模同时,将18只小鼠随机分为6组,每组3只,分别束缚0、1、3、5、7、14 d后取脑组织样本。2)慢性不同预知压力模型[chronic unpredictable mild stress(CUMS)model]使用实验室前期建模存留样本[9]。3)LPS模型[lipopolysaccharide(LPS) model]建立按照先前文献[10]执行,将8只小鼠随机分为实验组和对照组,每组4只,实验组小鼠腹腔注射LPS 1 mg/kg,对照组小鼠注射0.9%氯化钠溶液,24 h后收集小鼠海马组织。
1.2.2 行为学检测:强迫游泳测试(forced swim test, FST)和糖水偏爱测试(sucrose preference test, SPT)被用于测试模型小鼠的抑郁样行为。强迫游泳测试可以反映出小鼠行为上的绝望,测试时将小鼠放入透明的1 000 L烧杯中,用录像设备记录小鼠6 min内的行为,计数后4 min小鼠的不动时间;糖水偏爱测试前3 d小鼠进行双瓶饮水训练(一瓶正常饮水、一瓶1.5%蔗糖溶液),测试前24 h禁水,测试时允许动物自由摄取水或蔗糖溶液,2 h后记录并计算小鼠的蔗糖偏爱度:蔗糖偏爱度(sucrose preferences,%)=蔗糖消耗量/总消耗量×100%。
1.2.3 细胞培养及处理:BV2细胞系以56 ℃预处理1 h、含10%胎牛血清的培养基培养于37 ℃、5% CO2浓度的细胞培养箱中,隔天传代。BV2细胞转染质粒或siRNA时接种至六孔板,培养18~24 h后按转染试剂说明书进行转染,每组设置3个复孔,过表达组转染pcDNA3.1-PARP14质粒,过表达对照组转染pcDNA3.1-EGFP质粒;敲低组转染PARP14 si RNA,敲低对照组转染阴性对照si RNA。分别于转染后6、24 h换液,38~44 h后加入200 nmol/L LPS,LPS处理6 h后收集细胞进行后续实验。抑制剂组于细胞接种后40 h加入250 nmol/L PARP14抑制剂GeA-69,无抑制剂对照组加入DMSO,处理2 h后再加入200 nmol/L LPS,LPS处理6 h后收集细胞。
1.2.4 RNA提取与基因表达量检测:取新鲜海马组织液氮速冻后保存于-80 ℃直至使用。RNA提取使用Trizol匀浆和氯仿层分离法分离RNA。用转录本cDNA合成试剂盒将1 μg RNA反转录为cDNA进行后续RT-qPCR检测。检测引物见表1,结果以2-ΔΔCt进行相对定量计算。

表1 RT-qPCR检测引物Table 1 Primers for RT-qPCR
1.3 统计学分析
使用GraphPad Prism6.0和SPSS软件对实验数据进行统计分析,两组数据使用Student’st检验进行组间差异分析;多组数据使用单因素方差分析,组间值使用q分析;使用Person相关性检验进行相关性分析。
2 结果
2.1 抑郁症模型小鼠海马区PARP14表达水平升高
强迫游泳实验和蔗糖偏爱实验证实CRS模型组相比对照组表现出明显的绝望及快感缺失等抑郁样表型(P<0.01)(图1A,B)。CRS模型小鼠海马区中的PARP14蛋白及mRNA表达水平皆显著高于对照组(P<0.05)(图1C~E)。同时,PARP14蛋白和mRNA表达水平在束缚第14天时显著升高(P<0.05)(图1F,G)。此外,在CUMS模型海马区也观察到PARP14蛋白表达水平相较于对照组显著升高(P<0.05)(图1H,I)。
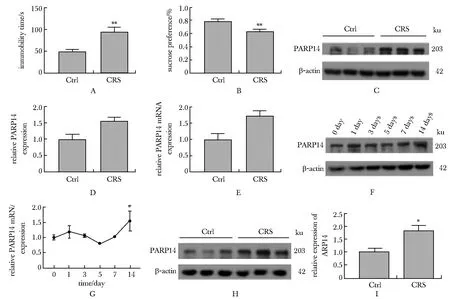
Male C57BL/6 mice were exposed to chronic restraint (CRS) model or chronic unpredictable mild stress (CUMS) model induction; A,B.CRS- treated mice and control(Ctrl) mice behaviors: A.forced swim tests, B.sucrose preference tests(n=9); C,D.PARP14 levels in hippocampus of CRS/Ctrl mouse brains, n=3 experimental replicates/group; E.PARP14 mRNA levels in hippocampus of CRS/Ctrl mouse brains(n=5); F,G.PARP14 protein and mRNA levels in mice hippocampus at different restraint time points (0D: CRS 0 day, 1D: CRS 1 day, 3D: CRS 3 day, 5D: CRS 5 day, 7D: CRS 7day dand 14D: CRS 14 day), #P<0.05 compared with CRS 0 day group; H,I.PARP14 levels in hippocampus of CUMS/Ctrl mouse brains(n=3); *P<0.05, **P<0.01 compared with Ctrl group图1 CRS和CUMS模型海马区PARP14的表达水平升高Fig 1 PARP14 levels were increased in the hippocampus of CRS and CUMS
2.2 PARP14与神经炎性反应相关
在CRS模型小鼠海马组织中,炎性因子IL-1β mRNA表达水平显著高于对照组(P<0.05)(图2A),且PARP14与IL-1β mRNA表达水平正相关(r=0.868,P<0.05)。LPS模型小鼠海马中,PARP14 mRNA和蛋白表达也显著上调(P<0.05)(图2B,C)。BV2细胞中,PARP14 mRNA表达水平在LPS刺激3、6和12 h后均有显著升高(P<0.01)(图3A);同时,PARP14蛋白表达水平在LPS处理6 h后显著升高(P<0.05)(图3B,C)。
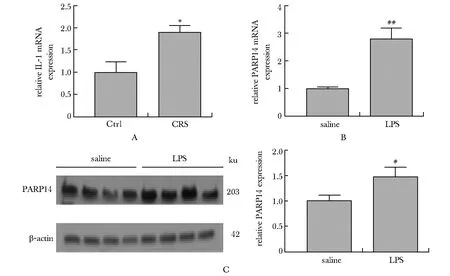
A.IL-1β mRNA levels in the hippocampus of CRS/Ctrl mouse brains; B.PARP14 mRNA levels in the hippocampus of mice treated with LPS or saline; C.PARP14 protein levels in hippocampus of LPS/control mouse brains; *P<0.05 compared with Ctrl group; #P<0.05, ##P<0.01 compared with saline group图2 PARP14表达水平与神经炎性反应相关Fig 2 PARP14 expression was related to neuroinflammatory n=4)
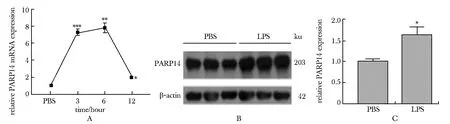
A.PARP14 mRNA expression in BV2 cells with LPS treated in different times(0, 3, 6, 12 hours); B,C.PARP14 expression in PBS and LPS group(PSB: BV2 cells treated with PBS in 6 hours, LPS: BV2 cells treated with LPS in 6 hours; *P<0.05, **P<0.01, ***P<0.001 compared with PBS group图3 BV2细胞LPS刺激后PARP14表达水平升高Fig 3 PARP14 levels were up-regulated in LPS treated BV2 n=3)
2.3 BV2细胞中过表达PARP14增强LPS诱导的炎性反应
BV2细胞中,过表达组PARP14 mRNA水平显著升高(P<0.001)(图4A)。经6 h LPS处理,PARP14过表达组产生的促炎细胞因子TNF-α mRNA显著升高(P<0.01)(图4B),同时抑炎细胞因子白介素10(IL-10) mRNA表达有下降的趋势,但无统计学意义(图4C)。
2.4 BV2细胞中敲低Parp14和抑制剂处理降低LPS诱导的炎性反应
在BV2细胞中,敲低组PARP14 mRNA表达水平与对照组相比显著降低(P<0.05)(图4D)。与过表达组相反,敲低组LPS处理后促炎细胞因子IL-1β mRNA表达水平显著低于对照组(P<0.05), 且IL-10mRNA水平有升高趋势,但无统计学意义(图4E,F)。LPS刺激BV2细胞后,PARP14抑制剂GeA-69处理相较于无抑制剂对照组,其促炎因子IL1-β mRNA表达水平显著降低(P<0.01)(图4G),同时TNF-α mRNA表达水平也表现出下降趋势,但无统计学意义(图4H,I)。
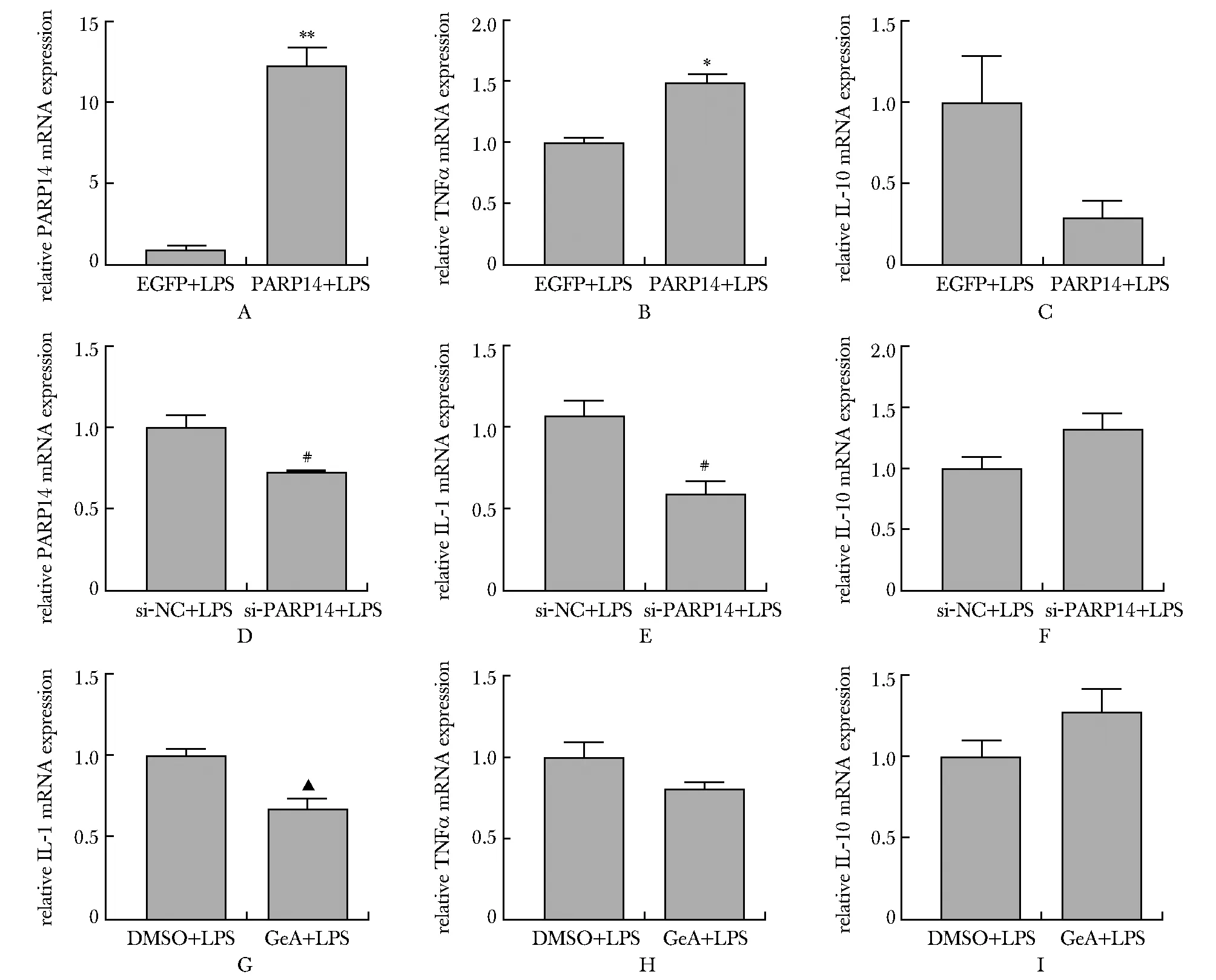
A.PARP14 mRNA expression in EGFP+LPS/PARP14+LPS group(EGFP+LPS: BV2 cells over-expression EGFP and then treated with LPS, PARP14+LPS: BV2 cells over-expression PARP14 and then treated with LPS); B.TNF-α mRNA expression in EGFP+LPS/PARP14+LPS group; C.IL-10 mRNA expression in EGFP+LPS/PARP14+LPS group; D.PARP14 mRNA expression in si-NC+LPS/si-PARP14+LPS group(si-NC+LPS: BV2 cells transfected with si-NC and then treated with LPS, si-PARP14+LPS: BV2 cells transfected with si-PARP14 and then treated with LPS); E.IL-1β mRNA expression in si-NC+LPS/si-PARP14+LPS group; F.IL-10 mRNA expression in si-NC+LPS/si-PARP14+LPS group; G.IL-1β mRNA expression in DMSO+LPS/GeA+LPS group(DMSO+LPS: BV2 cells pre-treated with DMSO before treated with LPS, GeA+LPS; BV2 cells pre-treated with 250 nmol/L GeA-69 before treated with LPS); H.TNF-α mRNA expression in DMSO+LPS/GeA+LPS group; I.IL-10 mRNA expression in DMSO+LPS/GeA+LPS group; *P<0.01, **P<0.001 compared with EGFP+LPS group; #P<0.05 compared with si-NC+LPS group; ▲P<0.01 compared with DMSO+LPS group图4 BV2细胞中过表达PARP14增强LPS诱导的炎性因子表达Fig 4 PARP14 levels were up-regulated in hippocampus of LPS induced depression models and LPS treated
3 讨论
海马作为边缘系统的重要组成部分,与许多情绪相关的脑区(如前额叶皮层和杏仁核)形成神经纤维连接,是当前抑郁障碍相关研究较多的一个脑区[11]。本实验通过对CRS和CUMS两种慢性应激小鼠模型海马中PARP14的mRNA和蛋白表达水平进行分析,发现慢性应激会引起PARP14表达升高,证实了海马区PARP14表达水平与抑郁症的相关性。同时,本研究发现CRS模型海马区存在IL-1β mRNA表达水平的升高,这与神经炎性假说中慢性应激引发神经炎性反应的观点相符[6]。重要的是,本研究也发现了PARP14 mRNA表达水平与IL-1β mRNA表达水平呈正相关,提示PARP14可能会通过影响神经炎性反应从而对抑郁症产生影响。本研究在LPS模型中的发现也进一步验证了PARP14与神经炎性相关的假设。
由于小胶质细胞是中枢神经系统中最重要的炎性反应细胞类型,在慢性应激情况下,与抑郁症相关的大脑区域小胶质细胞从静止状态变为活动状态,这也被认为是造成压力期间中枢神经系统炎性反应的重要原因[12]。当使用LPS刺激小胶质细胞时,也观察到了PARP14蛋白及其mRNA表达水平的升高,这提示PARP14可能在小胶质细胞中发挥作用从而影响神经炎性反应。当改变小胶质细胞PARP14表达后观察到了其响应LPS刺激后炎性反应的变化, PARP14在小胶质细胞中的过表达可以以通过增加促炎基因的表达,从而增强小胶质细胞的炎性反应;而Parp14在小胶质细胞中的敲低或抑制可以通过抑制促炎基因的表达从而抑制小胶质细胞的炎性反应。
综上所述,本研究首次发现PARP家族的macro亚家族成员PARP14与抑郁症的相关性,并提示其可能通过调控小胶质细胞活化而对抑郁样行为产生影响,但其影响小胶质细胞炎性反应的机制仍然有待研究。虽然之前已发现一些以抑制PARP1为主的PARP家族抑制剂在一些案例中起到了缓解抑郁症症状的作用[2]。但不同于PARP1介导的多聚ADP核糖基化修饰的广泛作用[13],PARP14介导的单ADP核糖基化修饰作用可能更为特异,因此其特异性抑制剂潜在的副作用可能也会更小。本研究表明PARP14很有可能成为抑郁症治疗有希望的靶标。

