饲料中丁酸钠添加水平对草鱼生长、脂代谢及健康的影响
晏显芳,张 明,郭 盼,李 杨,于海波,吉 红,周继术
(西北农林科技大学,陕西 杨凌 712100)
草鱼(Ctenopharyngodonidella)是一种重要的淡水养殖鱼类,大约占全球淡水养殖业的16%(Wang et al, 2015)。目前,在世界范围内的淡水养殖鱼类中,草鱼的产量最高(张露等,2016)。草鱼由于其生长速度快、肌肉品质细腻鲜美、养殖效益好等优点深受广大消费者和养殖户的青睐。然而,随着草鱼高密度养殖模式的普及和高能饲料的普遍使用,其肝脂代谢紊乱及肠道损伤情况越来越多见,肝脏变性、脂肪肝等疾病频繁发生,严重影响鱼体的健康状况。
丁酸属短链脂肪酸,可作为肠道上皮的直接能量来源,还具有重要的生理调控作用;不仅可促进小肠黏膜的生长发育,增强黏膜的通透性,修复受损肠道上皮细胞,增加绒毛的宽度,提高小肠消化吸收功能,还能促进肠道上皮细胞增殖,并修复肠道受损部位,从而促进肠道健康。由于丁酸具有挥发性及特殊气味,在生产上常用丁酸钠替代。已有研究表明,丁酸钠能改善鲤鱼、罗非鱼与鲫鱼的肠道健康,但在草鱼饲料中尚未见相关报道。研究还发现,丁酸通过降低胰岛素的敏感性,从而降低小鼠白色脂肪组织中的脂质积累;而这种抑制脂质蓄积的作用未能在小鼠的肝脏和肌肉组织中发现。丁酸在鱼类或在草鱼中是否也具有相应的调节脂质蓄积的作用,相关报道较为缺乏。
为探索丁酸钠对草鱼生长、脂代谢及健康状况的影响,本研究在草鱼饲料中添加不同水平的丁酸钠,通过56 d的饲养试验及检测相关指标,以期探索丁酸对草鱼生长、脂质代谢、肠道组织结构、免疫应答的影响,为丁酸钠在草鱼饲料中的适宜添加水平提供基础资料。
1 材料和方法
1.1 试验饲料
试验饲料所用的基础饲料原料由鱼粉、豆粕、菜粕、棉粕、豆油等组成。丁酸钠由新奥生物科技有限公司(福建省厦门市)提供。在基础饲料中分别添加0、500、1000 mg Kg-1丁酸钠,制成等氮(约36%粗蛋白)和等能(约6%粗脂)的三组试验饲料(SB0、SB500及SB1000)。将饲料原料粉碎,过60目筛,混匀后,由饲料颗粒机制成直径2 mm的颗粒饲料。饲料在室温下风干12 h后-20℃保存备用。饲料配方成分和常规营养成见表1。
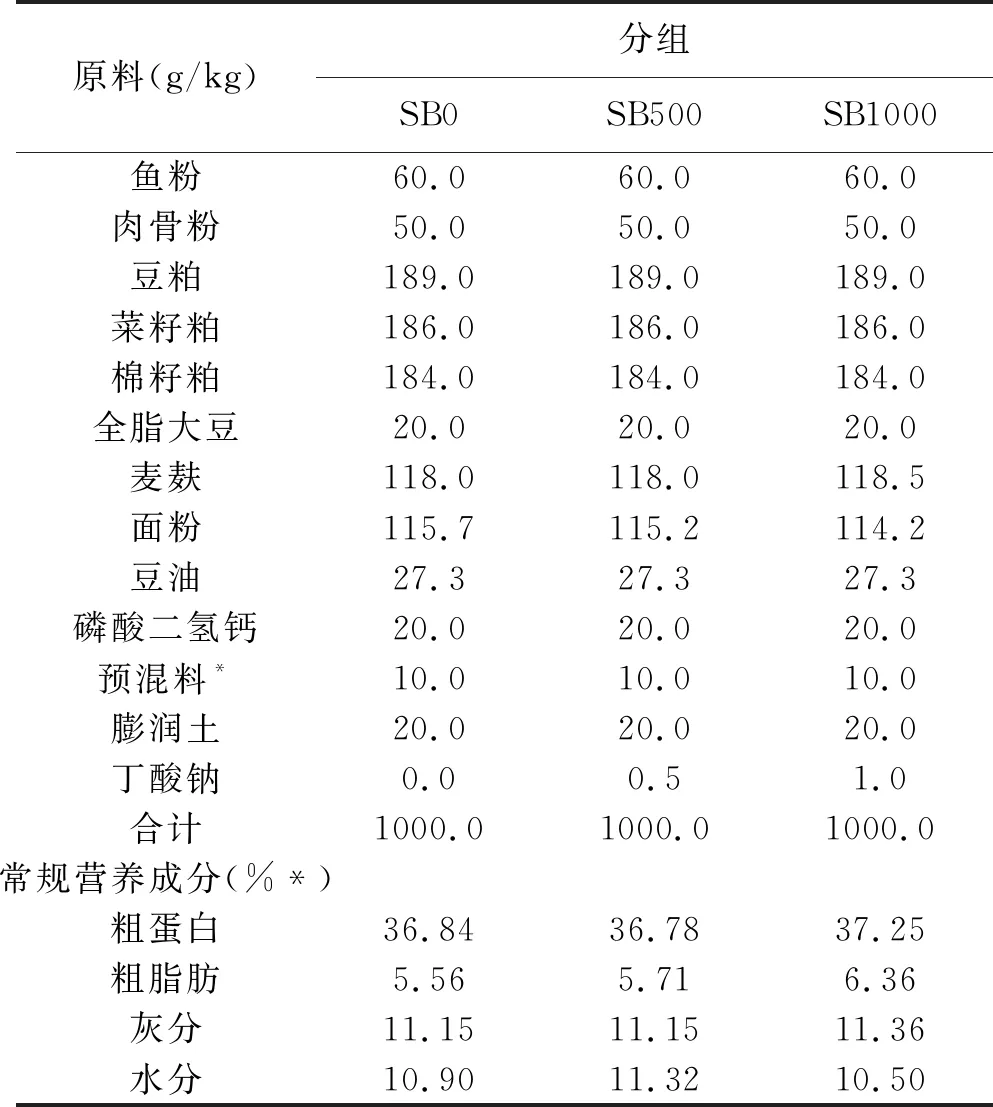
表1 试验饲料配方组成以及常规营养成分(风干基础)
1.2 试验鱼的分组及饲养管理
将153尾草鱼(14.10±0.60 g)随机分为3个组,每组三个重复,每个重复17尾,养殖于9个循环流水养殖缸(130 L)中,分别饲喂以上三组试验饲料。预饲三周后,进行正式饲喂。饲养试验中,每天投饲3次(8∶30、12∶30、16∶30),投饲率为2%~3%,饲养周期为56 d。保持流水水量5 L min-1,定期检测相关水质参数。试验期间,水温25.50±2℃,pH 7.65±0.20,溶解氧7±0.50 mg L-1,硝酸盐0.09±0.01 mg L-1。
1.3 采样
饲喂结束后,饥饿24 h,然后用三胺甲基磺酸盐(MS-222, 0.06 g L-1)麻醉。进行尾静脉采血,保存在4℃冰箱中,6 h后离心(1 000 rpm,10 min)制备血清。将每尾鱼称重并解剖,分别剖取草鱼肝胰脏、腹脂、肠、肾和脾,分别称重。按以下公式进行鱼体生长及生物学性状的计算。
特定生长率Specific growth rate(SGR)= (ln终重- ln初重)/饲养时间(d)×100;
投饲量Feed intake(F1,%,鱼/d) =饲料总消耗量(g);
饲料系数Feed conversion ratio(FCR)=饲料投饲量(g)/鱼体增重量(g);
肥满度Condition factor(CF,g/cm3%)=体重(g)/体长(cm)3×100;
肝脏指数Hepatopancreas index(HSI,%)=肝胰脏重量(g)/鱼体重(g)×100;
脾脏指数Spleen index (SI,%)=脾脏重量(g)/体重(g)×100;
肠长比Relative intestine length (RIL, %)=肠长(cm)/鱼体长(cm)×100;
内脏指数Viscerosomatic index(VSI,%)=内脏重量(g)/体重(g)×100;
肠体质量比Intestinal index (II, %)=肠重(g)/体重(g)×100;
腹脏脂肪指数Intraperitoneal fat index(IFI, %)=腹腔内脂肪重量(g)/体重(g)×100;
存活率Survival rate (SR, %)=末期鱼数量/初始鱼数量(g)×100;
将每箱3尾鱼的肝胰脏和小肠冻存于液氮中,并于-80℃保存,用于分析与免疫应答相关的基因表达。每箱取3尾鱼的肠道收集到5 mL离心管中,冷冻于液氮中,-80℃保存,用于肠道菌群分析。另外2尾鱼切除肝胰脏、肠和肌肉,保存于-20℃,进行常规营养成分分析。同时,将另外3尾鱼的肝胰脏和中肠固定在多聚甲醛溶液中进行HE染色及组织学观察与分析。
1.4 血清生化指标测定
采用全自动生化分析仪(日立7180,东京,日本)对草鱼血清进行分析。血清生化指标包括丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、葡萄糖(Glu)、胆固醇(Chol)、甘油三酯(TG)。
1.5 饲料和鱼肉的常规营养成分检测
检测并分析了饲料和鱼体肝胰脏、肌肉和肠道的常规营养成分,其中粗蛋白含量用凯氏定氮法,粗脂肪含量用乙醚抽提法,粗灰分含量马弗炉550℃灼烧法进行测定,具体方法见AOAC(2000)。
1.6 肝胰及肠道组织的HE染色观察
将固定后的肝胰脏和小肠于自来水中洗涤12 h,然后常规乙醇脱水和二甲苯平衡,随后,按照之前所述的标准组织学程序,用纱布包裹样品(Liu et al, 2016) ,再使用旋转切片机(RM2235,德国莱卡)连续切割厚5 μm的石蜡切片,有苏木精和伊红染色(H&E)染色。使用倒置显微镜(OPTEC)拍摄切片组织样品。
1.7 实时定量检测基因相对表达量
分别从3尾鱼的肝胰脏和肠组织中检测tlr22和myd88基因的表达。使用TRNzol试剂(TaKaRa,中国大连)提取草鱼肝胰脏和肠组织中总RNA。用所需量的无酶水溶解RNA,在260 nm~280 nm用电泳2%琼脂糖凝胶和UV-Vis光谱仪检测RNA的质量和数量。在20 μL的反应体积内,将清洗后的总RNA反向转录1 μg制备所有的cDNAs。qRT-PCR使用CFX 96实时PCR检测系统(Bio-Rad, Hercules, CA, USA)进行。PCR反应的总体积为20μL,其中每个引物0.6μL(10μM),cDNA 1μL,2×SYBR Premix Ex TaqTMII 10 μL,无酶双蒸水7.8 μL。循环条件为:95℃ 3 min, 95℃ 15 s,60℃ 30 s, 65℃ 5 s,38次循环。目的基因tlr22及myd88的引物序列见表2。采用 (Livak and Schmittgen 2001)中描述的相对定量方法计算基因相对表达量。

表2 实时定量PCR中使用的引物
1.8 肠道微生物区系检测
分析肠道菌群时,使用PowerSoil DNA分离试剂盒从鱼粪混合样本中提取总DNA。采用琼脂糖凝胶电泳检测DNA质量,纳米滴检测DNA纯度,然后用引物338F(5’- ACTCCTACGGGAGGCAGCA-3’)和806R(5’- GGACTACHVGGGTWTCTAAT-3’)扩增16S rRNA基因的V3-V4区。扩增产物采用磁珠纯化法纯化。对纯化后的产物进行Solexa PCR,再用1.8%琼脂糖凝胶在120V恒压下电泳40 min,使用IlluminaHiSeq 2500 (Biomarker,北京,中国)切除、纯化并测序相应的条带。
1.9 统计分析
试验数据以平均值±标准差(Mean±SD)表示。结果采用单因素方差分析,所有分析均使用PASW Statistics 18(SPSS,IL,USA)进行,然后进行Duncans检验,P<0.05为差异显著。
2 结果
2.1 草鱼生长性能和生物学参数
饲养8周后,SB1000组草鱼脏体比(VSI)显著低于对照组(P< 0.05);SB500和SB1000组草鱼腹脂指数(IFI)显著低于对照组(P<0.05);其它指标,如草鱼初始体重(IBW),特定生长率(SGR)、饲料转化率(FCR)、肥满度、肝胰脏指数及脾脏指数等在各组间均无显著差异(P> 0.05)。
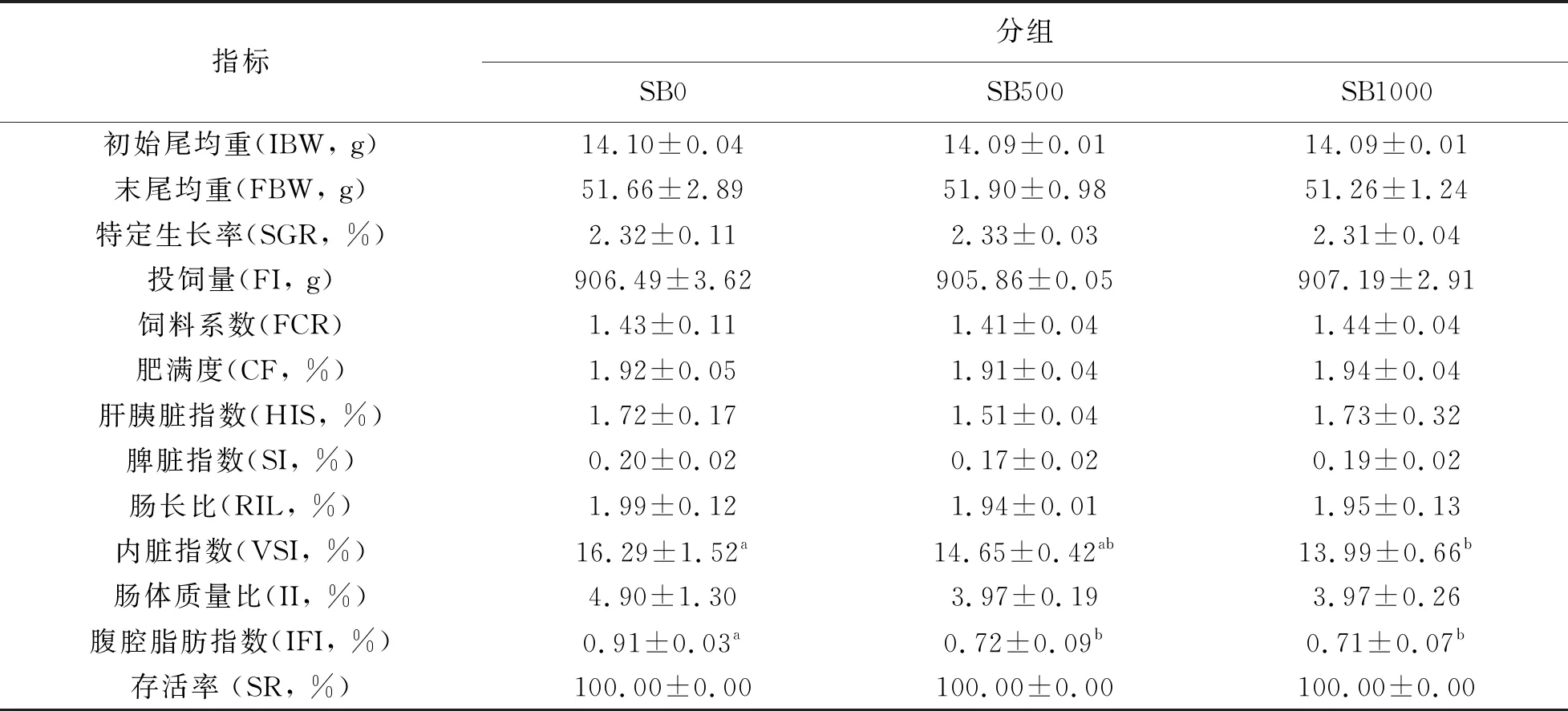
表3 丁酸盐对草鱼生长性能和生物学指标的影响(n=3)
3.2 血清生化指标
血清生化指标检测表明,SB500组的草鱼血清TP和Chol水平显著低于对照组(P<0.05);SB1000组草鱼的血清GLO水平显著高于SB500组(P<0.05),而大部分草鱼血清ALT、AST、ALB、GLU、TG、Chol等,不受丁酸钠添加水平的影响(P>0.05)。
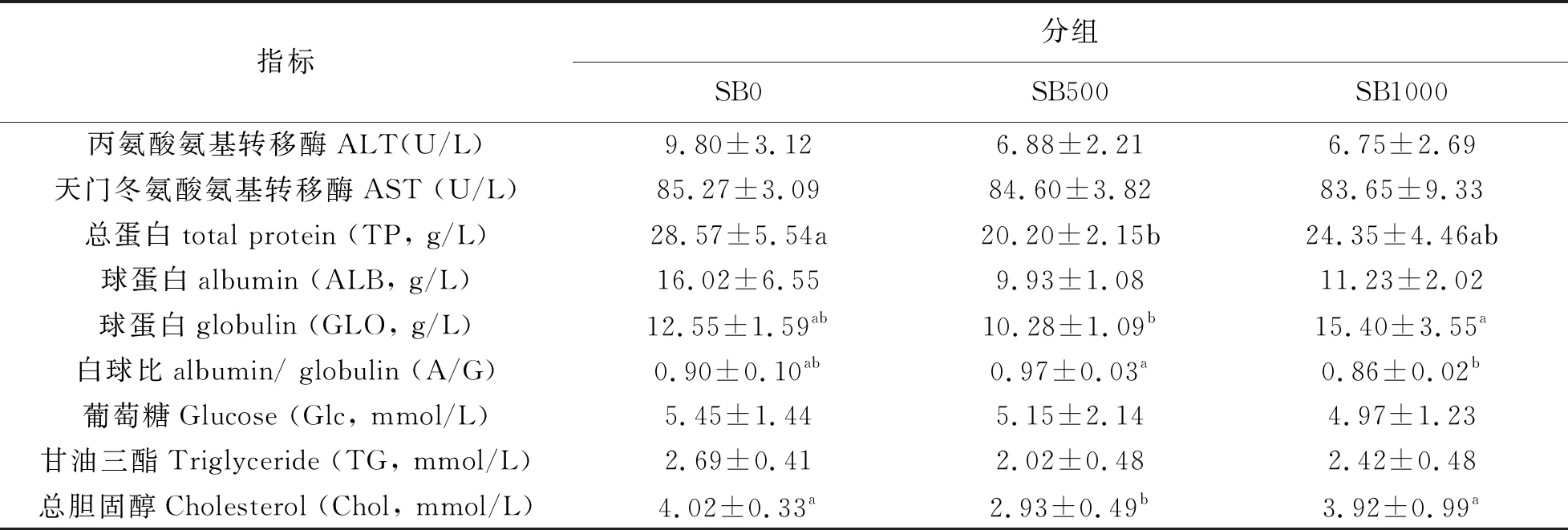
表4 丁酸盐对草鱼血清生化指标的影响(平均值±SD,n=3)
3.3 鱼体常规营养成分测定
在草鱼肌肉和肝胰脏中,SB500和SB1000组的粗蛋白和粗脂质含量均显著低于对照组(P<0.05)肌肉粗灰分含量在SB500和SB1000组中显著升高(P<0.05)。SB1000组小肠粗蛋白含量高于对照组(P<0.05);但丁酸盐的添加对小肠粗脂质含量无明显降低作用(P> 0.05)。
3.4 组织学观察
肝胰脏HE染色观察显示,与对照组相比,丁酸盐的添加(SB500及SB1000组)使草鱼肝胰脏中的白色空泡状的脂滴面积和数量有减小的趋势。
肠道HE染色观察显示,丁酸盐的添加,草鱼肠道绒毛高度呈上升趋势;通过对草鱼肠道绒毛高度的测定,结果显示,SB500和SB1000等丁酸盐的添加水平,均显著增加了草鱼肠道中肠绒毛高度(P<0.05)。
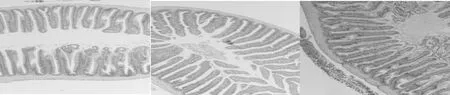
图2 草鱼肠道HE染色观察(n=3)
3.5 基因相对表达量检测
丁酸钠的添加显著提高了基因tlr22和myd88在肝胰脏中的相对表达量(P<0.05),这种表达量的升高在SB500和SB1000组间无显著差异(P>0.05)(图4)。丁酸钠的添加对基因tlr22和myd88在肠道组织中相对表达量无显著影响,各组间基因tlr22和myd88mRNA相对表达量无显著差异(P>0.05)(图5)。
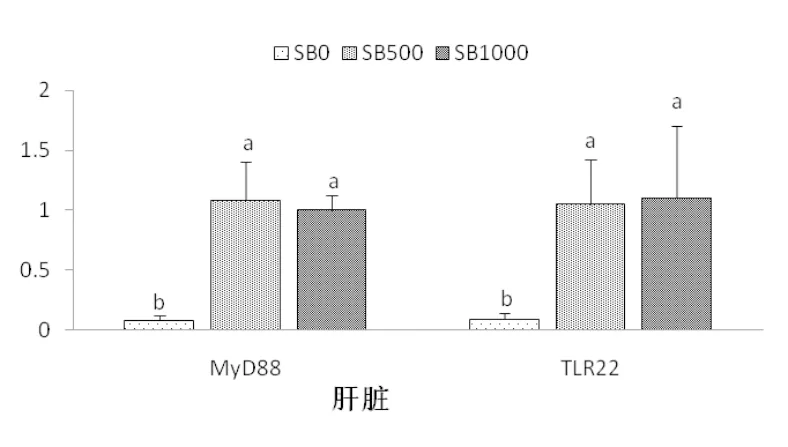
图4 草鱼肝脏基因tlr22和myd88的相对表达量(n=3)
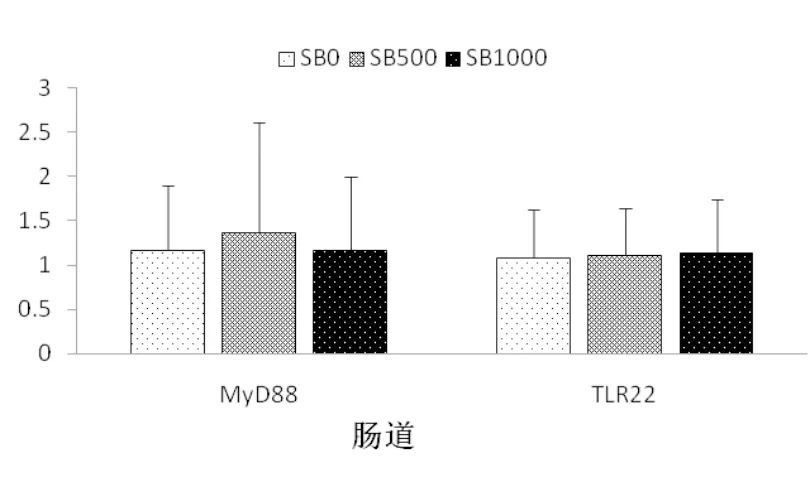
图5 草鱼肠道组织tlr22和myd88的基因相对表达量(n=3)
3.6 肠道菌群
结果显示,不同水平丁酸盐对草鱼肠道细菌群落的总序列无显著影响(P>0.05)。SB1000组肠道菌群ACE指数和操作分类学单位(OUTs)均显著高于对照组(P<0.05)。与对照组相比,SB1000组肠道细菌群Simpson多样性指数无显著差异,但该组的Shannon多样性指数显著低于对照组(P<0.05,表6)。

表6 草鱼肠道微生物菌群的细菌多样性指数(n=3)
对草鱼肠道内菌群在分类为门上的分析表明,肠道内优势菌种为梭杆菌(Fusobacteria)和变形杆菌(Proteobacteria),其中梭杆菌占总菌数的30%~70%,且丁酸钠的添加有增加梭杆菌占比的趋势,但与对照组相对差异并不明显(P>0.05)。变形杆菌为第二优势菌,占比10%~40%,且该菌受丁酸钠的影响,表现为SB1000显著降低了变形杆菌在总菌群中的占比(P<0.05,图6)。
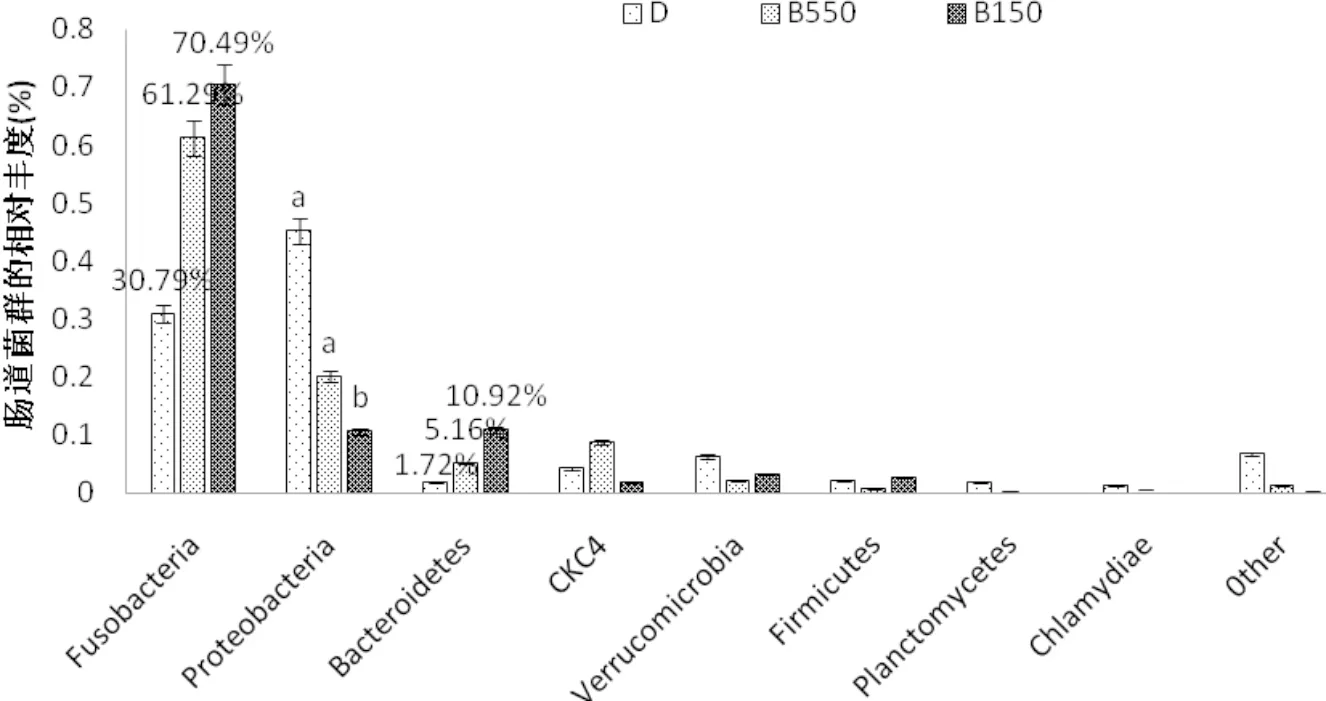
图6 草鱼肠道微生物菌群在门类水平上的相对丰度(n=3)
对草鱼肠道内菌群在分类为属上的分析表明,醋酸杆菌cetobacterium为草鱼肠道优势菌种,占比为44%~70%,拟杆菌Bacteroidetes为第二优势菌,占比在10%以内(图7)。结果表明,丁酸钠的添加对醋酸杆菌与与拟杆菌的占比无显著影响,但有提升的趋势。SB0组(44.68%)相比,虽然纳入SB500(60.46%)和SB1000(70.24%)后Cetobacterium的相对丰度有增加的趋势,但差异无统计学意义(P>0.05)。与SB0组(0.39%)相比,补充theSB500组(2.94%)和SB1000组(9.68%)似乎增加了拟杆菌的相对丰度,但增加无统计学意义(P>0.05)。
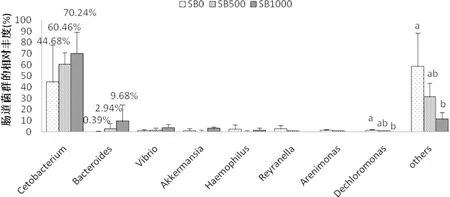
图7 草鱼肠道微生物菌属水平的相对丰度(n=3)
3 讨论
4.1 丁酸盐对草鱼生长的影响
研究发现,饲料中添加2 000 mg·kg-1的丁酸钠可以提高草鱼幼鱼的生长、抗氧化能力和肠道吸收能力(Liu et al,2016)。在本试验研究发现,丁酸钠在草鱼饲料中的添加,各组之间草鱼的生长性能没有显著差异,这与丁酸盐在草鱼(Liu et al,2016)、大西洋鲑鱼(Bjerkeng et al, 1999)和非洲鲶鱼(Owen et al.,2006)的研究结果一致。本试验结果与Liu等(2016)在草鱼中的报道不相一致的原因,可能与该研究用了较高的丁酸钠添加水平(2 000 mg kg-1)有关,而本研究中最高的丁酸钠添加水平仅为1 000 mg kg-1。
4.2 丁酸盐对草鱼脂质蓄积的影响
本研究显示,SB500和SB1000组的腹腔脂肪指数显著低于对照组(表2),同时丁酸钠的添加使草鱼具有较低的内脏指数,显示出丁酸钠具有抑制腹腔脂肪蓄积的作用。这在C57BL/6小鼠的白色脂肪组织中,丁酸盐也显示了相似的抑制脂肪蓄积效果(Zhouet al,2016);这可能与短链脂肪酸抑制脂肪分解并诱导“褐变”,增加产热能力,从而导致机体脂肪减少(Sahuri-Arisoylu et al,2016)有关,也可能与短链脂肪酸介导的GPR43被激活,而该GPR43的激活抑制了脂肪细胞中的胰岛素信号,从而抑制了脂肪组织中脂肪的堆积(Kimura et al, 2013)有关。
在本试验结果显示,SB500和SB1000的鱼的肝胰腺和肌肉中发现脂质积累显著减少(表5,图1)。这与许多研究的发现相一致,如小鼠研究(Jin et al , 2016;Zhou et al, 2016;Sahuri-Arisoylu et al,2016;Kimura et al, 2013;Khan et al, 2016)。Sahuri-Arisoylu等(2016)报道,短链脂肪酸在肝脏中减少脂质积累,改善肝功能,并提高线粒体效率。短链脂肪酸介导的GPR43激活抑制胰岛素介导的脂肪积累,从而通过抑制多余能量的积累和促进脂肪消耗来调节能量平衡(Kimura et al, 2013)。SB可以对直接和/或间接参与脂质代谢的各种调控基因和/或蛋白质进行微调(Khan et al, 2016)。因此,不同水平的SB可以提高线粒体效率,从而导致肝区和肌肉的减少。
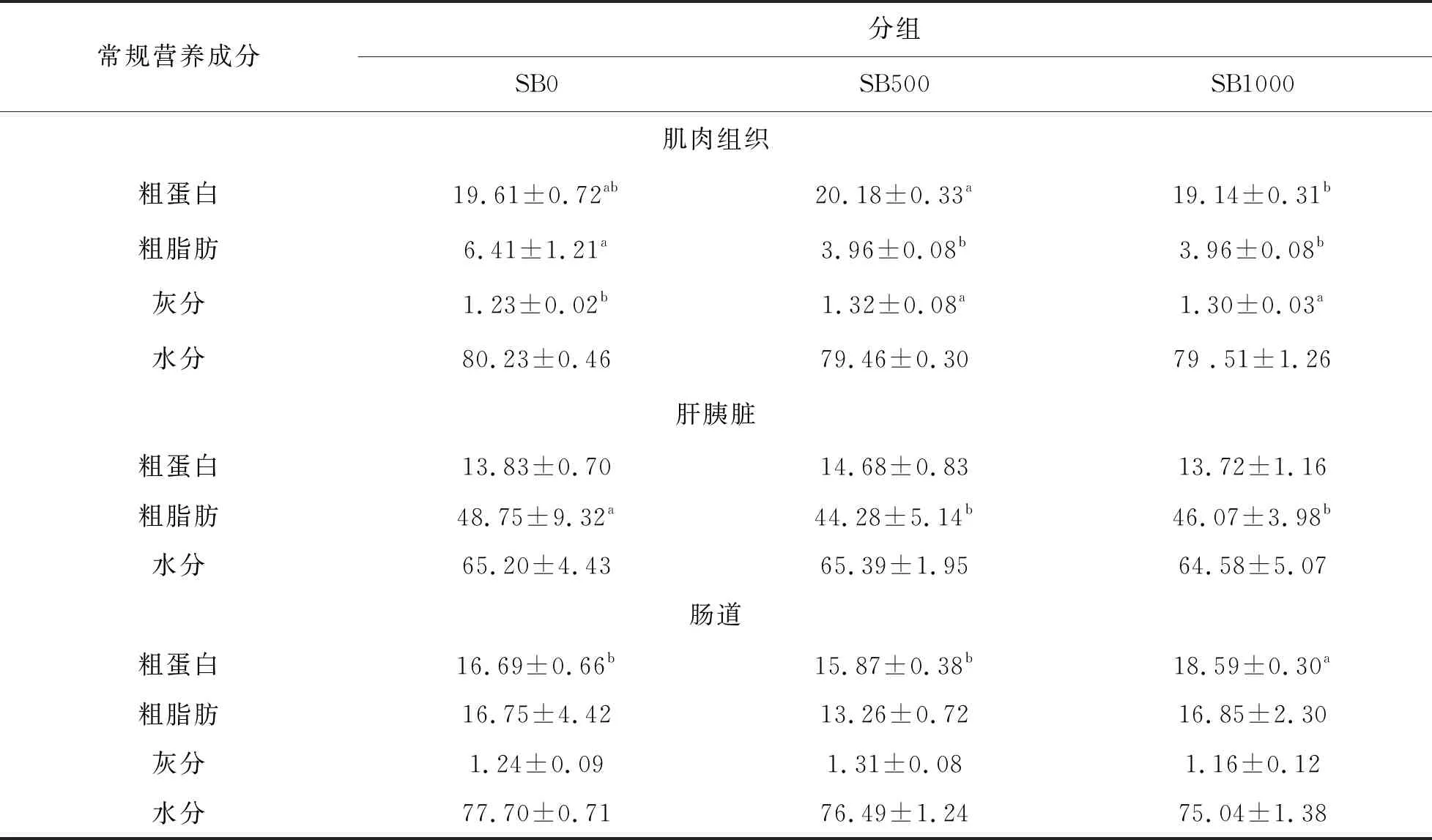
表5 丁酸盐添加水平对草鱼组织中常规营养成分的影响 (鲜样,%;n=3)

图1 草鱼肝胰脏HE染色观察
在水平试验中,SB1000促进了蛋白在肠内的沉积。丁酸盐似乎增加了几种必需氨基酸和核苷酸衍生物的可用性。此外,使用丁酸盐作为燃料可能会降低葡萄糖和氨基酸氧化,从而增强肠细胞的能量供应(Robles et al,2013)。据我们所知,SB是一种膳食HDAC抑制剂,HDACs调节组蛋白乙酰化,一种控制染色质结构的表观遗传修饰(Mathew et al,2010)。此外,丁酸盐的添加逆转了极端日粮(Benedito-Palos et al , 2016)喂养的鱼的肌肉中蛋白分解(CDH15、CAPN3、PSMA5、PSMB1、UBE2N)的上调表达(Benedito-Palos et al,2016)。因此,SB似乎是通过下调肌肉中蛋白分解相关基因的表达而增加蛋白质含量的。然而,在饲喂分级SB水平的草鱼中,肌肉的粗蛋白和脂质没有显著差异(Liu et al,2016)。这些不同的结果可能是由于鱼的大小和养殖条件的差异所致,相关问题尚需进一步研究。
4.3 丁酸盐对草鱼机体健康
4.3.1 丁酸盐对草鱼血清生化指标的影响 在水平试验中,血清AST和ALT的活性一般与肝损伤有关,其升高时是肝坏死的标志(Wang et al, 2015)。本研究结果显示,丁酸钠的添加水平对血清谷丙转氨酶和谷草转氨酶活性无显著影响,显示出该SB添加水平对草鱼肝胰脏健康无负面影响。
研究发现,血清总蛋白和白蛋白反映了机体对营养物质的吸收、合成和分解。血清总蛋白和白蛋白的减少是机体营养不良、肝脏疾病和炎症的反应(Artacho et al, 2007)。血液中GLO含量是保持机体健康和维持正常免疫功能的主要因素,体现了先天免疫机能(Talpur et al,2014)。本试验显示,与饲喂对照饲料的鱼相比,SB500组的血清总蛋白水平显著降低,但SB1000组鱼体血清总蛋白升高,表明添加较高水平SB对草鱼机体健康更有益。本研究结果显示,与SB500组相比,SB1000组的草鱼血清GLO水平明显更高,间接说明在先天免疫方面,SB1000饲料可能优于SB500饲料。Kurihara等(1985)发现,SB可以诱导成骨细胞MC3T3-E1细胞中GLO的合成。Ahmed等人(2015)报道,在3 g/10 kg日粮中添加SB会导致OreochromisNiloticus的总蛋白、白蛋白和GLO增加。此外,我们发现,A/G(蛋白-球蛋白比值)在SB1000组中明显低于SB500组。SB1000组的GLO水平可能是所有组中最高的。在研究中,我们发现,在SB500组中,Chol水平显著降低,提示草鱼体内脂质运输水平显著降低。各研究组血清TG无差异。因此,SB的低水平可能会抑制草鱼的脂溶或破坏胆固醇的合成能力。此外,SCFAs激活GPR43促进其他组织中多余能量的利用,而不是将多余能量作为脂肪储存在脂肪组织中,从而维持代谢稳态(Kimura et al,2013)。然而,在类型试验中,本研究表明,不同类型的SB处理对草鱼血清生化指标没有影响,这间接说明不同类型的SB可能不会影响草鱼血清生化指标。在小鼠(Zhou et al, 2016)和裂头海鲈 (Estensoro I et al,2016)中发现相似的结果,血清TG、Chol和Glc无显著差异。Ju 等(2015)发现补充不同类型的SB不会影响血清TP、白蛋白和GLO含量。因此,对于SB对血清生化指标的影响似乎没有共识。
4.3.2 丁酸盐对草鱼肠道健康及微生物菌群的影响 肠是鱼类营养物质吸收的主要场所,而肠绒毛在这一过程中发挥着重要作用。本试验结果显示,饲喂不同水平丁酸钠,草鱼中肠的绒毛高度均显著上升(图3),说明不同水平SB均能改善草鱼的肠道结构。Liu(2014)在鲤鱼和Hassanin(2015)在兔中也报道了类似的结果。SB似乎可以为肠上皮细胞提供能量,促进水和钠的吸收,从而增加肠上皮细胞的增殖和十二指肠黏膜的生长(Zuo et al,2013;Guilloteau et al, 2010;Huet al,2007)。
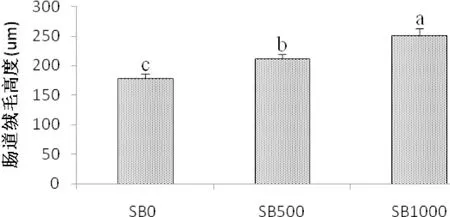
图3 丁酸钠添加水平对草鱼肠道绒毛高度的影响(μm)
4.3.3 丁酸盐对草鱼免疫机能的影响 骨髓分化因子88(myd88)是一个类似适配器样的蛋白质,参与受体(IL-1R)及toll样受体(tlr22)介导的核激活因子(NF-κB)(Lin et al, 2015)。在本试验中,myd88和 tlr22的mRNA相对表达量在SB500及SB1000组的肝胰脏中均较高(图4),表现出丁酸钠的添加促进了草鱼的免疫应答能力,这在欧洲海鲈(Terova et al,2016)及雄性大鼠(Mattace et al, 2013)中也有相似的发现。组蛋白去乙酰化酶(histone deacetylase,HDAC)是一类蛋白酶,对染色体的结构修饰和基因表达调控发挥着重要的作用。Sheikh 等(2016)报道了myd88的乙酰化作用,通过调节tlr依赖信号通路到细胞因子基因,进而影响HDAC抑制剂的抗增殖作用。因此推测,丁酸盐改善草鱼肝胰脏免疫应答的功能可能与丁酸钠是HDAC抑制剂有关。
研究显示,丁酸盐改善草鱼免疫应答的功能还具有组织特异性,因为在本试验中,丁酸钠的添加对草鱼肠道myd88和tlr22的相对表达量无显著影响(图5),表现出丁酸钠不影响肠道的免疫应答机能,这在欧洲海鲈(Terova et al,2016)的研究中也有类似发现,但与在鲤鱼的研究结果不一致,在鲤鱼的研究中发现,鲤鱼饲料中添加丁酸钠可以显著改善肠道的免疫应答(Liu et al, 2014)。饲料丁酸钠对不同鱼类肠道组织的免疫反应影响的差别,与鱼的种类、鱼的大小、养殖条件及丁酸钠的添加水平差异有关,相关问题尚需进一步研究。
4.3.4 丁酸盐对草鱼肠道菌群的影响 目前,丁酸盐对肠道菌群影响的研究主要集中在有益或有害细菌丰度的变化上,而对淡水鱼肠道微生物菌群多样性的影响,研究并不充分。本试验结果显示,SB1000组的Shannon指数显著降低(表6),说明SB1000可以降低肠道微生物种群多样性(Wang et al, 2012)。研究表明,饲料中添加SB1000会降低草鱼肠道的pH,从而导致肠道细菌的膜损伤(Hoseinifar et al.,2017),随着孵育时间的延长,细菌细胞不仅会失去重要离子,还会失去细胞质中的溶质,从而导致菌体的生长受到抑制,严重情况下导致细菌生存能力的丧失(Hu et al,2007;Guilloteau et al,2010)。此外,Lu等(2008)还发现,补充1 000 mg·kg-1SB可显著减少肠道的梭状芽胞杆菌和大肠杆菌的活菌数。而在SB1000中ACE指数明显低于对照组,说明SB1000可以显著增加肠道细菌丰度。然而,Liu等(2014)发现添加300mg kg-1的SB不能提高普通鲤鱼肠道菌群的丰度,这种差异可能与丁酸钠对肠道菌群丰度的影响存在剂量反应效应有关。在本试验中,鲸杆菌(Cetobacterium)和拟杆菌(Bacteroides)的相对丰度有随着丁酸盐的添加而有增加的趋势,且该两种菌在SB1000组的相对丰度最高(表6),表现了丁酸盐提高了该菌在草鱼肠道中的定植,这在鸡(Biagi et al, 2007)等动物中也发现了类似的效果。拟杆菌门中的拟杆菌属在糖类代谢、营养物质吸收、健康的维持和上皮细胞的成熟与维持等方面发挥着非常重要的作用(Hooper et al,1999; Eckburg et al,2005)。鲸杆菌是梭杆菌中的一种,它在鱼的消化过程中发挥着关键的作用(Lyons et al, 2017)。醋酸是鲸杆菌从蛋白质或碳水化合物(Finegold et al, 2003)中得到的主要最终产物。微生物群落的微小差异可能是由于肠黏膜形态和免疫应答的改变所致(Liu et al, 2014)。此外,变形菌(Proteobacteriain)在SB1000组中的相对丰度显著低于对照组(图6),这可能与环境或宿主因素的变化,如低纤维日粮和急性或慢性炎症,体内平衡被破坏,具有选择性,并导致肠道内变形细菌大量繁殖的生态失调(Shin et al, 2015)有关。综上所述,在饲料中添加丁酸钠1 000 mg·kg-1,可抑制草鱼脂质积累,提高其免疫力,促进其健康。

