大鼠骨髓间充质干细胞特异性核酸适配子的筛选和鉴定*
洪 昊, 李 昭, 董念国△
1华中科技大学同济医学院附属协和医院心脏大血管外科,武汉 4300222阜外华中心血管病医院心血管外科,郑州 451464
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是主要存在于骨髓组织中具有多向分化潜能甚至横向分化潜能的一种成体干细胞,由于其取材方便、创伤较小,体外增殖能力强,易于外源基因转染和表达,自体移植不易发生免疫排斥反应,几乎无伦理学问题等优点,已经成为细胞治疗、再生医学、器官移植等领域的研究热点[1]。尽管关于BMSCs生物学特性的研究越来越多,但因其缺乏特有的表面标记分子,使得分离、筛选和鉴定较为困难,目前常用方法如密度梯度离心法、差速贴壁筛选法等均不能很好地满足实验要求。此外,BMSCs在骨髓中的含量极低,只有不到0.05%的骨髓细胞能表现出BMSCs的特性,很难满足组织工程研究的需要[2]。因此,建立对其进行有效分离、筛选和鉴定的方法极为重要。本研究采取指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)[1],获得大鼠BMSCs的特异性核酸适配子(aptamer),从大鼠骨髓细胞中快速分离和筛选出BMSCs,并对核酸适配子与大鼠BMSCs的结合方式及能力进行鉴定,为其进一步应用于组织工程,招募、捕获靶细胞提供新的思路和方法。
1 材料与方法
1.1 主要材料
DMEM低糖培养液(美国Hyclone),胎牛血清(美国Gibco),0.25% EDTA-Trypsin(美国Gibco),青霉素-链霉素双抗(美国Gibco),BSA(美国Sigma),抗大鼠CD29、CD31、CD45、CD90抗体(美国Abcam),DNA文库、上游引物、下游引物、FAM-上游引物、Biotin-下游引物(美国Invitrogen),HiFi SuperMix(日本TaKaRa),100 bp DNA ladder(日本TaKaRa),DNA产物纯化试剂盒(日本TaKaRa),琼脂糖凝胶DNA回收试剂盒(日本TaKaRa),TA克隆试剂盒(美国Invitrogen),X-gal(美国Invitrogen),酵母tRNA(美国Invitrogen),Dynabeads M-280链霉亲和素磁珠、磁力架及磁珠缓冲液(美国Invitrogen)。Balb/c小鼠来源BMSCs(美国ScienCell),人来源BMSCs(美国ScienCell)。健康4周龄SD大鼠4只,SPF级(华中科技大学同济医学院实验动物中心)。
1.2 大鼠BMSCs的制备
颈椎脱臼法处死大鼠(SD大鼠,4周龄),无菌条件下取股骨和胫骨,用PBS冲洗3次。剪掉股骨和胫骨两端干骺端,显露骨髓腔,用无菌注射器吸取配制好的细胞培养液,反复冲洗骨髓腔,收集冲出的骨髓制成单细胞悬液,离心后丢弃上清,加入细胞培养液接种于细胞培养瓶,置于37 ℃、5% CO2细胞培养箱中培养。差速贴壁法纯化,第72 h全量换液后每2~3天全量换液。第7~10天第1次传代,之后每6天传代1次。取第3代生长状态良好的BMSCs,制成细胞悬液,分别加入抗大鼠CD29、CD31、CD45、CD90抗体,流式细胞仪(美国BD Bioscience公司)检测抗体表达。
1.3 SELEX
1.3.1 DNA文库及引物的设计 本研究的起始DNA文库及所用引物(美国Invitrogen公司)序列为:5′-ATACCAGCTTATTCAATT-60-nt-AGATAGTAAGTGCAATCT-3′;上游引物:5′-ATACCAGCTTATTCAATT-3′;下游引物:5′-AGATTGCACTTACTATCT-3′。首先进行PCR最佳循环数及退火温度的优化,反应体系包括HiFi SuperMix(2×) 50 μL,上、下游引物(均为100 μmol/L)各0.4 μL,模板10 μL,加水至总体积100 μL。PCR反应条件:94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸30 s,分别进行16、18、20、23、25轮循环;最后72℃延伸10 min。选择明亮清晰、没有非特异性扩增条带对应的循环数为扩增最佳循环数。对PCR扩增退火温度进行优化,反应条件如前所述,循环数取前述实验确定的最佳循环数,退火温度分别为:49℃、50℃、51℃、52℃、53℃,产物进行电泳分析,确定最佳退火温度。
1.3.2 SELEX反复筛选获得各轮DNA文库 取第3代SD大鼠BMSCs制成细胞悬浮液,进行细胞计数。将DNA文库与靶细胞在1 mL筛选缓冲液中混合,孵育、离心后得到细胞沉淀,然后纯化DNA,使用获得的DNA进行PCR,反应体系含HiFi SuperMix(2×) 180 μL,FAM-上游引物(100 μmol/L)25 μL,Biotin-下游引物(100 μmol/L)25 μL,模板500 μL,加水至总体积1 mL,反应条件同上述优化条件。磁珠洗涤,使用紫外分光光度计检测260 nm波长处单链DNA(ssDNA)的浓度,至此SELEX第1轮筛选结束,产物于-20℃条件下贮存。取第1轮获得的ssDNA作为第2轮筛选的DNA文库,重复上述各步骤,反复进行筛选,获得各轮适配子。
1.3.3 流式细胞术检测各轮文库与靶细胞的结合用0.25%胰酶消化贴壁生长的第3代BMSCs,收集细胞悬浮液、计数、离心,加入筛选洗脱液冲洗2次,用筛选缓冲液重悬细胞使细胞密度达到1×106/μL。每个流式管中加入50 μL细胞悬液和待检测的DNA文库,DNA终浓度均为200 nmol/L,随后在37℃恒温摇床孵育30 min,筛选洗脱液冲洗2次,加入200 μL筛选缓冲液重悬细胞,流式细胞仪检测各流式管中细胞荧光强度,以未筛选DNA文库(lib)作为阴性对照组。
1.3.4 荧光共聚焦成像检测各轮文库与靶细胞的结合 用0.25%胰酶消化贴壁生长的第3代BMSCs,收集细胞悬浮液,接种细胞于铺有细胞爬片的6孔板内;培养3 d后,加入1 mL PBS冲洗2次,用1~2 mL 4%多聚甲醛固定15 min;固定结束后加入PBS冲洗3遍,用1%BSA封闭30 min;加入PBS冲洗2次,随后分别加入未筛选DNA文库、第5轮文库及第9轮文库孵育60 min;加入PBS冲洗2次,DAPI染液染色5~10 min;加入PBS冲洗3次,滴甘油缓冲液1滴,封片,荧光显微镜拍照。
1.3.5 克隆测序及候选适配子的确定 使用BioEdit软件对所有序列进行分析,将重复次数在2次及2次以上的所有序列挑选出来,使用RNA structure对DNA二级结构进行预测。进行流式细胞术检测,统计与靶细胞结合的平均荧光强度以及空白细胞组的荧光强度,按公式(Faptamer-Fcell)/(Flib-Fcell)计算每个序列与靶细胞的相对荧光强度。
1.3.6 候选适配子与靶细胞解离常数Kd的定量 将候选适配子分别稀释成0、4、8、16、32、64、128、256 nmol/L的浓度,取第3代SD大鼠BMSCs制成细胞悬浮液,分别加入不同浓度候选适配子,流式细胞仪检测,以未筛选文库作为阴性对照。统计每个浓度候选适配子与靶细胞结合后的平均荧光强度,去除背景的荧光强度,与适配子的浓度代入公式Y=BmaxX/(Kd+X)中,使用SigmaPlot软件绘制解离曲线,测得每个候选适配子对BMSCs的Kd值。
1.3.7 适配子apt7的细胞选择性 分别取第3代生长状态良好的BMSCs(分别为SD大鼠、Balb/c小鼠以及人来源),制成细胞悬液,加入适配子apt7,DNA终浓度为200 nmol/L,37℃摇晃孵育30 min;离心并冲洗2次,200 μL PBS重悬细胞并转移至流式管中,4℃避光保存,流式细胞仪检测,以大鼠外周血单核细胞(PBMCs)作为阴性对照。
2 结果
2.1 大鼠BMSCs的制备
培养5~7 d的BMSCs形态见图1。细胞传至第3代时,流式细胞术检测SD大鼠BMSCs表面分子标记CD29、CD31、CD45、CD90,其中CD29(97.9%)及CD90(99.1%)表达阳性,CD31(4.56%)及CD45(5.50%)表达阴性,与国际上公认的BMSCs表型一致,证明本研究获取的BMSCs纯度已达到较高水平,可以作为靶细胞用于适配子筛选。

图1 大鼠BMSCs在光镜下呈扁平纺锤状(×100)Fig.1 BMSCs of rats show a flat spindle-like morphology under light microscope(×100)
2.2 基于SELEX的大鼠BMSCs特异性适配子筛选
PCR优化的反应条件为94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸30 s,分别进行16、18、20、23、25轮循环;最后72℃延伸10 min,PCR产物进行电泳。结果显示25轮可作为PCR的最佳循环数。进一步对PCR退火温度进行优化,退火温度分别为:49℃、50℃、51℃、52℃、53℃,结果显示53℃为PCR的最佳退火温度。
2.3 流式细胞术检测各轮DNA文库与靶细胞的结合
SELEX每2轮筛选采用流式细胞术检测各轮DNA文库与BMSCs的结合能力,用未筛选DNA文库(lib)作为阴性对照(图2)。随着筛选的进行,与BMSCs特异性结合的序列逐渐保留下来,得到扩增,非特异性序列逐渐被丢弃,文库与BMSCs结合能力逐渐上升,流式细胞仪检测到的荧光强度升高,对应的流式曲线右移。在前7轮筛选中BMSCs细胞表面的荧光强度显著增加,提示随着筛选的反复进行,特异性序列得到极大的富集。第9轮筛选文库与细胞结合的荧光强度同第7轮相比并没有显著的增加,提示特异性序列已得到最大程度的富集,继续进行筛选反而会导致特异性序列的丢失,因此,我们认为BMSCs特异性适配子在第9轮获得最大程度的扩增与富集。
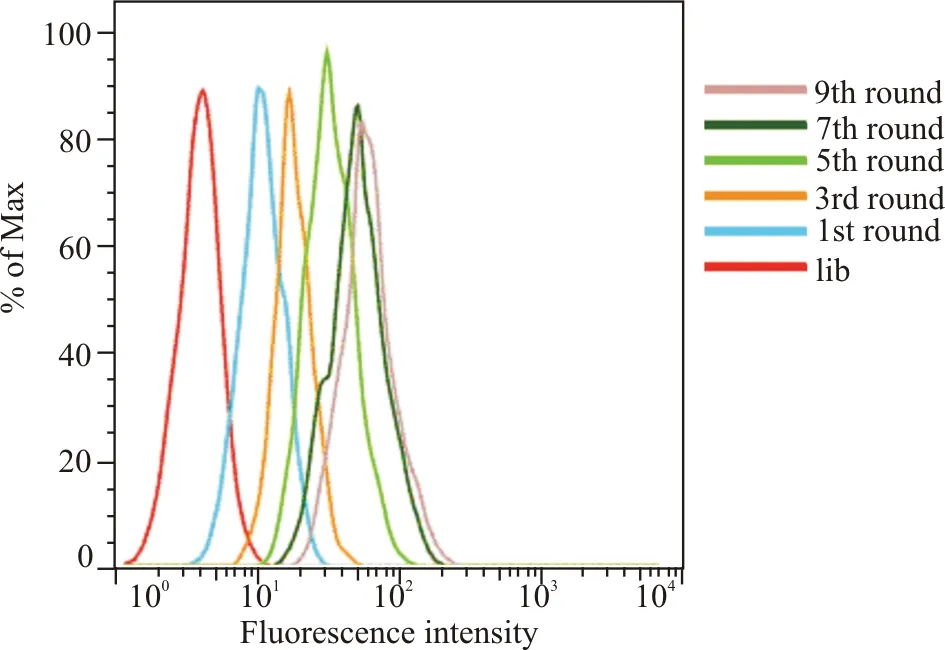
蓝色为抗体标记组,红色为空白对照组
2.4 共聚焦成像观察DNA文库与靶细胞的结合
用未筛选DNA文库、第5轮DNA文库与第9轮DNA文库分别与DAPI同时对大鼠BMSCs进行染色(图3)。共聚焦结果显示,第9轮DNA文库染色细胞的表面绿色荧光最强,提示该轮BMSCs特异性适配子得到最大程度地富集;第5轮文库染色细胞的绿色荧光较为微弱,未筛选文库组几乎看不到绿色荧光表达,提示第5轮文库中特异性适配子的富集程度高于未筛选文库,但二者都远远低于第9轮文库。因此,BMSCs特异性适配子序列在第9轮得到最大程度地富集。
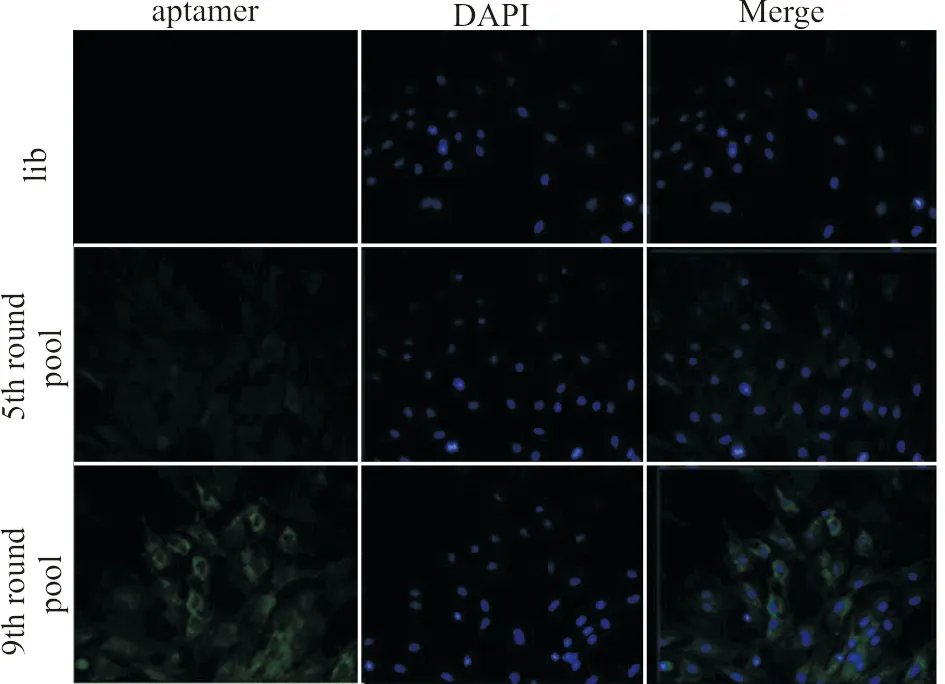
aptamer:适配子;lib:未筛选DNA文库;5th round pool:第5轮DNA文库;9th round pool:第9轮DNA文库
2.5 克隆测序及候选适配子的确定
对第9轮文库进行克隆,使用BioEdit软件对所有序列进行分析(图4),将重复次数在2次及2次以上的所有序列挑选出来,获得8条序列分别为:apt7、apt9、apt31、apt32、apt61、apt83、apt99、apt101(表1),使用RNA structure软件对每条序列进行二级结构预测(图5)。8条序列5′端均插入荧光基团FAM修饰。8条带荧光标记的序列分别与靶细胞BMSCs孵育30 min,流式细胞术检测结果如图6所示。所有序列的荧光强度都显著超过对照组lib,其中,apt7与BMSCs的结合能力最强,曲线右移程度远远超过其它序列,apt101与靶细胞的结合能力次之。分别统计lib、apt7、apt9、apt31、apt32、apt61、apt83、apt99、apt101与靶细胞结合的平均荧光强度以及空白细胞组(不加入任何荧光标记序列)的荧光强度,按公式(Faptamer-Fcell)/(Flib-Fcell)计算每个序列与靶细胞的相对荧光强度,结果如图7所示,8个候选适配子中apt7与BMSCs结合的荧光强度最强,apt101次之。

表1 候选适配子序列Table 1 Candidate sequences of aptamers

图4 使用BioEdit软件进行序列分析Fig.4 Sequence analysis using BioEdit software
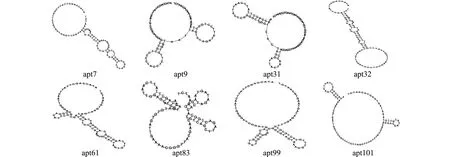
图5 各候选适配子二级结构预测Fig.5 Prediction of the secondary structure of each candidate aptamer
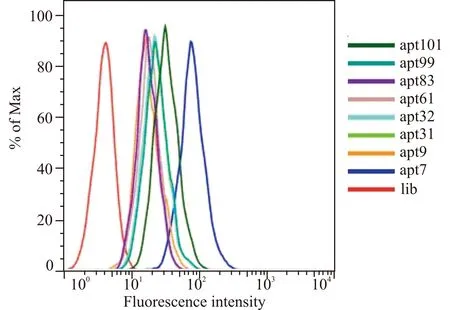
图6 流式细胞术检测候选适配子与BMSCs的结合Fig.6 Detection of binding of candidate aptamer to BMSCs by flow cytometry

图7 不同候选适配子与BMSCs结合能力的比较Fig.7 Comparison of the binding ability of different aptamers to BMSCs
2.6 候选适配子与靶细胞解离常数Kd的定量
8个候选适配子Kd值均在纳摩尔级别,对靶细胞具有高亲和力,其中apt7的Kd值最小,仅有(11.79±0.72)nmol/L,表明适配子apt7与BMSCs的亲和力是所有候选适配子中最高的(图8)。

图8 不同浓度apt与BMSCs结合及解离曲线Fig.8 Binding and dissociation curves of different concentrations of apts to BMSCs
2.7 荧光共聚焦成像观察候选适配子与靶细胞的结合
取候选适配子中与靶细胞Kd值最小的3个序列:apt7、apt61、apt101,每条序列5′端插入荧光基团FAM修饰,与BMSCs孵育30 min后,冲洗2次去除未结合适配子,然后用DAPI染液进行细胞核染色,荧光显微镜下观察3组靶细胞表面均有明亮的绿色荧光表达。结果表明候选适配子apt7、apt61、apt101能稳定地结合在靶细胞表面,与靶细胞均有高亲和力(图9)。
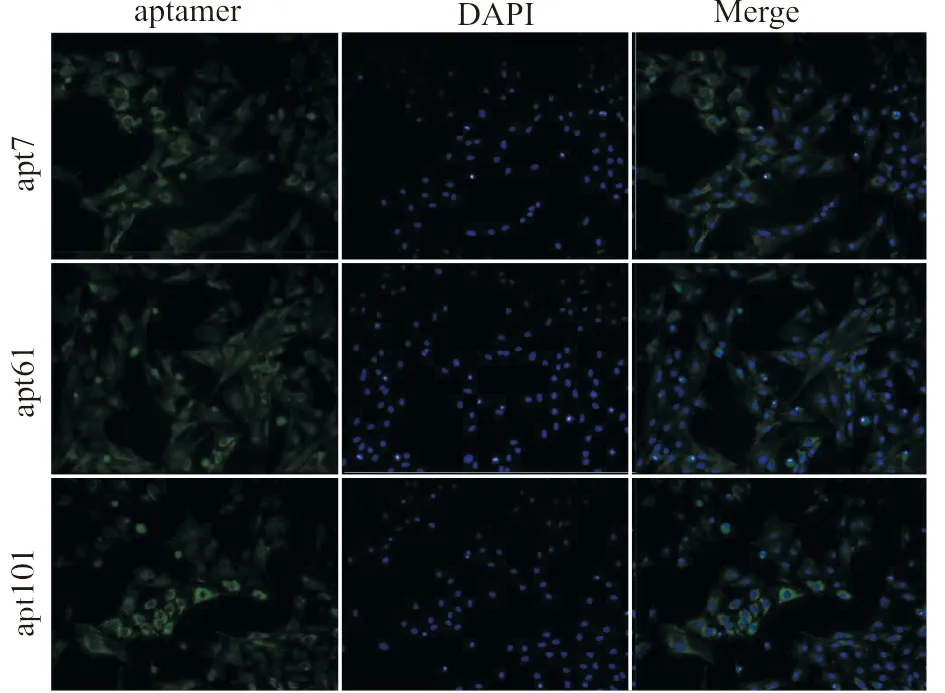
图9 apt7、apt61、apt101在BMSCs表面的结合(×200)Fig.9 Binding of apt7,apt61,and apt101 on the surface of BMSCs(×200)
2.8 apt7的细胞选择性实验
流式细胞术检测结果表明,apt7能与大鼠来源的BMSCs高亲和力结合,对人及小鼠来源的BMSCs无亲和力(图10)。
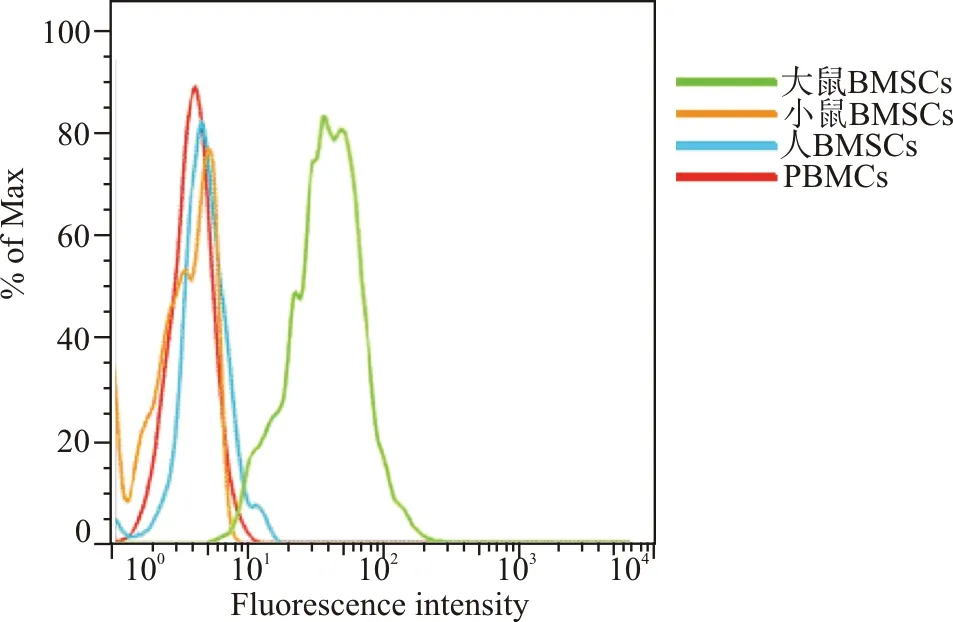
图10 apt7与不同来源BMSCs细胞的结合Fig.10 Binding of apt7 to BMSCs from different sources
3 讨论
本实验研究了一种新的BMSCs筛选和鉴定分子,即适配子。它是人工合成的小分子配体,能与靶目标高亲和力、高特异性结合,通常为小分子的单链DNA或RNA寡核苷酸序列,长度通常在100个碱基之内,可采用SELEX技术从构建的随机核酸文库中筛选出来[3-4]。
核酸适配子的筛选过程从构建核酸初始文库开始,将构建好的文库与靶分子混合孵育,采用离心、柱层析法、免疫吸附法等分离技术去除文库中无法与靶分子紧密结合的序列,随后,靶分子表面的核苷酸经过洗脱、PCR扩增等操作继续用于下一轮的筛选,整个过程重复进行直至获得特异性高的适配子序列[5]。与其它靶向分子比较,适配子具有显著独特的优势。首先,适配子从随机、多样、大容量的文库中经过反复数轮筛选得到,对靶分子的结合具有高特异性及高亲和力,Kd可达到纳摩尔级别[6]。适配子筛选耗费时间短,在体外可以用化学方法合成,稳定性好,易于插入各种官能团和基团如生物素、羧基、氨基等[7-8],扩展了适配子的应用范围,而且这种修饰不影响适配子对靶标的识别能力。独特的筛选技术使适配子识别靶分子范围极其广泛,包括小分子的金属离子、有机染料、氨基酸和抗生素,甚至各种大分子的蛋白质、细胞、病毒以及细菌等等都可作为筛选的靶目标,靶标的多样性也使适配子在生物信息学、医学、细胞生物学、微生物学等领域有着广泛应用。
适配子筛选最重要的靶标之一是活细胞,寡核苷酸序列通过三维空间构象牢牢结合在靶细胞的表面,细胞膜表面任何一个分子都有可能是适配子结合的潜在靶点,随着筛选的反复进行和筛选条件逐渐变得严苛,适配子与靶细胞之间形成特异性结合的保留下来,非特异性结合则直接被淘汰。
在本研究中,随着SELEX筛选的反复进行,靶点特异性适配子从核酸文库中筛选出来。为满足各种各样研究要求,不同类型的SELEX,如counter-SELEX、AFM-SELEX、Photo-SELEX、CE-SELEX等逐渐出现[9-10],其中以活细胞为靶点的Cell-SELEX已广泛应用于细胞成像、疾病的检测和治疗等方面[11-12]。使用Cell-SELEX技术筛选出的内皮祖细胞特异性适配子具有较高的亲和力,研究表明,在流体环境下该适配子具有捕获内皮祖细胞的能力,为用于构建血管支架材料提供了依据[13]。在本研究中我们以SD大鼠BMSCs为靶细胞,通过9轮SELEX筛选获得DNA富集文库,流式细胞术结果表明文库与BMSCs结合的荧光表达强度与未筛选文库相比显著增高,共聚焦成像显示文库能稳定结合在BMSCs表面,这些结果都进一步说明适配子筛选的过程具有特异性,BMSCs特异性适配子在第9轮达到最大程度的富集。
以细胞为靶点筛选特异性适配子是一种“盲筛”,研究人员不需要提前了解靶细胞的表面标记分子或膜蛋白的组成,特别是在缺乏特异性分离或鉴定方法的活细胞招募中是一个显著的优势[14]。本研究中,对富集文库进行克隆及测序后获得了8个候选适配子,与未筛选文库相比,8个候选适配子对BMSCs都有较高的亲和力,其中适配子apt7的Kd仅有(11.79±0.72)nmol/L,对大鼠BMSCs亲和力最高,我们决定选取apt7对适配子的特性作进一步的研究。
核酸适配子最重要的特性之一是靶点特异性。细胞选择性实验表明适配子apt7能高亲和力结合大鼠BMSCs,对小鼠、人来源的BMSCs没有亲和力,我们猜测apt7能与大鼠BMSC膜表面某种蛋白结合,而这种蛋白不存在小鼠或人来源BMSCs细胞表面。因此,apt7可作为分子工具研究大鼠BMSCs表面的特殊分子标记,必要时可作为大鼠BMSCs组织学特征用于鉴定。在另外一项有趣的研究中,Jiang等[15]筛选出人诱导多能干细胞(IPS)的核酸适配子apt19S,apt19S与IPS亲和力很高,研究人员利用细胞表型分析及基因敲除等技术发现apt19S能与IPS膜表面蛋白碱性磷酸酶配体(ALPL)高亲和力结合,认为ALPL不仅是适配子apt19S的一个作用位点,还能作为IPS特殊分子标记用于对IPS特性的研究中。此外,适配子在体内的血液残留时间短、无免疫原性、毒性低、分子小、扩散快速、体内清除快等特点使其适合进行体内研究[16],如适配子与纳米材料耦合用于肿瘤细胞成像中[11],以及基于适配子的靶向载药体系在疾病治疗中的应用等[17]。
本研究采用SELEX筛选技术,获得了大鼠BMSCs的特异性核酸适配子,建立了新的从大鼠骨髓细胞中快速筛选和鉴定BMSCs的方法,为BMSCs在体内的细胞生物学和分子生物学机制的研究,以及为组织工程支架研究中招募、捕获靶细胞等环节提供了新的思路和方法。

