淫羊藿苷元在大鼠体内的血浆动力学和组织分布研究
王 敏,谷 元,周 宇,武丽南,开跃义,耿雅杰,姚景春,王现珍*,司端运*
1.天津医科大学,天津 300070
2.天津药物研究院 释药技术与药代动力学国家重点实验室,天津 300193
3.鲁南制药集团股份有限公司 中药制药共性技术国家重点实验室,山东 临沂 276000
4.中国医学科学院药物代谢新技术创新单元,天津 300193
随着社会的发展和国家对中药的高度重视,天然产物逐渐成为药物研究的热点,从天然产物中寻找活性成分或通过改善其结构,来获取新的化学药品已然成为新药开发的一种重要途径[1]。淫羊藿作为我国传统中药,约有上千年的应用历史,具有治疗骨质疏松[2-5]、抗癌[6]、抗肿瘤、提高免疫力[7]、治疗老年痴呆[8]等作用,因其广泛的药理活性受到关注。
淫羊藿苷元是淫羊藿中主要药效单体成分,属于黄酮类化合物。黄酮类化合物的基本母核为苯并吡喃酮(C6-C3-C6)的一类多酚化合物,以游离或与糖结合成苷的形式广泛存在于多种植物中,具有抗氧化、抗肿瘤、抗病毒、神经保护、清除自由基、抗炎、心血管保护等多种药理活性[9]。尽管黄酮类化合物具有广泛的药理活性,但是由于其结构中的多酚羟基,使该类化合物在体循环血浆中主要以与葡萄糖醛酸或硫酸酯结合物的形式暴露,发挥药效作用的游离黄酮苷元的暴露量很低,普遍被认为具有较低的生物利用度,限制了该类化合物的成药性开发[10-12]。但是化合物在体内的真实浓度并不只是血药浓度所表现的,其在体内的生物利用度和暴露水平与血药浓度及组织浓度都有关系,而且组织中的存在形式更是直接影响药效的发挥。淫羊藿苷或淫羊藿苷元在动物血浆和组织中浓度测定的相关研究已有报道[13-19],但是尚没有研究报道淫羊藿苷元及其II相代谢产物在血液循环系统和组织脏器中的暴露形式及相应暴露程度。
本研究通过LC-MS/MS建立大鼠血浆及组织中游离淫羊藿苷元及生物样品经葡萄糖醛酸和硫酸复合酶水解后得到的总淫羊藿苷元的检测方法,考察大鼠ig淫羊藿苷元后的绝对生物利用度、血浆动力学和组织分布特征,揭示淫羊藿苷元在血液循环系统和组织脏器中的暴露程度、暴露形式及暴露比例,为具有低血浆药物暴露却呈现良好体内药理活性的黄酮类药物开发提供依据。
1 材料
1.1 药品与试剂
淫羊藿苷元(质量分数99.33%,批号170601)、淫羊藿苷元纳米晶(规格为27.4 mg/mL,批号181122)、淫羊藿苷元纳米晶溶媒(羟丙甲纤维素E5LV和十二烷基硫酸钠的混合物,批号分别为D011FBLL01和101420180501),均为山东新时代药业有限公司产品;汉黄芩素(质量分数100%,批号111515-201706),中国食品药品检定研究院;β-葡萄糖醛酸酶(β-葡萄糖醛酸酶和硫酸酯酶复合酶,批号SLBV4801),Sigma公司;磷酸二氢铵(色谱纯,天津市立元化工有限公司,批号20150814);甲醇、乙腈(色谱纯,美国Fisher公司,批号分别为185366、186355);正己烷(色谱纯,天津市康科德科技有限公司,批号190522);甲基叔丁基醚(色谱纯,美国Fisher公司,批号18100787);甲酸铵(分析纯,天津市光复精细化工研究所,批号20150313);甲酸(色谱纯,天津市大茂化学试剂厂,批号20181006);甲酸(质谱级,Sigma-Aldrich公司,批号BCBP4740V);超纯水为实验室自制。
1.2 仪器
高效液相色谱系统(含LC-30AD二元梯度泵、SIL-30AC自动进样器、CTO-30A柱温箱、DGU-20A5脱气机,日本岛津公司);5500型三重四极杆串联质谱仪(含Turbo ESI源、Analyst 1.5.2工作站,美国AB Sciex公司);17R台式高速冷冻离心机,美国Thermo Scientific公司;恒温混匀仪,杭州奥盛仪器有限公司;Turbo Vap LV型样品浓缩仪,美国Caliper公司。
2 方法
2.1 色谱条件
色谱柱ZORBAX Eclipse Plus C8(100 mm×4.6 mm,5 µm),流动相为乙腈(A)-0.5%甲酸-5%乙腈水溶液(B)(80︰20),等度洗脱,洗针水为乙腈-水(90︰10),体积流量为0.6 mL/min,柱温50 ℃,进样温度6 ℃。
2.2 质谱条件
ESI离子源,负离子检测;喷雾电压为−4500 V;源温度500 ℃;加热气和喷雾气均为60 Pa;卷帘气为20 Pa;出口电压−17 V,入口电压−10 V;扫描模式为多反应监测,淫羊藿苷元和内标汉黄芩素用于定量监测的离子对分别为 [M−H]−m/z367.1→309、283.1→162.9;碰撞能分别为−37、−39 eV;去簇电压分别为−110、−140 V。
2.3 动物
7~9周龄SD大鼠36只,SPF级,190.5~298.5 g,雌雄各半,由北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2016-0006、SCXK(京)2016-0011,大鼠饲养环境温度为(25±2)℃,湿度为(50±10)%,12 h光照,昼夜交替,实验方案经天津天诚新药评价有限公司实验动物伦理委员会审核通过(批准号2019022501),实验过程符合动物实验的伦理要求。大鼠给药前禁食12 h,自由饮水,给药后3 h统一给食。
2.4 给药溶液配制
剂量的选择参考药效学的量效关系,大鼠血浆动力学和组织分布以10 mg/kg ig给药,iv以5 mg/kg给药。大鼠ig给药制剂为淫羊藿苷元纳米晶供试品,加入空白溶媒(淫羊藿苷元纳米晶溶媒)制成;大鼠iv给药制剂为淫羊藿苷元原料药,加入N,N-二甲基甲酰胺溶解后,再加入5%葡萄糖注射液(N,N-二甲基甲酰胺-5%葡萄糖注射液4∶1)稀释,配制成溶液型制剂。
2.5 给药、分组及样品采集
2.5.1 血浆动力学 参考前期预试验结果,依据总淫羊藿苷元及游离淫羊藿苷元大鼠ig给药后的达峰时间、消除特点进行实验设计。将12只SD大鼠,随机分为2组,每组6只,分别ig(10 mg/kg)和iv(5 mg/kg)淫羊藿苷元,并于给药后0.083 3、0.25、0.5、1、2、3、4、6、9、12、15、18、24 h自颈静脉采血,肝素钠抗凝,并离心分离血浆,−20 ℃冰箱冻存至LC-MS/MS定量分析。实验结束后,动物统一麻醉后脱颈椎处死。
2.5.2 组织分布 根据血浆动力学的特征,游离淫羊藿苷元和总淫羊藿苷元在0.292 h左右达到峰值,半衰期分别为0.812、2.73 h。设计组织样本采集时间点分别0.25、2、9、18 h,包含药物的吸收、分布、消除过程。将24只SD大鼠,随机分为4组,分别为4个时间点,每个时间点6只,ig淫羊藿苷元(10 mg/kg),并于各时间点腹主动脉取血并立即脱颈椎处死动物,分别取血浆、脑、肌肉、脂肪、卵巢、子宫、睾丸、心、肝、脾、肺、肾、胃、肠(十二指肠段)、骨髓。组织称质量,剪刀剪碎,以1︰5(g/mL)的比例用纯甲醇在冰浴条件下制备组织匀浆,–20 ℃冷冻保存待测。
2.6 样品处理
2.6.1 血浆中的淫羊藿苷元
(1)游离淫羊藿苷元测定:吸取50 µL血浆样品,加入150 μL 0.05 mol/L磷酸二氢铵水溶液,涡旋1 min后,吸取150 μL,加入50 µL内标汉黄芩素甲醇溶液,1.2 mL提取剂甲基叔丁基醚-正己烷(2∶1),涡旋2 min,4 ℃、12 000 r/min离心5 min,取上层有机相960 µL于玻璃试管中,40 ℃水浴氮气吹干,加入100 µL复溶液(70%甲醇水溶液)涡旋复溶,取复溶后样品于内插管中,4 ℃、12 000 r/min离心10 min后,进行LC-MS/MS定量分析。
(2)总淫羊藿苷元测定:吸取50 μL血浆样品,加入150 μL 0.05 mol/L磷酸二氢铵水溶液,涡旋1 min,取30 μL加入125 μL 200 U β-葡萄糖醛酸酶混匀后,37 ℃孵育40 min后加入50 μL内标汉黄芩素,之后提取等步骤与游离淫羊藿苷元测定步骤相同。
2.6.2 组织中的淫羊藿苷元
(1)游离淫羊藿苷元测定:吸取50 µL组织匀浆样品,加入50 μL甲醇,250 µL 0.05 mol/L磷酸二氢铵水溶液,25 µL内标汉黄芩素甲醇溶液,1.2 mL提取剂正己烷-二氯甲烷-异丙醇(20∶10∶1),涡旋2 min,4 ℃、12 000 r/min离心5 min。取上层有机相960 µL于玻璃试管中,40 ℃水浴氮气吹干后,加入100 µL复溶液涡旋复溶,取复溶后样品于内插管中,4 ℃、12 000 r/min离心10 min后,进行LC-MS/MS分析。
(2)总淫羊藿苷元测定:吸取50 µL组织匀浆样品,加入50 μL甲醇,40 ℃水浴氮气吹干,加入250 µL 0.05 mol/L磷酸二氢铵水溶液,50 μL β-葡萄糖醛酸酶混匀后,37 ℃孵育40 min,加入25 µL内标汉黄芩素甲醇溶液,之后提取等步骤与游离淫羊藿苷元测定步骤相同。
2.7 数据处理
血浆药物浓度-时间数据采用WinNonlin 7.0软件非房室模型统计矩法计算药动学参数,其中血药浓度-时间曲线下面积(AUC)采用梯形法计算,消除半衰期(t1/2)采用Best Fit法计算,峰浓度(Cmax)及达峰时间(Tmax)采用实测值。
3 结果
3.1 方法学验证
血浆中淫羊藿苷元的LC-MS/MS定量分析方法经过了完整的方法学验证,在该分析方法下,血浆中的内源性物质不会干扰待测物和内标的测定,总淫羊藿苷元和游离淫羊藿苷元的线性范围分别为0.01~5 µg/mL和0.5~100 ng/mL,曲线斜率的变异系数均小于5.13%,相关系数大于0.99,表明在该范围浓度内线性良好。定量下限分别为0.01 µg/mL和0.5 ng/mL,准确度在96.3%~108%,精密度小于9.52%。低、高2个质量浓度水平的基质效应在87.7%~105%,变异系数小于11.6%。
组织中淫羊藿苷元的LC-MS/MS定量分析方法分别选取3个代表性组织脑、心、肝进行了1个分析批的部分方法学验证。组织中的内源性物质不会干扰待测物和内标的测定,总淫羊藿苷元和游离淫羊藿苷元的线性范围均为2.5~1000 ng/g,相关系数大于0.99,表明在该范围浓度下线性关系良好。定量下限为2.5 ng/g,准确度在103%~111%,精密度小于9.52%。低、高2个质量浓度水平的基质效应在61.9%~89.4%,变异系数小于9.16%。
血浆和组织中的方法学验证结果均符合指导原则要求。
3.2 淫羊藿苷元的大鼠血浆动力学
大鼠ig给药后血药浓度-时间曲线见图1。大鼠ig及iv给药后的主要药动学参数见表1、2。
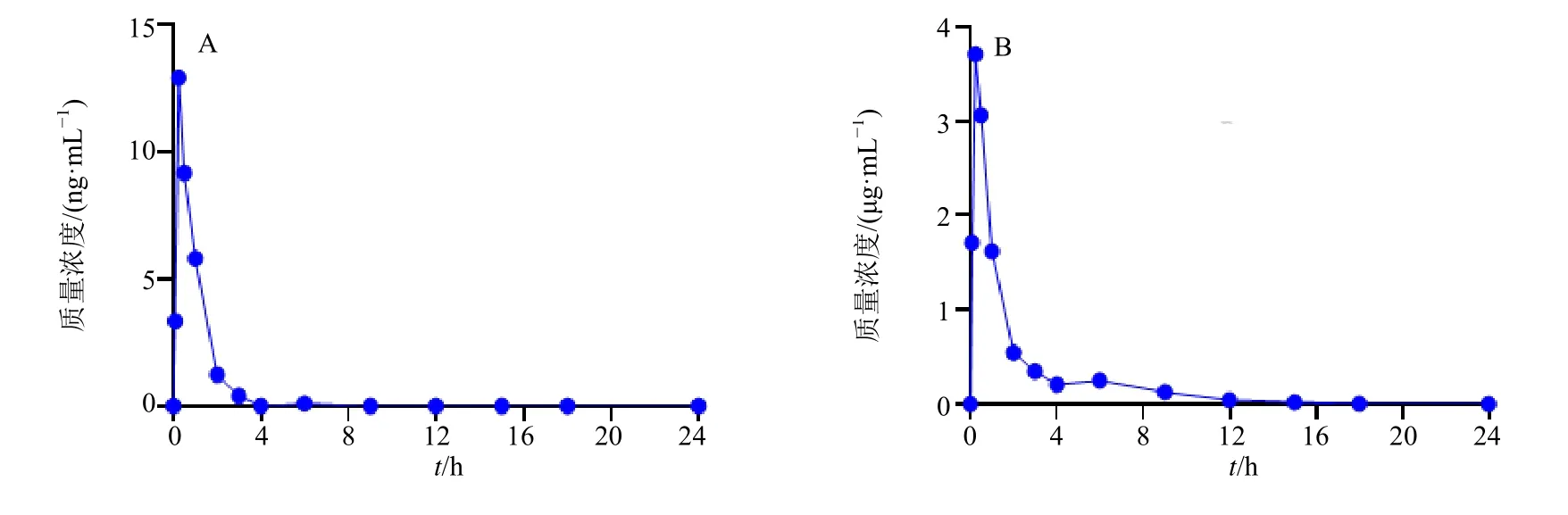
图1 大鼠ig 10 mg·kg−1淫羊藿苷元后游离淫羊藿苷元 (A) 与总淫羊藿苷元 (B) 的血药浓度-时间曲线 (±s ,n=6)Fig.1 Plasma concentration-time curve of free (A) and total (B) icaritin after intragastric administration of icaritin (10 mg·kg−1) in rats (±s ,n=6)
表1 大鼠ig 10 mg·kg−1淫羊藿苷元后血浆中淫羊藿苷元的药动学参数 (±s ,n=6)Table 1 Pharmacokinetic parameters of icaritin in plasma after intragastric administration of icaritin (10 mg·kg−1) in rats (±s ,n=6)
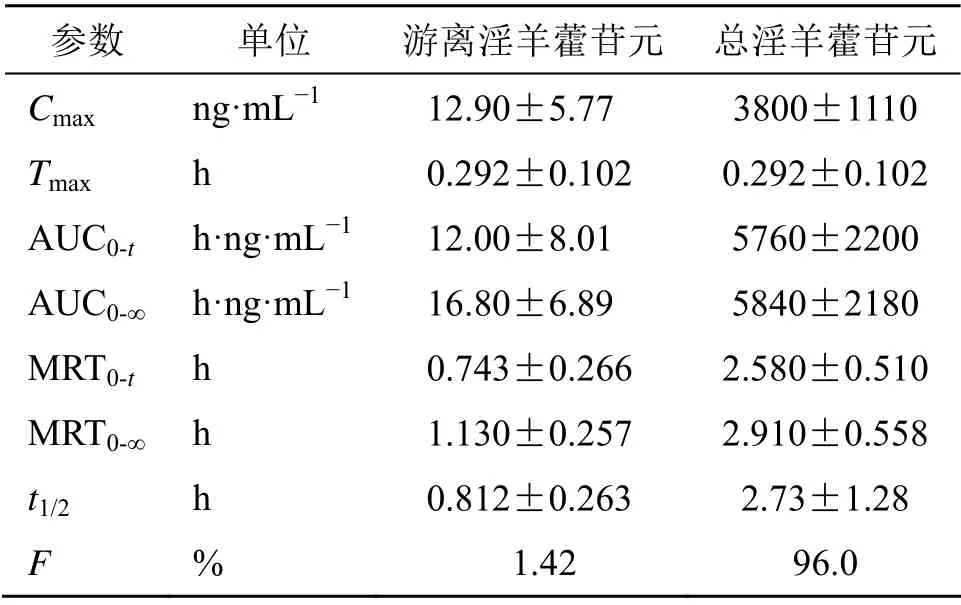
表1 大鼠ig 10 mg·kg−1淫羊藿苷元后血浆中淫羊藿苷元的药动学参数 (±s ,n=6)Table 1 Pharmacokinetic parameters of icaritin in plasma after intragastric administration of icaritin (10 mg·kg−1) in rats (±s ,n=6)
MRT为平均驻留时间MRT is the average resident time
参数 单位 游离淫羊藿苷元 总淫羊藿苷元Cmax ng·mL−1 12.90±5.77 3800±1110 Tmax h 0.292±0.102 0.292±0.102 AUC0-t h·ng·mL−1 12.00±8.01 5760±2200 AUC0-∞ h·ng·mL−1 16.80±6.89 5840±2180 MRT0-t h 0.743±0.266 2.580±0.510 MRT0-∞ h 1.130±0.257 2.910±0.558 t1/2 h 0.812±0.263 2.73±1.28 F % 1.42 96.0
大鼠ig给药淫羊藿苷元后,吸收迅速,消除较快,在血浆中总淫羊藿苷元的暴露量明显高于游离淫羊藿苷元,总淫羊藿苷元的Cmax和AUC0-∞分别是游离淫羊藿苷元的295倍和347倍,提示淫羊藿苷元在血液循环系统中只有少部分以原型的形式存在,大部分被代谢成为葡糖醛酸结合物和硫酸酯结合物。与大鼠iv淫羊藿苷元(5 mg/kg)相比,经剂量校正后,游离淫羊藿苷元的绝对生物利用度(F)为1.42%,总淫羊藿苷元的F为96.0%。
3.3 淫羊藿苷元的大鼠组织分布
大鼠ig给药后各组织分布见图2和表3。
3.3.1 游离淫羊藿苷元 大鼠ig给药10 mg/kg,除肾、脂肪、肺在给药后2 h达分布峰值外,其余组织中游离淫羊藿苷元均在0.25 h达分布峰值。随后逐渐消除,给药18 h后组织中的淫羊藿苷元已降至分布峰值的1/10或1/20以下,各组织的分布与血药浓度的时间变化趋势一致,未发现明显的组织蓄积趋势。大鼠ig给药后,淫羊藿苷元在组织中分布药浓度的时间变化趋势一致,未发现明显的组织蓄积趋势。大鼠ig给药后,淫羊藿苷元在组织中分布广泛,所有被研究的组织中除睾丸外均可检测到游离淫羊藿苷元。基于AUC0-t评价游离淫羊藿苷元在组织中的分布程度排序为胃、肠、肺(110~220倍血浆)>肝、子宫(20~65倍血浆)>心、卵巢、脾(4~15倍血浆)>骨髓、肾、肌肉(1~2倍血浆)>血浆>脑、脂肪(20%~50%血浆)>睾丸(未检测到)。总体趋势上组织中游离淫羊藿苷元的暴露量高于血浆。
表2 大鼠iv 5 mg·kg−1淫羊藿苷元后血浆中淫羊藿苷元的药动学参数 (±s ,n=6)Table 2 Pharmacokinetic parameters of icaritin in plasma after intravenous administration of icaritin (5 mg·kg−1) in rats (±s ,n=6)

表2 大鼠iv 5 mg·kg−1淫羊藿苷元后血浆中淫羊藿苷元的药动学参数 (±s ,n=6)Table 2 Pharmacokinetic parameters of icaritin in plasma after intravenous administration of icaritin (5 mg·kg−1) in rats (±s ,n=6)
Vd为表观分布容积,CL为清除率Vd is the apparent volume of distribution,CL is the clearance rate
参数 单位 游离淫羊藿苷元 总淫羊藿苷元Cmax ng·mL−1 978±107 2390±295 AUC0-t h·ng·mL−1422±38 3000±932 AUC0-∞ h·ng·mL−1425±38 3080±884 MRT0-t h 0.531±0.049 3.740±0.702 MRT0-∞ h 0.599±0.093 4.500±0.649 Vd L·kg−1 28.5±14.9 10.4±7.4 CL L·h−1·kg−111.80±1.05 1.73±0.48
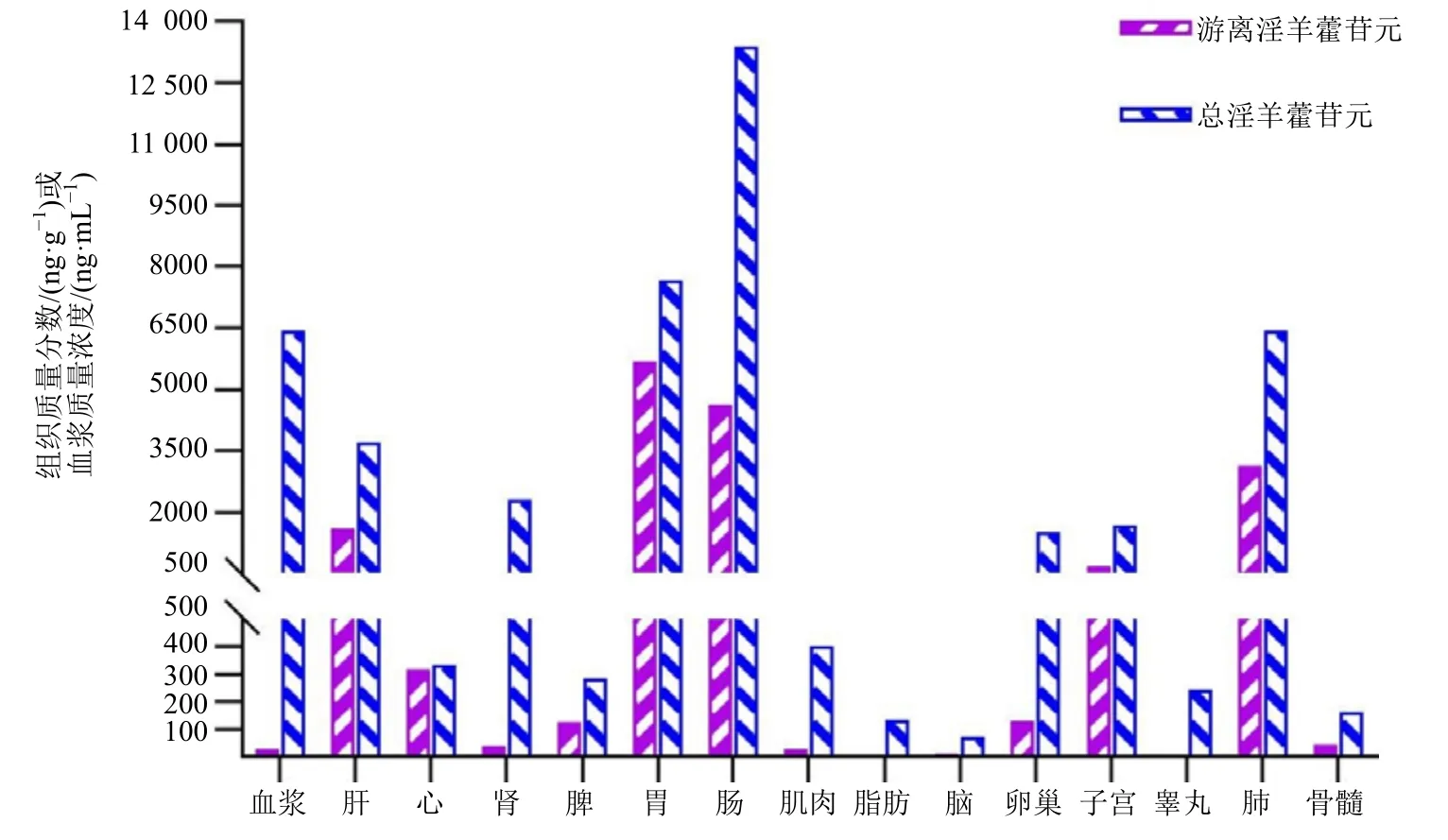
图2 大鼠ig 10 mg·kg−1淫羊藿苷元后游离和总淫羊藿苷元的组织分布Fig.2 Tissue distribution profile of free and total icaritin in rats after intragastric administration of icaritin (10 mg·kg−1) in rats

表3 大鼠ig 10 mg·kg−1淫羊藿苷元后各组织中游离和总淫羊藿苷元的暴露量比较 (n=6)Table 3 Comparison of free and total icaritin exposure in different tissues after intragastric administration of icaritin (10 mg·kg−1) in rats (n=6)
3.3.2 总淫羊藿苷元 大鼠ig给药10 mg/kg,除睾丸、肺在ig给药后2 h达分布峰值外,其余组织中总淫羊藿苷元均在0.25 h达分布峰值。随后逐渐消除,给药后18 h组织中的总淫羊藿苷元已降至分布峰值的1/10或1/20以下,各组织的分布与血药浓度的时间变化趋势一致,未发现明显的组织蓄积趋势。大鼠ig给药后,总淫羊藿苷元在组织中分布广泛,所有被研究的组织中均可检测到结合型的淫羊藿苷元。基于AUC0-t评价总淫羊藿苷元在组织中的分布程度,从高到低排序为肠、胃、肺(1~2倍血浆)>血浆>肝、肾、子宫、卵巢(20%~60%血浆)>肌肉、心、脾、睾丸、骨髓、脂肪、脑(1%~7%血浆)。总体趋势上,除胃、肠外的各组织中总淫羊藿苷元的暴露量低于血浆。
大鼠灌胃淫羊藿苷元后,多数组织中游离淫羊藿苷元的暴露量、暴露时间明显高于血浆,而且游离淫羊藿苷元与总淫羊藿苷元的比例明显大于血浆。
4 讨论
在测定大鼠血浆和组织中总淫羊藿苷元浓度时,进行了水解条件的考察和优化,分别对β-葡萄糖醛酸酶的浓度(0、50、100、150、200、300、500 U)以及孵育时间(0、10、20、30、40、60 min)进行了考察,最终确定酶浓度为200 U、孵育时间为40 min可以达到对总淫羊藿苷元的充分水解。
大鼠ig给予淫羊藿苷元后,血浆中游离淫羊藿苷元的浓度较低,游离淫羊藿苷元与总淫羊藿苷元暴露量比为0.208%,提示ig给药后在大鼠的血液循环系统中淫羊藿苷元主要以II相结合型产物暴露为主。进一步结合大鼠iv给药(5 mg/kg)的数据,ig给药后以游离淫羊藿苷元形式计算的绝对生物利用度为1.42%,以总淫羊藿苷元形式计算的绝对生物利用度为96.0%,提示虽然淫羊藿苷元的绝对生物利用度偏低,但是其吸收分数并不低。除胃、肠外,多数组织中游离淫羊藿苷元的暴露量明显高于血浆,总淫羊藿苷元的暴露量低于血浆。除睾丸外,其他组织中游离淫羊藿苷元与总淫羊藿苷元AUC0-18h比值(1%~95%)远高于血浆(0.208%),即与血浆相比,游离的淫羊藿苷元在组织器官中的暴露量和暴露比例更高、持续时间更长。
淫羊藿苷元游离/结合形式暴露比例在血浆和组织中呈现出的悬殊差异,在其他类型的天然药物和化学药物的药动学研究中鲜有报道。这一现象是淫羊藿苷元特有的,还是黄酮类化合物可能具有的共性,以及产生该现象的机制?是由于其II相结合物极性增大,膜通透性变差,不易于进入组织细胞,还是血液和组织中的结合/水解代谢酶的差异引起的?或转运差异引起的?以上问题均需要进一步的研究和验证,以便加快推动黄酮类化合物的成药性开发。
利益冲突所有作者均声明不存在利益冲突

