PD-L1翻译后修饰的研究进展*
刘禹辰 刘丹 郑骏年 施明
程序性死亡受体-配体1(programmed death li⁃gand-1,PD-L1)也称为表面抗原分化簇274(cluster of differentiation 274,CD274)或B7 同源体(B7 homo⁃log 1,B7-H1),是B7家族成员之一,其编码基因位于染色体9p24.1,包含7个外显子。PD-L1属于Ⅰ型跨膜蛋白,由290个氨基酸组成,包含Ig-V和Ig-C样胞外区、跨膜区和不含典型信号基序的短胞质尾巴。1999年12月,陈列平教授首次发现PD-L1(B7-H1)分子,并报道其可以促进T细胞增殖及分泌白细胞介素10(interleukin-10,IL-10)[1]。日本学者本庶佑(Tasuku Honjo)课题组报道PD-L1 可与程序性死亡受体1(programmed cell death protein 1,PD-1)相互作用并负调控淋巴细胞活化[2]。陈列平课题组先后报道肿瘤细胞表达的PD-L1 可诱导T 细胞凋亡,阻断PD-L1 可增强T 细胞免疫治疗的疗效[3-4]。目前,已有3个抗PD-L1抗体获批上市用于治疗多种肿瘤[5]。
高表达PD-L1是肿瘤细胞逃逸免疫系统监视和攻击的重要途径。因此,PD-L1表达调控的机制是肿瘤研究领域的热点之一。已有研究表明PD-L1表达水平受到多种因素影响。作为蛋白分子,PD-L1可发生糖基化、泛素化、磷酸化、棕榈酰化以及乙酰化等修饰,这些翻译后修饰(posttranslational modifications,PTMs)对PDL1的稳定性及生物学功能产生重要影响(图1)。
1 PD-L1的糖基化
1.1 PD-L1糖基化机制
作为一种重要的翻译后修饰形式,糖基化对蛋白质分子的稳定性、定位和功能起着重要作用。根据聚糖结构连接的氨基酸不同,蛋白质的糖基化修饰主要分为N-糖基化与O-糖基化两种类型。
N-糖基化是在寡糖转移酶复合体的催化下,将由寡糖预形成的糖链转移到位于NXT 基序(天冬氨酸-X-色氨酸/丝氨酸序列,X为除脯氨酸外的任何氨基酸)中的天冬酰胺侧链受体上,随着肽链进入内质网腔和高尔基体,N-糖链继续被糖苷酶和糖基转移酶进一步加工修剪,形成最终的糖蛋白。
N-糖苷酶F(peptide-N-glycosidase F,PNGase F)可去除N-糖基化修饰。有研究[6]采用PNGase F 或N-糖基化抑制剂衣霉素(tunicamycin)处理MDAMB-231 细胞和BT549 细胞后,将全细胞裂解物进行Western-blot 检测,PD-L1 的分子量由45 kDa 下降到33 kDa,但O-糖苷酶却不能产生类似效应。这说明PD-L1 的糖基化类型主要是N-糖基化,根据聚糖链的组成不同,N-糖基化又可分为高甘露糖型、复杂型和杂交型。内切β-N-乙酰氨基葡糖苷酶-H(endobeta-N-acetylglucosaminidase H,Endo-H)能裂解高甘露糖型和一些杂交型结构,当用Endo-H处理细胞后,仅部分降低PD-L1糖基化,说明PD-L1的糖基化类型主要是复杂型N-糖基化。该研究通过点突变的方法证实了PD-L1 的糖基化位点是N35、N192、N200、N219,见图1。
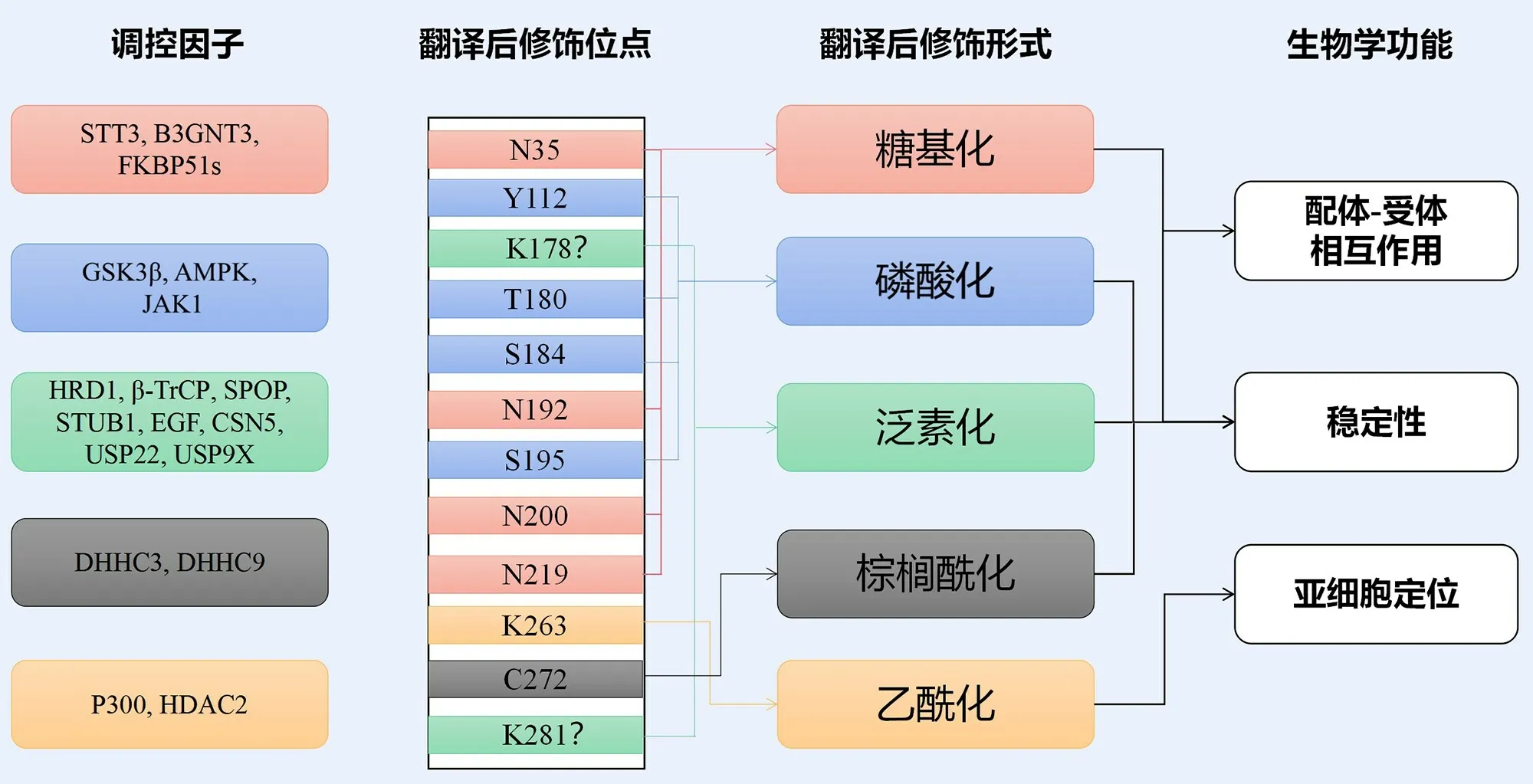
图1 PD-L1翻译后修饰模式图
已报道的PD-L1糖基转移酶包括星状孢子素温度敏感性酶3(staurosporine and temperature sensitivity 3,STT3)[7]和β-1,3-N-乙酰氨基葡萄糖转移酶(β-1,3-N-acetylglucosaminyl transferase,B3GNT3)[8]。STT3是内质网相关的N-糖基转移酶,敲除STT3后,PD-L1的糖苷结构消失,仅存在33 kDa的非糖基化形式,说明PDL1 4个糖基化位点均需在STT3的催化下才能发生糖基化修饰。B3GNT3是高尔基体相关糖基转移酶,可以在PD-L1的N192和N200位点催化多聚-乙酰乳糖胺糖基化修饰。蛋白质分子折叠为糖基化的重要步骤,FK506结合蛋白51剪接体(FKBP51s)作为PD-L1的伴侣分子,通过在内质网中辅助PD-L1折叠,从而促进PD-L1的糖基化,稳定胶质瘤中的PD-L1[9]。整合膜支架蛋白(Sigma1)在内质网处调节PD-L1的糖基化,阻止PD-L1的自噬降解从而稳定肿瘤细胞中PD-L1[10]。
1.2 糖基化对PD-L1的影响
糖基化可影响PD-L1的稳定性[6]。研究发现[6],在PD-L1的4个糖基化位点中,仅N192、N200和N219这3个位点的糖基化会影响PD-L1的稳定性。这3个位点发生糖基化会抑制PD-L1 与糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)结合以及随后的蛋白酶体途径降解。亦有研究报道,抑制介导PD-L1糖基化修饰的关键分子,如STT3[7]、B3GNT3[8]、Sigma1[10]和FKBP51s[9],可显著降低PD-L1的表达水平。
糖基化可影响PD-L1与PD-1之间的相互作用。PD-L1的4个糖基化位点均位于胞外区[6]。研究者[6]在人乳腺癌细胞BT549中敲低内源性PD-L1,然后在细胞中回转野生型PD-L1(可糖基化PD-L1,gPD-L1)和4个糖基化位点突变的PD-L1突变体(不能糖基化的PD-L1,ngPD-L1)。结果显示,与ngPD-L1相比,gPD-L1与PD-1的结合更强。而使用糖基化抑制剂2-脱氧-D-葡萄糖(2-deoxyglucose,2-DG)[11]或者1-(4-碘苯基)-3-(2-金刚烷基)胍(1-(4-iodophenyl)-3-(2-adamantyl)guanidine),IPAG)[10]抑制了PD-L1糖基化后,PD-L1与PD-1的结合能力明显下降。同样,影响PD-L1糖基化修饰的分子也会影响其与PD-1的相互作用,如B3GNT3介导N192和N200处的糖基化就可以增强PD-L1与PD-1的结合[8]。
糖基化还会影响PD-L1检测的准确性[12-13]。肿瘤组织PD-L1的表达水平是判断患者能否从抗PD-1/PDL1治疗中获益的重要指标[14]。抗体是检测PD-L1表达水平的重要工具。大多数抗PD-L1抗体是用含有PDL1部分序列的多肽或重组蛋白作为抗原免疫动物而获得的,而这些多肽或重组蛋白一般不具有糖基化等翻译后修饰形式。PD-L1的糖基化修饰可能影响检测抗体对其识别与结合。Lee等[13]报道,采用PNGase F处理A549 和BT-549 细胞后,以抗PD-L1 抗体(Abcam,ab58810)作为一抗进行免疫荧光检测。与对照组相比,PNGase F处理组荧光强度显著升高。对A549和H1299细胞进行去糖基化处理后[13],测定抗PD-L1抗体(28-8 mAb,该抗体已被美国食品药品监督管理局批准用于临床检测)与细胞表面PD-L1的亲和力。在上述2种细胞中,去糖基化处理使亲和力分别增加25和55倍。上述研究结果提示,对肿瘤标本进行去糖基化处理可以重新界定PD-L1表达水平的判别标准。研究者[13]对95例接受atezolizumab(抗PD-L1抗体)治疗的患者的样本进行PD-L1表达水平检测。未经去糖基化处理时,PDL1高表达患者较PD-L1低表达患者的死亡风险降低18%,但2组患者的无进展生存期无显著性差异。经去糖基化处理后,PD-L1高表达患者的无进展生存期较PDL1低表达患者显著延长,死亡风险降低42%。这提示去糖基化处理可提高PD-L1作为标志物预测抗PD-1/PD-L1治疗疗效的准确性。
2 PD-L1的泛素化
泛素化是指泛素在一系列酶的催化作用下共价结合到靶蛋白的过程。泛素是一种由76个氨基酸组成的高度保守的多肽,其C端的谷氨酸通过酰胺键与靶蛋白赖氨酸的ε氨基结合。当靶蛋白结合单个泛素分子时称为单泛素化,当靶蛋白的多个赖氨酸同时被单个泛素分子标记称为多泛素化。泛素分子本身也含有7个赖氨酸(K6、K11、K27、K29、K33、K48和K63),这些赖氨酸能耦连其他泛素分子形成特异的多聚泛素链,靶蛋白的单个赖氨酸被多个泛素分子标记称为多聚泛素化。
2.1 PD-L1的多聚泛素化
靶蛋白被多聚泛素链标记后,会被26S蛋白酶体识别并被降解。PD-L1的多聚泛素化可以发生在不同的细胞间室。在内质网中,E3泛素连接酶HRD1(HMGCoA reductase degradation 1)可以诱导异常糖基化的PDL1发生多聚泛素化,从而发生内质网相关的蛋白质降解(ER-associated degradation,ERAD)[15]。在细胞质中,E3泛素连接酶β-TrCP(β-transducin repeat containing E3 ubiquitin protein ligase)诱导PD-L1多聚泛素化及降解[6]。干预GSK3β 或哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)活性可扰动β-TrCP和PD-L1之间的相互作用,从而影响PD-L1的多聚泛素化及稳定性[6,27]。细胞膜上的PD-L1有较大一部分会被内化并进行再循环,该过程依赖于PD-L1与CMTM6(CKLF-like marvel transmembrane domain con⁃taining 6)的结合,敲除CMTM6后,E3泛素连接酶STUB1(STIP1 homology and U-box containing protein 1)便会诱导循环内体中的PD-L1多聚泛素化,从而经溶酶体途径降解[17-18]。这可以解释为何CMTM6的高表达可作为预测PD-1/PD-L1抑制剂疗效的独立因素[19-20]。
研究者发现[21],在不同的细胞周期中,PD-L1的表达水平呈规律性变化[21]。在M期和G1期早期,PD-L1表达水平显著上调。而在G1晚期和S期,细胞周期蛋白依赖性激酶4(cyclin-dependent kinases 4,Cyclin DCDK4)磷酸化E3泛素连接酶Cullin 3的接头蛋白SPOP(speckle type BTB/POZ protein),将SPOP从Cullin 3上解离下来,从而增强Cullin 3的稳定性。Cullin 3诱导PDL1多聚泛素化,导致PD-L1表达水平降低。
2.2 PD-L1的单泛素化和多泛素化
单泛素化和多泛素化可以不依赖26S蛋白酶体系统对蛋白质的稳定性、定位、内吞和运输起调控作用。最近一项研究发现[22],在表皮生长因子(epidermal growth factor,EGF)诱导下,PD-L1可以发生单泛素化和多泛素化,并伴随着表达水平的增高。该研究[22]使用UbPred软件预测PD-L1中的2个赖氨酸残基(K178,K281)为潜在的泛素化位点,但其准确性仍需进一步的试验确认。表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂可显著降低PD-L1的单一泛素化和多泛素化[22]。然而,亦有研究报道EGFR抑制剂可诱导PDL1的多聚泛素化[6]。EGFR抑制剂通过促进或抑制PDL1不同类型的泛素化,下调了PD-L1的表达。因此,有必要进一步研究EGFR信号通路诱导PD-L1的单泛素化、多泛素化和多聚泛素化之间是否存在串扰。
2.3 PD-L1的去泛素化酶
泛素化是动态可逆的修饰,靶蛋白上的泛素分子和多聚泛素链可被去泛素化酶解离。在口腔鳞癌细胞中,去泛素化酶USP9X(ubiquitin-specific proteases 9X)会使PD-L1去泛素化,从而增强PD-L1的稳定性[23]。去泛素化酶USP22(ubiquitin-specific proteases 22)在肝癌中高表达,可与PD-L1的C末端相互作用,催化PDL1的去泛素化反应,增强PD-L1的稳定性,且与肝癌患者的不良预后密切相关[24]。去泛素化酶CSN5(COP9 signalosome 5)也可诱导PD-L1的去泛素化反应[25-26]。炎症信号,如TNF-α可使肿瘤细胞中NF-κB信号通路活化,进而增强CSN5表达。而姜黄素可通过抑制CSN5活性,从而降低炎症信号诱导的PD-L1表达上调[25-26]。
3 PD-L1的磷酸化
PD-L1可发生磷酸化修饰,其磷酸化位点主要位于胞外结构域。不同激酶诱导PD-L1不同位点的磷酸化,并产生不同效应。白细胞介素6(interleukin-6,IL-6)诱导杰纳斯激酶-1(Janus kinase-1,JAK1)活化,后者在内质网与PD-L1结合,并诱导PD-L1的Y112位点磷酸化,从而招募内质网相关N-糖基转移酶STT3A使PD-L1糖基化,增强PD-L1稳定性[27]。二甲双胍激活腺苷酸活化蛋白质激酶(adenosine-5'-monophosphate-activated protein kinase,AMPK),后者与PD-L1在内质网腔直接结合,使PD-L1在S195位点磷酸化,导致PD-L1的异常糖基化及内质网相关降解[15]。该过程通过降低PD-L1的稳定性和膜定位,抑制了肿瘤细胞的免疫逃逸。PDL1的T180和S184位点存在能够被GSK3β磷酸化的基序[6]。GSK3β诱导未糖基化的PD-L1磷酸化,促进PDL1与E3连接酶β-TrCP结合,导致PD-L1在细胞质中发生多聚泛素化而被降解。而N192、N200和N219位点的糖基化会造成了空间位阻,抑制GSK3β对PD-L1的磷酸化[6]。这表明β-TrCP介导的PD-L1降解是依赖GSK3β对PD-L1的磷酸化。有研究提出不依赖GSK3β的PD-L1降解途径,即mTORC1/p70S6K诱导PD-L1的磷酸化,从而引起β-TrCP介导的PD-L1降解[16]。该模型还有待后续研究加以证实。
4 PD-L1的棕榈酰化
棕榈酰化修饰是指将脂肪酰基通过硫酯键连接到靶蛋白的半胱氨酸上,这一过程由棕榈酰转移酶催化。据估算,约1 000种人源蛋白分子会发生棕榈酰化[28]。棕榈酰化可以影响蛋白质分子的稳定性、定位、运输和相互作用等。
PD-L1能够发生棕榈酰化修饰[29-30]。在不同类型的肿瘤中,介导PD-L1棕榈酰化修饰的棕榈酰转移酶可能不同。Yang等[30]报道,在乳腺癌中棕榈酰转移酶DHHC9(aspartate-histidine-histidine-cysteine 9)介导了PD-L1的棕榈酰化修饰。而Yao等[29]在小鼠结肠癌模型中发现棕榈酰转移酶DHHC3(aspartate-histidinehistidine-cysteine 3)可以使PD-L1发生棕榈酰化,从而抑制PD-L1的泛素化降解,提高PD-L1的表达水平。C272是PD-L1发生棕榈酰化修饰的位点[29]。研究者根据该位点附近的氨基酸序列特征设计竞争性多肽。该多肽可竞争性抑制PD-L1棕榈酰化,降低肿瘤细胞PDL1的表达水平并增强T细胞介导的抗肿瘤免疫反应。
5 PD-L1的乙酰化
乙酰化是通过赖氨酸乙酰化酶(lysine acetyl⁃transferases,KATs)将乙酰基从乙酰辅酶A转移到赖氨酸的ε-氨基侧链,这个过程可以被赖氨酸去乙酰化酶(lysine deacetylases,KDACs)逆转。50多年前,赖氨酸残基的ε氨基上的乙酰化作为组蛋白的翻译后修饰首次被发现,其在表观调控过程中至关重要。然而,乙酰化修饰的功能并不限制于细胞核内,在过去的30年里,乙酰化修饰的研究已经从组蛋白扩展其他蛋白分子上。
近期一项研究报道[31],乙酰基转移酶p300可以使PD-L1胞内域K263处发生乙酰化修饰,而去乙酰化酶HDAC2(histone deacetylases 2)可以使PD-L1去乙酰化。HDAC2使细胞膜上的PD-L1去乙酰化后,内吞接头蛋白亨廷顿蛋白相互作用蛋白1 相关蛋白(Huntingtin interacting protein 1-related,HIP1R)与PD-L1的C端特异性结合后,网格蛋白依赖性内吞接头蛋白复合体(AP-2)的β亚基(AP2B1)通过一个双亮氨酸基序D/E-x-xx-x-L-L/I识别HIP1R,并与PD-L1结合,形成复合体,在网格蛋白的介导下实现内吞,并在波形蛋白vimentin和内输蛋白importin-α的作用下,实现核转位,而PDL1的乙酰化会阻断其核转位。在癌细胞中敲除PD-L1,会在转录水平抑制一系列免疫相关基因的表达水平,如IFNs、NF-κB、MHCI通路相关基因。这提示,PD-L1可能入核发挥转录因子功能,与DNA元件结合并调控靶基因转录。靶向PD-L1的乙酰化修饰途径可阻断PDL1的核转位,这可为肿瘤免疫治疗提供新思路[31]。但是,去乙酰化反应是否是PD-L1发生核转位的必要条件,还有待进一步深入研究[32-33]。
6 结语与展望
PD-L1的翻译后修饰仍有很多值得探究的空间(图1),未来将有更多的翻译后修饰类型及其生物学意义被揭示。例如,有研究发现[22],肿瘤细胞在EGF刺激下,其PD-L1会发生单偶氮化。探索这些新型翻译后修饰会加深我们对PD-L1生物学功能的理解。同时,进一步研究各种PD-L1翻译后修饰类型之间的相互串扰也具有重要价值。
通过靶向PD-L1的翻译后修饰,降低或升高PD-L1的表达水平都可能成为肿瘤免疫治疗的新型候选策略,具有良好的临床转化前景。部分药物通过影响PD-L1翻译后修饰可抑制PD-L1表达,从而活化抗肿瘤免疫反应,如依托泊苷[7]和IPAG[10]等。而另外一些药物本身具有抑制肿瘤细胞增殖的作用,却能增加PD-L1的稳定性,提高PD-L1的表达水平,如CDK4/6抑制剂帕博西林(palbociclib)[21]。上述药物与PD-L1或PD-1抑制剂联合使用具有协同抑瘤效应。目前,有多项临床试验在进行中(编号:NCT04438824、NCT03294694、NCT04000529、NCT04213404、NCT04251169)。
目前,多数PD-L1翻译后修饰研究是以肿瘤细胞为模型。除肿瘤细胞外,PD-L1还表达于多种免疫细胞,如巨噬细胞[34]和T细胞[35]等。探索PD-L1在上述非肿瘤细胞中的翻译后修饰形式及其生物学意义可能会给肿瘤免疫治疗研究提供新的重要线索。深入研究PDL1的翻译后修饰可能为肿瘤免疫治疗的临床应用提供更好策略。

