牛磺酸-水解大豆蛋白复合体系对运动性 疲劳大鼠的影响
白海军,李志江*
(1.黑龙江八一农垦大学体育教研部,黑龙江 大庆 163000;2.黑龙江八一农垦大学食品学院,黑龙江 大庆 163000)
现今社会节奏的不断加快,高负荷的脑力与体力劳动者易出现疲劳症状,致使工作效率降低乃至威胁身心健康,研究表明通过适当补充抗疲劳外源活性物质,是一种方便、灵活的延缓疲劳手段[1-2]。目前已发现大量具有抗疲劳活性的物质,诸如多糖、多肽、植物多酚等,它们在具备抗氧化活性的同时还兼具抗疲劳作用,因而不断有学者根据疲劳产生的“自由基理论”尝试建立抗氧化能力与抗疲劳作用之间的联系[3],为抗疲劳功能产品的开发提供依据。牛磺酸作为功能性饮品的常见配料,已被大量研究证实能通过提高超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力、降低肝组织丙二醛(malondialdehyde,MDA)含量,减轻活性氧自由基对机体产生的氧化损伤,从而达到缓解疲劳的功效[4]。随着蛋白质工业技术的不断发展,水解蛋白日益成为国内外功能性食品的重要配料,其生物利用率高并含有大量可调节机体生理功能的抗氧化活性肽[5-6],能够有效抑制生物大分子过氧化反应并清除体内自由基[7],且能提高抗氧化酶活性、缓解疲劳[8]。张玉萍等[9]研究发现水解大豆蛋白在增强大鼠耐力的同时,还能够降低疲劳小鼠的血乳酸含量,验证了其具有抗疲劳活性。此外,刘晶等[10]认为具有抗疲劳作用的抗氧化物质之间存在协同作用,这种协同作用有利于增强抗疲劳功效。杨晓等[11]也发现大豆肽和牛磺酸混合之后对小鼠的抗疲劳效果优于大豆肽单体。
活性物质功效的评判通常需要建立动物学模型,目前水解大豆蛋白单体与牛磺酸单体的抗氧化活性与抗疲劳活性已被大量研究证实[12-13],由于建立动物学模型实验周期长、操作繁琐、成本较高,所以该方法不适用于两种或多种活性物质协同作用的功能性评价的初筛。因此,本实验拟选取商业水解蛋白以及牛磺酸单体复配牛磺酸-水解大豆蛋白(taurine-hydrolyzed soybean protein composite,TSPC),通过体外抗氧化实验对配方进行初期筛分,并通过大鼠运动性疲劳模型以及相关血液生化指标进行验证,从而更好地为抗疲劳补充剂协同作用的后续实验研究提供理论依据,以期为抗疲劳类产品的制备及活性评价提供思路。
1 材料与方法
1.1 动物、材料与试剂
SPF级SD种8 周龄雄性健康大鼠50 只(使用许可证号: SYXK(黑)2016-004),个体质量约(220±20)g, 购自东北农业大学动医学院实验动物中心,饲养期间给予啮齿类动物标准颗粒饲料及自由饮水,饲养环境条件:恒定相对湿度55%、室温(25±1)℃。
水解大豆蛋白(hydrolyzed soybean protein,HSP)、大豆分离蛋白(soy protein isolate,SPI) 山东禹王集团有限公司;牛磺酸、邻苯三酚 北京百灵 威科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma 公司;生化指标检测试剂盒 上海碧云天生物技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UV-2600紫外-可见分光光度计 日本岛津公司;FC酶标仪 美国赛默飞世尔科技公司;磁力搅拌器 德国IKA公司;大鼠跑台 北京智鼠多宝生物科技有限责任公司。
1.3 方法
1.3.1 HSP的水解度测定
HSP的水解度采用三氯乙酸(trichloroacetic acid,TCA)沉淀法进行分析[14],根据TCA沉淀蛋白的特性,以可溶性氮质量分数表征水解度,将1 mg/mL HSP或SPI溶液与质量分数10% TCA等体积充分混合后,在6000×g条件下离心15 min,并用凯氏定氮法测定沉淀中的氮质量。可溶性氮质量分数按公式(1)计算。
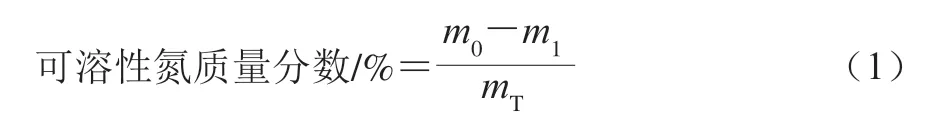
式中:m0表示SPI中TCA-沉淀氮质量/mg;m1表示HSP中TCA-沉淀氮质量/mg;mT为SPI中的总氮质量/mg。
1.3.2 TSPC的制备
在室温下准确称取牛磺酸和HS P并用去离子水稀释,控制HSP的质量浓度为0.5 g/L,并使牛磺酸与HSP的质量浓度比分别为1∶10、1∶20、1∶30、1∶40、1∶50,以0.5 g/L HSP和0.5 g/L SPI溶液为对照组,在200 r/min下磁力搅拌20 min使样品充分混合,最后在3000 r/min条件下均质2 min。
1.3.3 TSPC、SPI体外抗氧化性的测定
1.3.3.1 DPPH自由基清除能力的测定
参考蔡俊等[15]的方法并稍加修改,用无水乙醇配制质量浓度为50 μg/mL的DPPH溶液,用移液枪吸取DPPH溶液1.5 mL、TSPC或SPI 25 µL置于96 孔平板,充分 振荡混匀后于25 ℃恒温暗箱中孵育30 min,以无水乙醇代替DPPH溶液作为对照,测定517 nm波长处的吸光度, 按公式(2)计算DPPH自由基清除率。
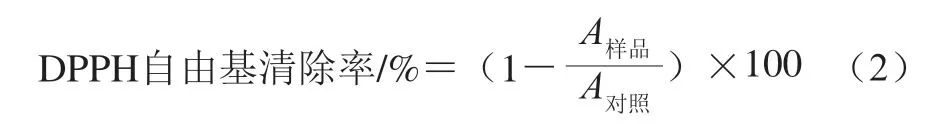
1.3.3.2 超氧阴离子自由基清除能力的测定
参考马诗文等[16]的方法,取TSPC或SPI 200 μL与5.76 mL的Tris-HCl缓冲液(50 mmol/L、pH 8.2)充分振荡混匀,于25 ℃孵育10 min后加入40 μL邻苯三酚(25 mmol/L),随后每隔1 min测定320 nm波长处的吸光度,作吸光度随时间变化的回归方程,方程斜率即为自氧化速率(ΔA1),以蒸馏水为对空白对照(回归方程斜率ΔA0),超氧阴离子自由基清除率按公式(3)计算。

1.3.3.3 抗脂质过氧化能力的测定
参照吴瑕等[17]的方法并稍作修改。将1 mL TSPC或SPI、3 mL 0.02 mol/L硫代巴比妥酸溶液和17 mL质量分数7.5%三氯乙酸-盐酸溶液充分混合并沸水浴30 min,冷却至室温后取样并与20 mL氯仿混合,3000 r/min离心15 min后取上清液,测定其在532 nm波长处的吸光度(A532nm),以每升脂质氧化样品溶液中丙二醛的质量表示硫代巴比妥酸反应物(thiobarbituric acid reactive species,TBARS)值,具体按式(4)计算。
式中:V为样品溶液的体积(1 mL)。
1.3.4 TSPC抗疲劳实验
1.3.4.1 运动性疲劳大鼠模型的建立
参考陈艳华等[18]的方法,选取健康雄性SD种大鼠50 只并随机分为5 组,设立对照组以及疲劳模型组,再根据TSPC体外抗氧化活性的差异设立牛磺酸高(A组,1∶10)、中(B组,1∶20)、低(C组,1∶30)剂量组。除正常对照组外,其余大鼠进行持续20 min的跑台适应性训练5 d,跑台速率由12 m/min逐渐提升至24 m/min。从第6天起,跑台速率控制在24 m/min持续40 min,运动负荷强度相当于60%~70%的最大摄氧量,每6 d休息1 d,7 d为一个周期,约21 d后大鼠出现行典型运动性疲劳行为学异常状况,如动作迟缓、鼠毛稀疏、食欲减退等,视为造模成功,采取灌胃法给予大鼠TSPC溶液,正常组及模型组给予生理盐水,每次灌胃3 mL/只,持续训练15 d直至实验结束。
1.3.4.2 跑台耐力实验
跑台耐力实验实施胃饲的最后一天,跑台速率控制在32 m/min,使其运动负荷强度高于90%的最大摄氧量。在大鼠跑步过程中采用电刺激以保持其持续的运动强度,当大鼠不能维持跑步状态时,允许其休息2 min,控制累计 休息时间10 min,在累计休息时间超过10 min后,连续刺激仍无法保持强度的状态记为力竭,并记录总运动时间。
1.3.4.3 生化指标检测方法
最后一组跑台耐力实验结束后立即处死大鼠,眼球取血并将采集到的新鲜血液于4 ℃静置1 h后,在3000 r/min 条件下分离15 min取上层血清,乳酸(lactic acid,LA)浓度、血尿素氮(blood urea nitrogen,BUN)浓度、SOD活力、GSH-Px活力、过氧化氢酶(catalase,CAT)活力和丙二醛(malondialdehyde,MDA)浓度严格按照试剂盒操作说明测定,剩余血清保存于-70 ℃超低温冰箱中备用。
1.4 数据处理与分析
应用SPSS 19.0软件对数据进行处理,实验数据以平均值±标准偏差表示,多样本平均值间比较采用单因素方差分析检验,各组间多重比较采用最小显著性差异(least significant difference,LSD)法,水迷宫数据采用重复设计性方差分析,P<0.05为差异有显著性。采用Origin 2017软件作图。
2 结果与分析
2.1 不同配比对TSPC体外抗氧化活性的影响
本实验通过DPPH自由基清除能力、超氧自由基清除能力以及抗脂质过氧化能力对TSPC进行综合评判。根据TCA法测定HSP水解度为(35.32±1.23)%,并可以发现HSP的体外抗氧化指标均高于未处理的SPI。
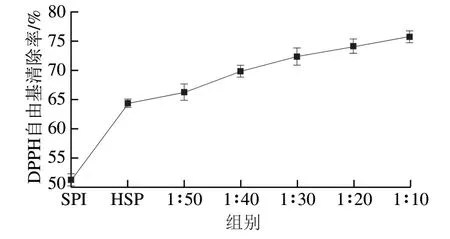
图 1 TSPC对DPPH自由基清除作用Fig. 1 Scavenging effect of TSPC on 1,1-diphenyl-2-picrylhydrazyl radical
DPPH自由基清除能力是一种被用于评判物质是抗氧化活性的指标,DPPH的乙醇溶液呈蓝紫色,在517 nm波长处具有最大吸收峰,具有自由基清除能力的物质所提供的电子会与DPPH结合从而使其褪色。如图1所示,5 种配比的TSPC均具有DPPH自由基清除能力,并与牛磺酸在溶液中所占的比例呈正相关,SPI的DPPH自由基清除能力相对较低。当牛磺酸与HSP质量浓度比为1∶10时,复合体系对DPPH自由基的清除能力最大(75.8%)。
超氧阴离子自由基具有极强的生物毒性,清除超氧阴离子自由基的能力可用来判断被测物的抗氧化能力,在本实验中邻苯三酚自氧化形成的超氧阴离子自由基 有色产物的浓度与320 nm波长处的吸光度呈线性关系。如图2所示,当牛磺酸与HSP质量浓度比低于1∶20时,超氧阴离子自由基清除率随HSP比例增加呈上升趋势;当质量浓度比超过1∶20后呈平稳趋势,质量浓度比达到1∶20时超氧阴离子自由基清除率最大,达到71.4%。
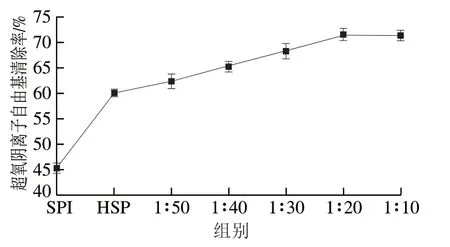
图 2 TSPC对超氧阴离子自由基清除作用Fig. 2 Scavenging effect of TSPC on superoxide anion radical
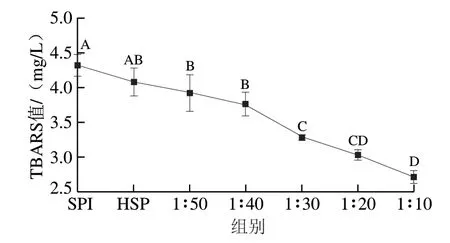
图 3 TSPC抗脂质过氧化能力Fig. 3 Anti-lipid peroxidation capacity of TSPC
抗脂质过氧化能力可以通过TBARS法测定,其原理是脂质氧化的重要终产物MDA可与硫代巴比妥酸发生颜色反应,并在532 nm波长处具有最大吸收,吸光度越低说明抗脂质过氧化能力越强。如图3所示,SPI与水解SPI的抗脂质过氧化能力相对较弱,随着牛磺酸与HSP质量浓度比增加,TBARS值逐渐降低,质量浓度比低于1∶30时TBARS值与对照HSP组无显著差异(P>0.05),当质量浓度比超过1∶30后TBARS值显著降低(P<0.05),质量浓度比达到1∶10时抗脂质过氧化能力最强。
根据上述体外抗氧化指标的综合分析,最终选取1∶10(A组)、1∶20(B组)、1∶30(C组)3 种质量浓度比对TSPC进行动物实验,从耐力跑台以及体内生化指标共同探究TSPC抗氧化活性与抗疲劳功能的关系。
2.2 TSPC抗疲劳实验结果
2.2.1 大鼠力竭跑台运动时间
运动耐力的时间能客观机体的疲劳程度,是评判实验样本抗疲劳功效最直观的指标。实验结果见表1,与对照组相比,模型组的运动时间显著缩短(P<0.05),说明模型组出现了疲劳症状,经过15 d胃饲后,A、B、C组的运动时间与模型组相比具有统计学差异 (P<0.05),分别提升了61.2%、55.8%、37.4%,A组运动时间最长,C组运动时间最短,但A、B两组间无显著性差异(P>0.05)。

表 1 TSPC对大鼠运动时间及血清LA、BUN浓度的影响Table 1 Effect of TSPC on exercise endurance time and serum LA and BUN concentrations in rats
2.2.2 大鼠血清LA、BUN浓度
通过对血清中LA和BUN浓度可判断大鼠在运动后的疲劳程度及恢复状况,实验结果见表1。经各剂量组饲喂后,与模型组相比,C、B、A组使大鼠体内LA浓度分别降低了4.07%、7.94%、15.39%,C组与模型组相比不能使LA浓度显著降低,A、B组能够显著降低LA浓度 (P<0.05),且A组降低LA浓度的能力最佳,但仍与对照组具有差异。模型组的BUN浓度与对照组相比具有显著差异(P<0.05),与模型组相比剂量组均能显著降低BUN浓度(P<0.05),A组效果最佳,降低了20.79%,
综上,表明TSPC能够一定程度上通过减少LA积累、降低BUN浓度,达到相应的缓解疲劳作用。
2.2.3 大鼠体内抗氧化活性
牛磺酸和HSP都能参与机体的抗氧化生物进程,一般可通过增强SOD、GSH-Px和CAT活性,减少因机体由自由基的过量堆积和清除过缓而诱发的加速衰老、癌症等一系列疾病的可能,由于测定血液和组织中自由基水平比较困难,而检测血液和组织中抗氧化酶则比较容易,可由此来间接反映机体内自由基累积水平[19-23]。
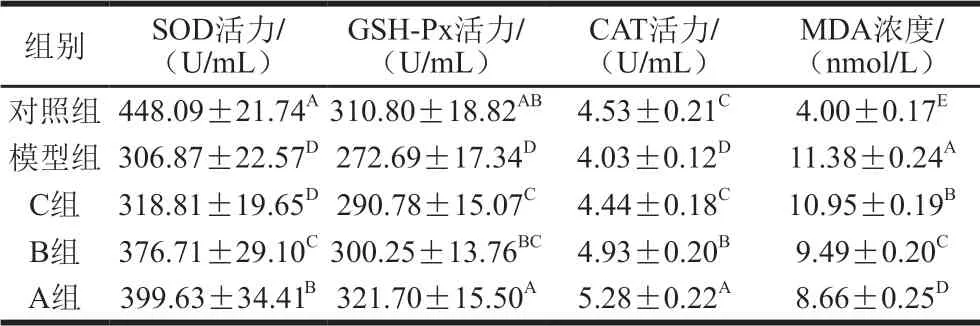
表 2 TSPC对大鼠血清SOD、GSH-Px、CAT活力和MDA浓度的影响Table 2 Effect of TSPC on serum SOD, GSH-Px and CAT activity and MDA concentration in rats
SOD广泛存在于机体细胞中,是超氧阴离子自由基的唯一底酶,主要通过催化超氧阴离子自由基产生歧化反应,从而清除体内产生的活性氧自由基并保护细胞膜系统结构与功能的完整性[24]。由表2可知,模型组中SOD的活力显著低于对照组(P<0.05),C组未能对SOD的活力产生显著影响(P>0.05),A、B组的SOD活力与模型组相比差异显著(P<0.05),分别提高了30.23%、22.76%。
由表2可知,模型组中GSH-Px的活力显著低于对照组(P<0.05),与模型组相比,3 组TSPC均能够显著提高GSH-Px活力(P<0.05),B、C两组间GSH-Px活力无显著性差异(P>0.05),A、B两组与对照组相比GSH-Px活力无显著差异(P>0.05),说明A、B两组均能使大鼠机体内GSH-Px活力达到正常水平,与模型组相比,A组的提高效果最为明显,约提高了17.97%。由表2可知,CAT活力在运动性疲劳造模后显著降低(P<0.05), C组的TSPC可使CAT活力恢复至对照组水平,且A、B组能将CAT活力显著高于对照组(P<0.05)。
当体内MDA浓度超过机体代谢能力时,自由基便会诱导不饱和脂肪酸形成脂质过氧化物,并导致细胞与组织的氧化损伤,因此MDA浓度也是一种用以评估由自由基导致体内脂质过氧化程度的有效指标[25]。由表2可知,模型组大鼠血清中MDA浓度显著高于对照组 (P<0.05),在饲喂TSPC后,A、B、C组均能够使大鼠血清中MDA的浓度显著低于模型组(P<0.05)。
2.3 TSPC抗氧化活性与抗疲劳能力的相关性
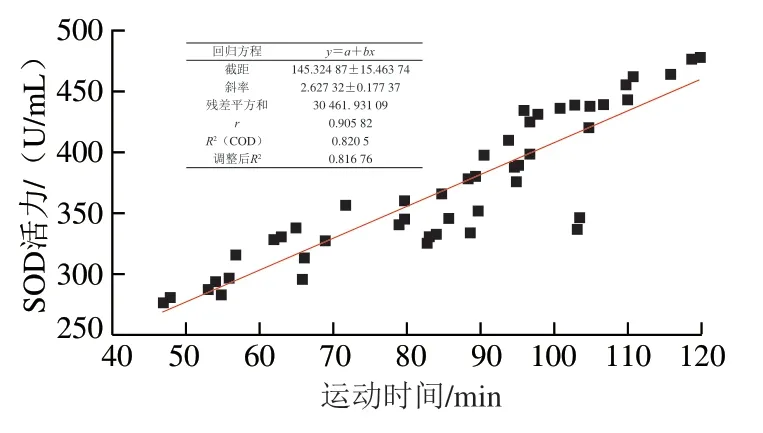
图 4 大鼠TSPC抗氧化活性与抗疲劳能力的相关性Fig. 4 Correlation between antioxidant activity and anti-fatigue capacity of TSPC in rats
为确立TSPC抗氧化活性与抗疲劳能力间的联系,分别以对照组、模型组、A组、B组、C组的SOD活力为纵坐标,耐力运动时间为横坐标绘制散点图。如图4所示,通过线性回归方程拟合计算,体内抗氧化活性与抗疲劳能力决定系数R2为0.8205,显著水平经F检验为0.01,证明在该运动模型下大鼠的抗氧化活性与抗疲劳能力呈正相关。
3 讨 论
疲劳是机体的一种自我保护反应,它被描述为“机体在生理过程中不能持续维持其在特定水平上运动强度的生理现象”[26],“自由基理论”是对其产生的较为统一学说,其原理是机体高强度运动会导致体内活性氧自由基的生成和清除速率失衡,致使活性氧积累机体处于氧化应激状态,当体内自由基浓度升高,体内消除自由基抗氧化酶活性提高,但所积累的自由基一旦超出酶的清除能力范围,就会对生物膜系统造成氧化损伤,引发副反应并最终导致运动性疲劳的产生、机体工作能力下降[27]。
在体外抗氧化活性研究中所筛选3 个TSPC剂量组,其体内抗氧化活性与体外抗氧化活性强弱的趋势基本保持一致,抗氧化物酶的活性增加以及MDA含量降低直接证明了TSPC能够通过清除自由基缓解运动性疲劳所导致的氧化损伤。
在本实验的力竭跑台实验中,大鼠在剧烈的运动过程中,为了满足机体能量代谢的需求,体内无氧环境下通过糖酵解途径供给能量并产生代谢产物LA[28],与此同时肝脏也会消耗部分氨基酸与蛋白质参与能量的供给并产生代谢产物BUN[29],它们二者均会通过血液进入循环系统中,因而通过对二者浓度进行分析以及力竭运动时长的比对,能有效评判大鼠的疲劳程度以及TSPC的抗疲劳效果。结果显示在运动性疲劳模型下,TSPC中牛磺酸占比越高,LA、BUN浓度越低、耐力运动时长越长,表明TSPC具有良好的抗疲劳效果,且与牛磺酸呈剂量-效应关系。
最后本实验根据SOD活力与运动时长的相关系数证实,TSPC的抗氧化活性与抗疲劳能力呈正相关,陈园园等[30]在对大豆低聚肽的研究中与得到本实验一致的结论。因此,可以根据体外抗氧化实验对多种原料复配的抗疲劳效果进行初筛。
4 结 论
本实验采用了体外抗氧化实验对牛磺酸与HSP的质量浓度比进行了筛选,根据实验结果最终选取了1∶10、1∶20、1∶303 种比例进行动物实验,通过运动性疲劳大鼠实验模型发现各组均表现出一定的体内抗氧化活性,可提高SOD、GSH-Px、CAT活力,降低MDA浓度,从而减轻过氧化损伤程度,并通过LA、BUN浓度降低以及运动时间延长的结果验证了TSPC具有一定的抗疲劳能力,其中质量浓度比为1∶10时效果最佳。最后通过计算体内抗氧化活性与抗疲劳能力相关性,确立了TSPC体内抗氧化活性在本实验中运动性疲劳模型下与抗疲劳能力正相关,表明可以根据体外抗氧化实验对抗疲劳产品的配比进行初筛,从而为进一步开发以水解蛋白和牛磺酸为基础原料的复合功能抗疲劳产品提供了理论依据。

