原料肉贮藏时间对牛肉发酵香肠中微生物菌相变化和蛋白质降解的影响
徐 晔,刘诗宇,王艺伦,牛淑慧,杨壹芳,余沁芯,肖子涵,刘书亮,何 利,陈姝娟,刘爱平,杨 勇*
(四川农业大学食品学院,四川 雅安 625014)
发酵香肠是指将绞碎的肉、皮下脂肪、盐、糖、发酵剂和各类香辛料等充分混合后灌入肠衣,在自然或人工操控的条件下,利用微生物的发酵作用,再经过后期干燥成熟制成的具有良好贮藏性和典型发酵风味、色泽与质地的发酵肉制品[1]。原料肉的品质直接影响产品加工过程及最终产品中游离氨基酸含量、微生物种类和数量,进而影响生物胺的产生与积累。原料肉如果处理不当或受到污染就会积累不同种类和数量的微生物,而这些微生物可能在加工制作前就已经产生一定量的某些生物胺,随着后期生产加工,原料肉带入的某些微生物可能会继续生长繁殖,通过脱羧作用产生更多生物胺,从而影响香肠的品质及安全性[2]。发酵香肠多以降温至0~4 ℃的肉为原料,但随着贮藏时间的延长,原料肉中污染的嗜冷菌仍会不断积累,在微生物和酶的共同作用下,肌肉蛋白质发生降解,从而使挥发性盐基氮、氨基酸态氮以及游离氨基酸含量上升[3],而产生的游离氨基酸会作为生物胺的前体物质,在微生物的作用下形成生物胺,导致生物胺的积累[4]。
生物胺是由氨基酸脱羧或醛和酮氨基化生成的具有生物活性的小分子质量含氮有机化合物[5]。适量生物胺可以维持正常的内脏功能和免疫系统的代谢活性[6],然而过量的生物胺会对人体心脏和中枢神经系统等造成 损害[7]。发酵香肠中生物胺主要是由氨基酸在具有氨基酸脱羧酶活性的微生物作用下脱羧产生,主要有组胺、腐胺、尸胺、酪胺4 种,色胺、苯乙胺、亚精胺含量 较少[8]。Tosukhowong等[9]研究发现,用新鲜肉制成的发酵香肠生物胺含量均低于-20 ℃贮藏2 d、4 ℃贮藏2 d、30 ℃贮藏6 h的原料肉制成的香肠,表明原料肉的贮藏温度和贮藏时间很可能会影响肉制品中生物胺的含量。目前相关研究多为不同贮藏条件下原料肉对香肠安全质量的影响,而0~4 ℃贮藏不同时间的原料肉对香肠安全质量影响的研究鲜见报道。
本研究以新鲜牛肉为原料,在0~4 ℃冷藏条件下分别贮藏不同时间(0、12、24、36 h)后制作成发酵香肠,然后分析香肠在发酵、成熟和干燥过程中微生物菌相变化以及蛋白质降解所致含氮化合物和生物胺含量的变化,探索原料肉的贮藏时间对发酵香肠安全质量的影响,为牛肉发酵香肠生产中生物胺的有效控制提供参考。
1 材料与方法
1.1 材料、菌种与试剂
新鲜牛后腿肉购于四川雅安市屠宰场,置于冰盒中迅速转移至实验室;猪肥膘、肠衣、食盐等调料均购于四川雅安市苍坪山农贸市场。
植物乳杆菌(Lactobacillus plantarum)为四川农业大学食品学院肉品科学与技术实验室从川味香肠中筛选出的肉品发酵菌株。
PCA、MRS、PDA、VR生物胺合成培养基 雅安万科有限责任公司;细菌基因组DNA提取试剂盒 美国Omega公司;生物胺标准品、丹磺酰氯等 美国Sigma公司;乙腈、丙酮、甲醇(色谱纯) 成都化学试剂有限公司;蒸馏水和超纯水为实验室自制。
1.2 仪器与设备
BCD-539WDCO型电冰箱 青岛海尔股份有限 公司;SYQ-DSX-280型高压蒸汽灭菌锅 上海申安医疗器械有限公司;BMS602型均质机 德国BRT公司;LHS-250SC型恒温恒湿培养箱 上海荣丰科学仪器有限公司;LC-2010CHT型高效液相色谱仪、LC-solution型工作站 日本岛津公司;Sorvall ST 16R型高速冷冻离心机 美国Thermo Fisher Scientific公司;LA8080型超高速全自动氨基酸分析仪 日本日立高新技术公司。
1.3 方法
1.3.1 发酵牛肉香肠的制作
将牛肉切割成5 cm×2 cm×2 cm的肉条,分成4 份置于无菌的自封袋内,于0~4 ℃冰箱中分别贮藏0、12、24、36 h,得到4 种不同贮藏时间的原料牛肉,参考巩洋等[10]的配方和工艺流程制作为香肠。以植物乳杆菌作为发酵剂,接种量为107CFU/g。经预实验优化后,确定发酵香肠的加工工艺参数为:发酵温度18 ℃、相对湿度70%、时间8 h;成熟温度13 ℃、相对湿度55%、时间120 h;干燥温度55 ℃、时间24 h。
1.3.2 样品的采集
参考巩洋等[10]的样品采集方式,在发酵香肠的生产过程中共设置5 个采样点,分别为:原料肉(刚采购回实验室的新鲜牛肉以及不同时间贮藏处理后的牛肉)、发酵结束(从发酵工艺开始,至发酵8 h为止)、成熟中期(从发酵工艺结束开始,至成熟60 h为止)、成熟结束(从发酵工艺结束开始,至成熟120 h为止)、干燥结束(从成熟工艺结束开始,至干燥24 h为止)。每个采样点各取3 份样品(200 g左右),将用于高通量测序的样品迅速保存于-80 ℃冰箱内,其余指标测定需立即进行。
1.3.3 菌落总数和大肠菌群数的测定
菌落总数的测定参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[11]。
大肠菌群数的测定参照GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群测定》[12]中的第二法,即大肠菌群平板计数法。
1.3.4 高通量测序检测微生物多样性
细菌总DNA的提取:采用细菌组DNA提取试剂盒提取样品细菌的总DNA。经质量分数1.0%的琼脂糖凝胶电泳检测后,于-20 ℃条件贮藏备用。
聚合酶链式反应(polymerase chain reaction,PCR)扩增:扩增体系(25 μL):5×反应缓冲液5 μL、5×GC缓冲液5 μL、dNTP(2.5 mmol/L)2 μL、正向引物(10 μmol/L)1 μL、反向引物(10 μmol/L)1 μL、DNA模板2 μL、双蒸水8.75 μL、Q5 DNA 聚合酶0.25 μL。扩增参数:预变性98 ℃ 2 min;变性98 ℃ 15 s,退火55 ℃ 30 s,延伸72 ℃ 30 s,25~30 次循环;最终延伸72 ℃ 5 min。
高通量测序:提取的样品DNA送至上海派森诺公司进行Illumina Miseq高通量测序,测序区域为细菌16S rDNA的V3~V4可变区,引物为:338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’),扩增片段长度约为500 bp。基因序列的生物信息学分析[13]:1)操作分类单元(operational taxonomic units,OTU)聚类和物种分类分析:提取非重复序列,与数据库中的16S核糖体序列进行比对,相似性在97%以上的序列归并,生成OTU;2)菌群分类学分析:将OTU中全部序列与Silva数据库[14]进行比对,找出其最相近且可信度达80%以上的种属信息。并将每一个OTU中的所有序列进行类比,找出同一OTU中不同序列最近祖先的种属信息。根据Silva数据库中的参考序列对OTU进行种属鉴定;根据分类学分析比对结果,在各个分类水平上对样品中群落结构进行菌群种类和丰度分析。
1.3.5 含氮化合物含量测定
1.3.5.1 总挥发性盐基氮含量测定
总挥发性盐基氮(total volatile base nitrogen,TVB-N)含量参照 GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[15]中第二法进行测定,单位为mg/100 g。
1.3.5.2 氨基酸态氮含量测定
氨基酸态氮(amino acid nitrogen,AAN)含量参照GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》[16]中第一法进行测定,单位为g/100 g。
1.3.5.3 游离氨基酸含量测定
游离氨基酸(free amino acids,FAA)含量的测定参考Lorenzo等[17]的方法,超高速全自动氨基酸分析仪上机检测之前通过0.22 μm的过滤器进行样品的注射过滤。
1.3.6 生物胺含量测定
参考张楠等[18]的方法,样品经丹磺酰氯丙酮溶液进行柱前衍生后,采用高效液相色谱法测定其中生物胺含量,单位为mg/kg。
1.4 数据处理与分析
本研究所有实验均设3 次重复,结果表示为平均值± 标准差,所有涉及含量的结果均以干质量计。采用SPSS 19.0软件进行方差分析,P<0.05为显著性差异。使用Microsoft Excel 2007软件作图。
2 结果与分析
2.1 牛肉贮藏时间对牛肉发酵香肠中微生物的影响
2.1.1 菌落总数
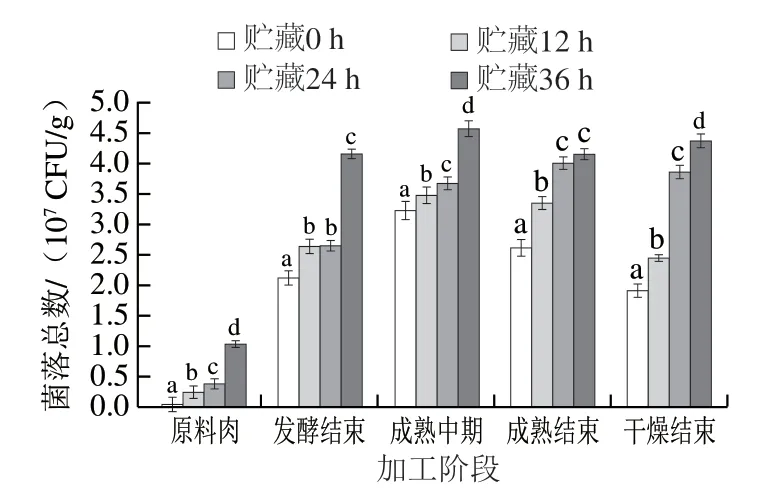
图 1 牛肉发酵香肠加工过程中菌落总数的变化Fig. 1 Changes in total bacterial count of fermented beef sausages during processing
由图1可知,在香肠加工过程中,4 组香肠中菌落总数均呈先上升后下降的趋势,这是因为香肠发酵阶段温度较高、湿度较大,利于微生物的生长繁殖,而成熟阶段温度、水分含量的降低以及发酵剂产生大量酸,导致香肠内pH值下降,微生物的生长繁殖受到抑制。对比不同处理组可知,发酵香肠中的菌落总数随原料肉贮藏时间的延长而增加,贮藏36 h组的菌落总数均显著高于其他3 组(P<0.05),说明牛肉在0~4 ℃贮藏过程中仍有微生物不断积累。其中,贮藏36 h牛肉与未经贮藏牛肉加工的香肠对比,菌落总数平均值由2.40×107CFU/g增加到4.03×107CFU/g(P<0.05)。
2.1.2 大肠菌群数
大肠菌群数是衡量原料肉卫生质量与肠道致病菌的重要指标[19]。由图2可知,在香肠加工过程中,4 组香肠中大肠菌群数均呈先上升再下降,最后降为0的趋势, 干燥阶段降为0是因为55 ℃、24 h的干燥环境会使大肠菌群失活或死亡。对比不同处理组可知,贮藏0 h组在整个加工过程中大肠菌群数最低,且显著低于贮藏36 h组 (P<0.05)。结果表明,未经贮藏的原料牛肉制作的发酵香肠中大肠菌群数一直处于最低水平。
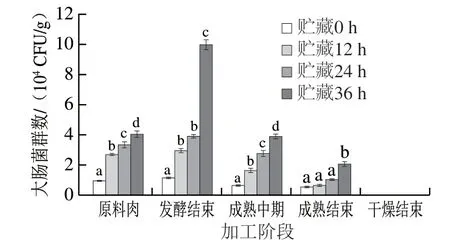
图 2 牛肉发酵香肠加工过程中大肠菌群数的变化Fig. 2 Changes in coliform count of fermented beef sausages during processing
2.1.3 高通量测序检测微生物结果
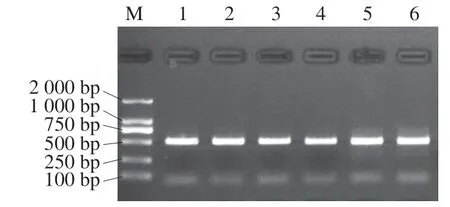
图 3 细菌16S rDNA的V3~V4区PCR产物电泳图Fig. 3 Electrophoresis of polymerase chain reaction products of the V3-V4 region of bacterial 16S rDNA
由图3可知,对细菌的V3~V4可变区进行PCR扩增,6 个样品均扩增成功,扩增片段长度约为500 bp,回收浓度均高于后续建库要求。将0~4 ℃贮藏0 h和36 h的牛肉分别制作发酵香肠,分别采集不同加工阶段的样品进行微生物的高通量测序分析,结果见表1。
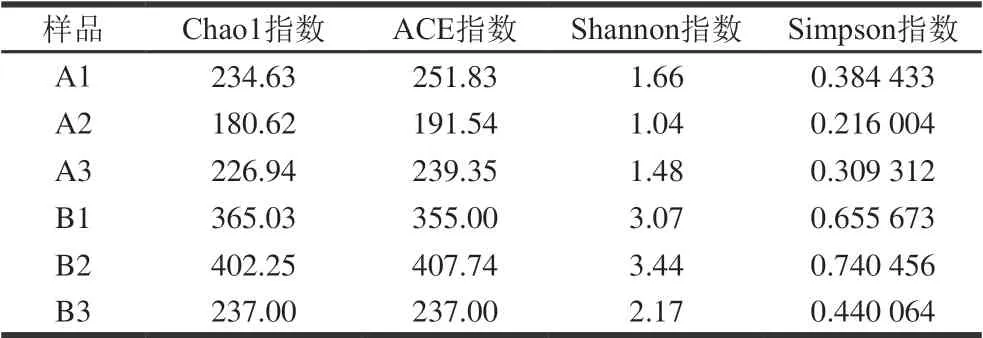
表 1 牛肉发酵香肠菌群多样性指数Table 1 Bacterial diversity indexes of fermented beef sausages
Chao1和ACE指数均为丰富度指数,用来估计群落中实际存在的物种数,指数越大,表明群落丰富度越高;Shannon和Simpson指数均为多样性指数,分别用来估计群落的丰富度和均匀度,值越大,表明群落多样性 越高[21-23]。由表1可知,B1、B2、B3的Chao1指数和ACE指数整体上高于A1、A2、A3,说明贮藏36 h牛肉制作的香肠中微生物群落丰富度更高;B1、B2、B3的Shannon指数和Simpson指数均高于A1、A2、A3,说明贮藏36 h牛肉制作的香肠中微生物群落多样性更高。其中,贮藏36 h牛肉与未经贮藏牛肉加工的香肠相比Shannon指数平均值由1.39增长为2.89。
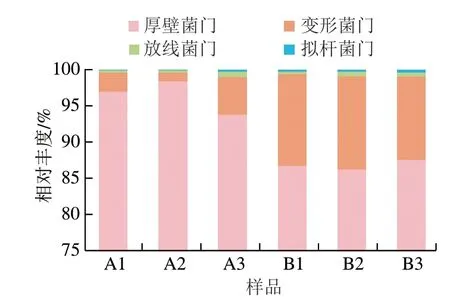
图 4 牛肉发酵香肠中微生物基于门水平上的变化Fig. 4 Changes in bacterial community composition in fermented beef sausages at the phylum level
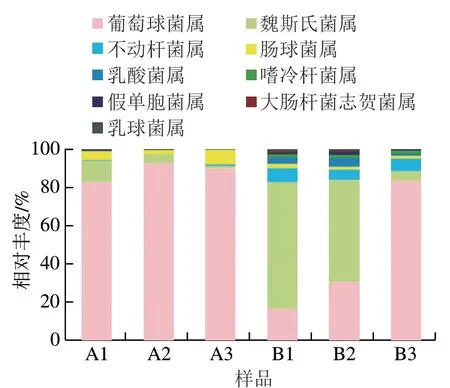
图 5 牛肉发酵香肠中微生物基于属水平上的变化Fig. 5 Changes in bacterial community composition in fermented beef sausages at the genus level
根据OTU划分和分类鉴定结果,可以获得每个样本在门、属水平的具体组成,结果分别如图4、5所示。在门水平,A组中厚壁菌门(Firmicutes)丰度最高,B组中变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)相对丰度最高,变形菌门包括较多病原菌,如大肠杆菌、沙门氏菌等。Santos等[24]研究的30 株大肠杆菌均有鸟氨酸和赖氨酸脱羧酶活性,经脱羧作用可以将鸟氨酸和赖氨酸转化为腐胺和尸胺。在属水平,A组中葡萄球菌属(Staphylococcusspp.)占比最高。葡萄球菌常存在于发酵肉制品中,可降解蛋白质、脂肪以促进风味物质的形成,消除过氧化氢[25],有研究证实葡萄球菌属微生物还具有降解生物胺的能力[26]。B1、B2中魏斯氏菌属(Weissellaspp.)相对丰度最高,魏斯氏菌已被证实为发酵食品中的产胺菌[27]。Takebe等[28]研究表明从日本豆腐酱中分离得到的魏斯氏菌均为生物胺产生菌,且均具有酪氨酸脱羧酶基因和组氨酸脱羧酶基因。Pereira等[29]选择一株既能发生鸟氨酸脱羧反应,又能发生精氨酸脱羧反应的魏斯氏菌(Weissella halotoleransW22)进行研究,结果表明这株菌具有反转运精氨酸、产生腐胺的作用,从而导致肉制品中腐胺的产生与积累。B3中葡萄球菌属相对丰度最高。综上所述,贮藏0 h牛肉制作的香肠在加工过程中优势菌群为多具有降解生物胺能力的葡萄球菌;贮藏36 h牛肉制作的香肠在发酵阶段优势菌群为魏斯氏菌,成熟阶段优势菌群为葡萄球菌,其中魏斯氏菌可能与生物胺形成有关。
2.2 原料肉贮藏时间对牛肉发酵香肠中含氮化合物含量的影响
2.2.1 对牛肉发酵香肠中TVB-N含量的影响

图 6 牛肉发酵香肠加工过程中TVB-N含量的变化Fig. 6 Changes in TVB-N content of fermented beef sausages during processing
TVB-N指动物性食品在腐败过程中,酶和细菌的作用使得蛋白质分解而产生氨及胺类等碱性含氮物质,其含量越高,表明氨基酸被破坏得越多[30]。由图6可知,在香肠加工工程中,4 组香肠中TVB-N含量均呈上升趋势,这是因为香肠发酵和成熟过程中,微生物产生的蛋白酶和氨基酸脱羧酶等不断分解蛋白质产生氨和胺类物质,而这些化合物通常具有挥发性;对比不同处理组可知,同一加工阶段时贮藏0 h组中TVB-N含量(6.49~19.78 mg/100 g)显著低于贮藏36 h组(8.41~32.34 mg/100 g)(P<0.05),可能是因为随着贮藏时间延长,微生物数量增加,产生的蛋白酶较多,蛋白质在其作用下产生的TVB-N也较多。
2.2.2 对牛肉发酵香肠中ANN含量的影响
由图7可知,在香肠加工过程中,4 组香肠中含量大体呈缓慢上升再趋于稳定的规律,这可能是由于前期蛋白质降解产生游离氨基酸和多肽,后期氨基酸和多肽会在微生物和酶的作用下进一步降解或脱羧、脱氨生成醛酮等小分子化合物,使得AAN含量变化不明显。对比不同处理组可知,贮藏0 h组中AAN含量(最高为0.28 g/100 g,最低为0.15 g/100 g)显著低于贮藏36 h组(最高为0.38 g/100 g,最低为0.29 g/100 g)(P<0.05), 可能是因为贮藏时间的延长导致细胞中水分渗出,原料肉中水分含量减少,制作的香肠中盐含量相对增大,脱羧酶活性受到抑制,同时微生物大量生长繁殖,蛋白质在其作用下降解产生氨基酸等小分子化合物[31], 使得氨基酸大量积累,AAN含量增多,这与本研究中菌落总数的变化结果一致。
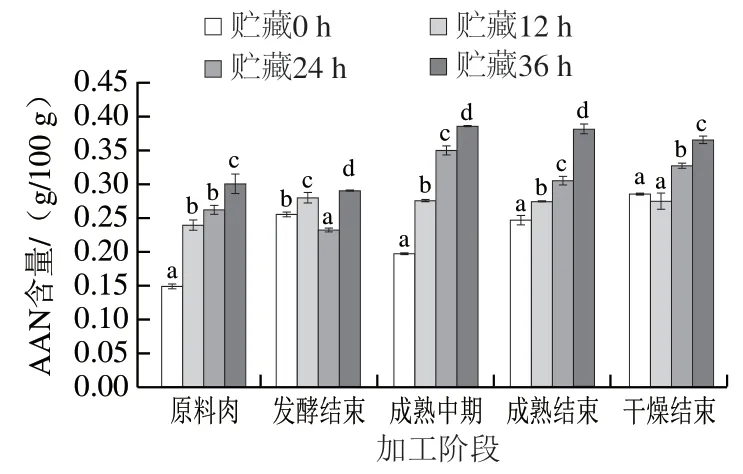
图 7 牛肉发酵香肠加工过程中AAN含量的变化Fig. 7 Changes in amino acid nitrogen content of fermented beef sausages during processing
2.2.3 对牛肉发酵香肠中FAA含量的影响
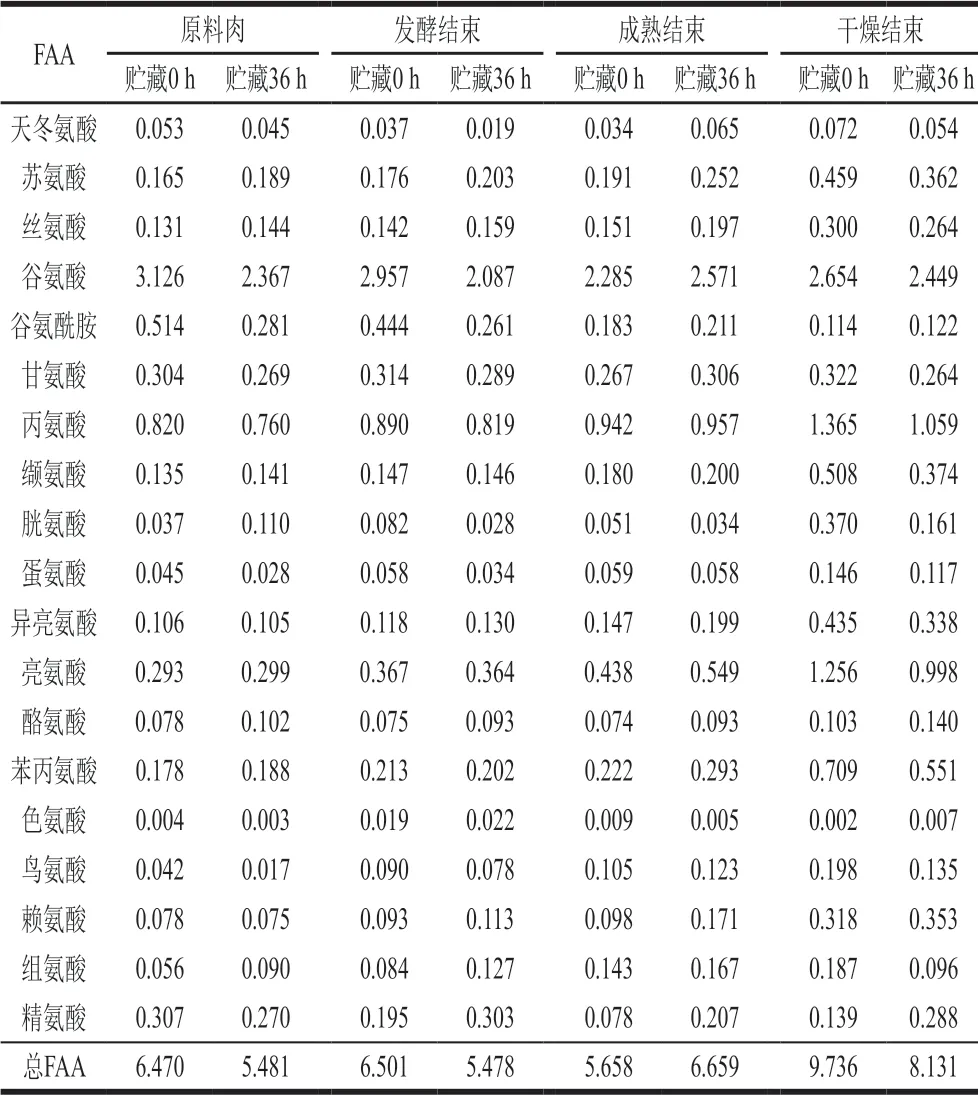
表 2 牛肉发酵香肠加工过程中FAA含量的变化Table 2 Changes in free amino acid contents of fermented beef sausages during processing mg/g
香肠中的蛋白质在微生物作用下能分解产生较多FAA,其能够在具有氨基酸脱羧酶活性的微生物作用下脱羧形成生物胺,FAA含量既能反映蛋白质降解程度,又可反映生物胺的生成与积累情况[32]。其中酪氨酸、组氨酸、赖氨酸分别为酪胺、组胺、尸胺的前体物质, 鸟氨酸、精氨酸为腐胺的前体物质。由表2可知,在香肠加工过程中,4 组香肠中组氨酸、赖氨酸、鸟氨酸和总FAA含量均呈上升趋势。在原料肉阶段,贮藏0 h组中鸟氨酸、赖氨酸、精氨酸、总FAA含量均高于贮藏36 h组;在发酵结束阶段,贮藏0 h组中鸟氨酸、总FAA含量均高于贮藏36 h组;在干燥结束阶段,贮藏0 h组中鸟氨酸、组氨酸、总FAA含量均高于贮藏36 h组。对比不同处理组可知,贮藏时间越长,FAA含量越低,这可能是因为贮藏36 h组的香肠在发酵阶段中优势菌群为魏斯氏菌,在其产生的氨基酸脱羧酶作用下,可以将某些FAA如鸟氨酸、精氨酸、组胺酸等作为生物胺的前体物质转化成生物胺[28], 从而导致贮藏36 h组中FAA含量低于0 h组。其中,贮藏36 h牛肉加工的香肠与未经贮藏牛肉加工的香肠对比,总FAA含量平均值由7.09 mg/g减少至6.44 mg/g。
2.3 原料肉贮藏时间对牛肉发酵香肠中生物胺含量变化的影响
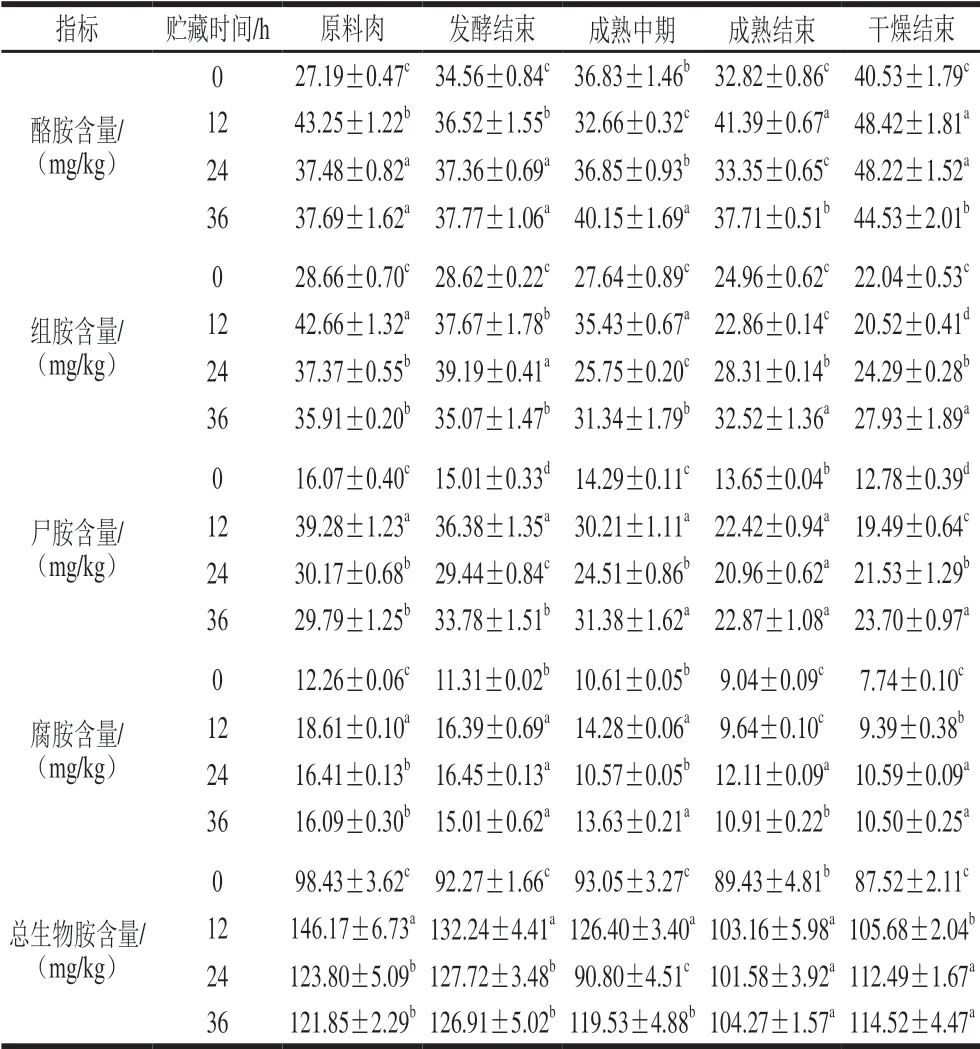
表 3 牛肉发酵香肠加工过程中生物胺含量的变化Table 3 Changes in biogenic amine contents of fermented beef sausages during processing
由表3可知,香肠中的生物胺主要有酪胺、组胺、尸胺、腐胺,其中酪胺含量最高,腐胺含量最低,而色胺、苯乙胺、亚精胺的含量较低。香肠的加工过程中酪胺含量呈上升趋势,组胺、腐胺和尸胺含量呈下降趋势。对比不同处理组可知,贮藏36 h组中酪胺、组胺、尸胺、腐胺以及总生物胺含量显著高于贮藏0 h组 (P<0.05)。其中,贮藏0 h牛肉制作的发酵香肠中总生物胺含量平均值为92.14 mg/kg;贮藏36 h牛肉制作的香肠中总生物胺含量平均值为117.42 mg/kg。贮藏0 h组中
优势菌群为具有生物胺降解能力的葡萄球菌属,能够降解已生成的生物胺,这可能是贮藏0 h组中总生物胺含量显著低于36 h组的原因之一。贮藏36 h组中酪胺、尸胺、总生物胺含量在发酵阶段增多,在成熟阶段减少,这可能是在贮藏36 h组中原料肉和香肠发酵阶段的优势菌为能够产生物胺的魏斯氏菌,成熟阶段生物胺含量升高为葡萄球菌造成的。在干燥结束后酪胺的含量最高,为主要的生物胺,这可能是因为香肠在55 ℃环境下干燥,使得酪氨酸残基暴露,酪胺前体物质增多[33]。综上所述,控制原料肉的贮藏时间可以有效抑制发酵香肠中生物胺的积累,从而有效控制其中生物胺含量,保障产品的安全性。
2.4 原料肉贮藏时间对香肠成熟阶段中微生物数量、含氮化合物含量与生物胺含量相关性的影响
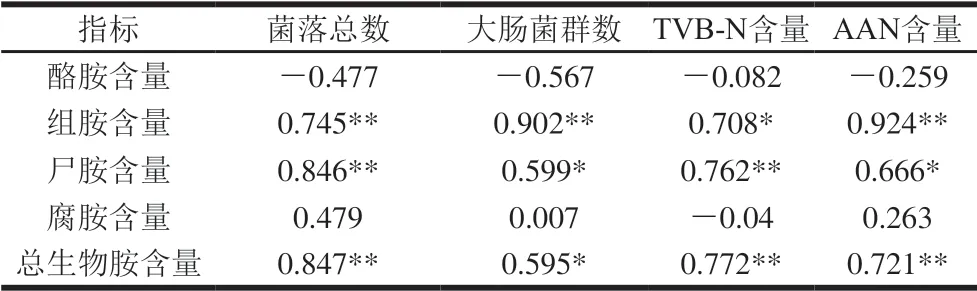
表 4 成熟阶段牛肉发酵香肠中生物胺与微生物、含氮化合物 指标之间的皮尔逊相关系数Table 4 Pearson’s correlation coefficients of biogenic amines with microbial load and nitrogen-containing compound contents during the ripening of fermented beef sausages
由表4可知,香肠成熟阶段中菌落总数与组胺、尸胺、总生物胺含量之间呈极显著正相关(P<0.01),相关系数分别为0.745、0.846、0.847;大肠菌群数与组胺含量之间呈极显著正相关(P<0.01),相关系数为0.902;TVB-N含量与尸胺、总生物胺含量之间呈极显著正相关(P<0.01),相关系数分别为0.762、0.772;AAN含量与组胺、总生物胺含量之间呈极显著正相关 (P<0.01),相关系数分别为0.924、0.721。综上所述,香肠成熟阶段中微生物数量与生物胺含量多呈正相关,这可能是因为贮藏过程中仍有一些具有适应低温的耐冷细菌的积累,如假单胞菌属、微球菌属、嗜冷杆菌属,其中假单胞菌为产胺菌,所以贮藏后的原料肉中已经存在与生物胺产生密切相关的微生物,其在香肠成熟阶段大量生长,对生物胺的产生起到较大作用;原料肉贮藏时间对香肠成熟阶段中TVB-N含量与生物胺含量相关性的影响较强,这可能是因为牛肉中的蛋白质在耐冷微生物作用下降解为TVB-N。
3 讨 论
原料肉贮藏时间对牛肉发酵香肠中菌群结构变化的影响较为显著(P<0.05)。未经贮藏牛肉制作的 香肠中菌落总数、大肠菌群数显著低于贮藏36 h牛肉制作的香肠(P<0.05),这与Çoban等[34]对鲤鱼香肠中微生物数量变化的研究结果一致,这是因为0~4 ℃环境中微生物生长繁殖虽然受到抑制,但其细胞结构并未破坏,不会很快造成死亡并能在较长时间内保持活力,当温度升高时,微生物又可以恢复正常生命活动。还有一些耐冷细菌,如假单胞菌属、微球菌属、嗜冷杆菌属具有适应低温环境的生长能力[35];贮藏36 h牛肉制作的香肠中微生物群落丰富度和多样性均高于未经贮藏牛肉制作的香肠,这与滕安国等[13]关于腐败香肠中微生物丰富度和多样性高于新鲜香肠的研究结果一致;未经贮藏牛肉制作的香肠中优势菌群一直为葡萄球菌(Staphylococcus),贮藏36 h牛肉及制作的香肠在发酵阶段优势菌群为魏斯氏菌(Weissella),成熟阶段优势菌群为葡萄球菌(Staphylococcus),这与Wang Xinhui等[36]研究的自然发酵四川腊肠成熟过程中优势菌群为魏斯氏菌的结果不一致,这可能是因为魏斯氏菌在15 ℃环境下生长便会受到抑制[37],而本研究中成熟温度为13 ℃;这与张巍[38]研究的接种发酵香肠成熟过程中优势菌群为葡萄球菌这一结果一致,说明接种发酵剂且控温控湿的加工工艺可以有效抑制魏斯氏菌的生长繁殖,使得优势菌群变为葡萄球菌。
原料肉贮藏时间对牛肉发酵香肠中含氮化合物含量变化的影响较为显著(P<0.05),随着牛肉贮藏时间的延长,制作的发酵香肠中TVB-N、AAN含量增多,总FAA含量减少。这与Zhang Xin等[39]对意大利香肠中TVB-N含量变化规律的研究结果一致,与张楠[40]对川味香肠中AAN含量的变化研究结果一致,这可能是因为牛肉贮藏时间较长,细胞中水分渗出,水分含量降低,制作的香肠中盐含量相对增大,脱羧酶活性受到抑制,同时微生物大量生长繁殖,降解蛋白质产生氨基酸等小分子化合物,使得氨基酸大量积累,TVB-N和AAN含量增多,同时微生物的大量繁殖使得FAA转化为生物胺,FAA含量相应减少。与韦友兵等[41]研究的萨拉米香肠中FAA含量在加工过程中先增加后降低的结果不一致,可能是因为该研究中香肠的原材料没有进行4 ℃贮藏处理,而且香肠的加工工艺条件也不一样。
香肠的加工过程中,组胺、腐胺和尸胺含量呈下降趋势,该结果与孙霞等[42]对传统自然发酵四川香肠加工贮藏过程中这3 种生物胺含量显著增加的研究结果不一致。这可能与香肠中微生物群落丰富度和多样性随着加工的进行而降低有关(贮藏0 h组:Chao1和ACE指数分别由234.63、251.83降低到226.94、239.35,Shannon和Simpson指数分别由1.66、0.384433降低到1.48、0.309312;贮藏36 h组:Chao1和ACE指数分别由365.03、355降低到237、237,Shannon和Simpson指数分别由3.07、0.655673降低到2.17、0.440064);也可能 与所采用的香肠加工工艺有关,孙霞等[42]采用的自然发酵工艺成熟时间较长,而本研究为人工控温控湿条件,且发酵成熟时间较短;原料肉贮藏时间对牛肉发酵香肠中生物胺含量变化的影响较为显著(P<0.05),未经贮藏牛肉制作的香肠中酪胺、组胺、尸胺、腐胺含量均低于贮藏36 h牛肉制作的香肠,这与Tosukhowong等[9]研究发现泰国发酵香肠中生物胺含量的变化结果一致,也与本研究中贮藏36 h牛肉及制作的香肠在发酵阶段的优势菌群是多具有产生物胺能力的魏斯氏菌结果一致。说明贮藏后的牛肉中具有氨基酸脱羧酶活性的微生物大量繁殖,经脱羧作用将FAA转化为生物胺。
4 结 论
随着原料肉在0~4 ℃条件下贮藏时间的延长,发酵香肠加工过程中菌落总数、大肠菌群数、菌群多样性以及TVB-N、AAN含量均呈上升趋势。贮藏0 h牛肉制作的发酵香肠在加工过程中的优势菌群为葡萄球菌,总生物胺含量平均值为92.14 mg/kg;贮藏36 h牛肉制作的香肠在发酵阶段优势菌群为魏斯氏菌,成熟阶段优势菌群为葡萄球菌,加工过程中总生物胺含量平均值为 117.42 mg/kg。因此,通过缩短原料肉贮藏时间可以有效减少发酵香肠中微生物数量,降低菌群多样性和丰富度,抑制蛋白质的降解,减少生物胺的产生,从而提高发酵香肠的食用安全性。

