朝鲜蓟茎叶中脂溶性提取物对神经细胞的保护作用
班龄尹,王笑园,庞思成,代毓敏,李景明,侯彩云
(中国农业大学食品科学与营养工程学院 北京100083)
朝鲜蓟【Cynara cardunculus L.var.scolymus(L.)Fiori】为菊科菜蓟属多年生草本植物,主要种植于地中海地区,起源于野生多年生的野生型刺菜蓟【Cynara cardunculus L.var.sylvestris(Lamk)Fiori】[1],是一种富含营养物质的保健蔬菜,被认为是一种功能性食品[2],具有缓解肝胆疾病及消化不良、抗氧化、抗菌、抗癌等多种生理功能活性。朝鲜蓟的可食部分为内部苞片及花托,不可食用的工业副产物部分包括其外部苞片及茎叶,占整个植株鲜重的80%左右[2-3],造成大量的土地占用、资源浪费及环境污染,因此对朝鲜蓟茎叶副产物的开发利用尤为重要。
萜类化合物是异戊二烯聚合物及其衍生物的总称,而倍半萜化合物及三萜化合物是朝鲜蓟中主要的亲脂类化合物。Ramos 等[4]从刺菜蓟【Cynara cardunculus L.var.Altilis(DC)】中提取了脂溶性成分并对其组分进行系统分析,其中去酰基菜蓟苦素、羽扇豆醇醋酸酯、Ψ-蒲公英甾醇醋酸酯在栽培型刺菜蓟中均为第1 次报道。有文献表明,萜类化合物具有抗高血脂[5]、抗炎[6]、抗癌[7]等生理活性,然而截至目前,对朝鲜蓟副产物中萜类化合物的开发利用及相关活性的研究较少,对于其神经保护作用的报道更是不足。
大量研究表明,氧化应激诱导的神经细胞损伤与多种神经退行性疾病有关,如阿尔兹海默症和帕金森病等[8-11]。在神经退行性疾病中,活性氧引起的氧化应激被广泛认为是神经细胞损伤的主要原因之一[12-13]。现普遍认为,对中枢神经系统退化的有效治疗方法是保护神经细胞免受氧化损伤[14-15]。有大量研究证明,许多天然抗氧化物都具有神经保护作用[16-20]。
本研究采用GC-MS 分析朝鲜蓟副产物脂溶性提取物中萜类及甾醇类化合物的组成与含量,通过测定不同指标研究脂溶性提取物对神经细胞的保护作用,为朝鲜蓟副产物的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
朝鲜蓟(Cynara scolymus L.)的茎叶等副产物于2018年4月份采自于中国云南省曲靖市陆良县中枢镇华侨农场,采收后当天立即空运送往实验室,液氮冷冻干燥、粉碎,过50 目筛,装于自封袋中,于-20℃冰箱中保存。
正构烷烃(C7~C40),上海安普实验科技股份有限公司;正十六烷(纯度>99.5%)、吡啶(纯度>99.9%),上海阿拉丁生化科技股份有限公司;菜蓟苦素(纯度96.4%)、豆甾醇(纯度98%)、β-谷甾醇(纯度95%)、羽扇豆醇(纯度98%),天津阿尔塔科技有限公司;α-香树脂醇(纯度≥98%)、β-香树脂醇(纯度≥98%)、Annexin V-FITC 凋亡检测试剂盒,美国Sigma-Aldrich 公司;三甲基氯硅烷(纯度>99%)、N,O-双(三甲基硅烷基)三氟乙酰胺(纯度96%)、二氯甲烷(分析纯级),上海麦克林生化科技有限公司;30% H2O2溶液,国药集团化学有限公司;RPMI1640 培养基、青霉素-链霉素、0.25%胰蛋白酶,美国GIBCO 公司;胎牛血清,美国HYCLONE 公司;二甲基亚砜(DMSO)、PBS 缓冲液、DPBS 缓冲液、CCK8 试剂盒、DCFH-DA 试剂盒、吖啶橙-溴化乙锭(AO-EB)试剂盒,索莱宝生物科技有限公司;脂质氧化(MDA)试剂盒、乳酸脱氢酶细胞毒性检测试剂盒,碧云天生物技术有限公司。
1.2 主要仪器与设备
6890N/5973 气相色谱-质谱联用仪,美国安捷伦科技公司;BD FACSEALIBUR 型流式细胞仪,美国BD 公司;YG-XD 30 型荧光显微镜,中国PVD 公司;Tis 型倒置相差显微镜,日本Nikon公司;Infinite F50 型酶标仪,澳大利亚TECAN 公司。
1.3 脂溶性物质的提取
参考Romas 等[4]的方法并稍作修改。准确称取朝鲜蓟副产物冻干粉5 g,加入125 mL 二氯甲烷,索氏提取7 h,利用旋转蒸发仪在50℃下对提取液进行低压干燥,旋蒸后加入二氯甲烷对干燥后的提取物进行复溶,定容至25 mL,取1 mL 氮吹至彻底干燥,于-20℃冰箱中保存。
1.4 GC-MS 分析
参考Romas 等[4]的方法并稍作修改。在进行GC-MS 检测之前,先进行三甲基硅烷化(TMS)衍生,向氮吹干燥后的脂溶性提取物中加入250 μL含1 mg 正十六烷(内标)的吡啶,待提取物完全溶解后,加入250 μL 的N,O-双(三甲基硅烷基)-三氟乙酰胺和50 μL 的三甲基氯硅烷,混合物于70℃反应30 min。
气相色谱-质谱联用仪配以DB-5 J&W 毛细管柱(30 m×0.25 mm×0.25 μm,美国安捷伦科技公司),载气为高纯氦气(41 cm/s)。色谱的操作条件为:自动进样,进样量1 μL,进样口温度270℃,分流比30∶1。柱温箱的升温程序为:初始温度120℃,保持2 min,以4℃/min 的速度升至250℃,而后以2℃/min 的速度升至285℃,并保持15 min。质谱的操作条件为:离子碰撞模式,离子能量70 eV,以全扫描模式进行信息采集,扫描范围为m/z 30~600,离子源温度230℃。
GC-MS 色谱图的处理软件采用MSD Chem-Station 工作站(Agilent,Version E02)。定性时,通过将色谱峰的质谱信息与相关文献及工作站所匹配的NIST 质谱库进行比较,必要时通过标样定性。定量时,主要的萜类及甾醇类化合物通过标曲定量,其余化合物通过内标(正十六烷)定量,结果均折算为样品中物质的含量,用mg/kg DM 表示。
1.5 细胞培养
参考Tang 等[21]的方法并稍作修改。将PC12细胞用完全培养基(RPMI 1640 培养基,10%胎牛血清,1%青霉素-链霉素)接种于6 孔板中,接种密度3×105 个/mL,接种量2 mL/孔,置于37℃,5%CO2的水套式CO2 孵育箱中培养24 h。
1.6 细胞活力的测定
将PC12 细胞用完全培养基接种于96 孔板中,接种密度3×105个/mL,接种量100 μL/孔,于37℃,5% CO2的孵育箱中培养24 h。用不完全培养基(RPMI 1640 培养基,2%胎牛血清,1%青霉素-链霉素)将脂溶性提取物稀释至高、中、低3 个不同的质量浓度,分别处理PC12 细胞8 h 后,加入含90 μmol/L H2O2的不完全培养基培养4 h。与预保护后伤害组相对应,以未经脂溶性提取物保护、经H2O2伤害的PC12 细胞作为模型组,以未经H2O2伤害、经高浓度脂溶性提取物处理的PC12 细胞作为脂溶性提取物保护组,以未经任何处理的PC12 细胞作为空白对照组,利用CCK8 法检测每孔中细胞的存活率,参考Ding 等[22]的方法,将处理后的细胞移除培养基,加入100 μL/孔配好的CCK8 工作液,置于5% CO2 的孵育箱中,37℃孵育2 h,酶标仪检测橘黄色甲臜的生产量,检测波长450 nm 处的吸光度值,每组做6 个平行。
1.7 乳酸脱氢酶(LDH)漏出率检测
细胞培养基中的LDH 含量是衡量细胞损伤程度的重要指标,对按照1.5 节方法培养好的细胞进行4 组不同处理后,收集每孔中的培养基,按照试剂盒说明书检测培养基中LDH 活性。
1.8 抗氧化活性的测定
氧化应激会直接或间接导致ROS 介导的核酸、蛋白质和脂质损伤,并且涉及癌变[23]、神经退行性病变[24]、动脉粥样硬化、糖尿病[25]和衰老[26]等。在神经退行性疾病中,活性氧(ROS)引起的氧化应激被广泛认为是神经细胞损伤的主要原因之一,本研究利用2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)探针检测细胞内ROS 水平。对按照1.5 节方法培养好的细胞进行脂溶性提取物处理组、模型组、空白对照组3 组处理后,用不含乙二胺四乙酸(EDTA)的胰蛋白酶消化细胞,于4℃,1 500 r/min 离心3 min 后使用完全培养基洗涤细胞,按照1∶1 000 比例用无血清培养基(RPMI1640培养基,1%青霉素-链霉素)稀释DCFH-DA,取0.5 mL 稀释液加入细胞,于CO2 孵育箱中避光孵育20 min,使用无血清培养基洗涤细胞3 次,用荧光显微镜观察细胞荧光情况,并用流式细胞仪量化检测,检测条件为激发波长488 nm,发射波长605 nm。对按照1.5 节方法培养好的细胞进行4组处理后,按照试剂盒说明书对细胞内丙二醛(MDA)水平进行检测,来确定脂质氧化的水平。
1.9 细胞凋亡的测定
对按照1.5 节方法培养好的细胞进行预保护后伤害组、模型组、空白对照组3 组处理后,用不含EDTA 的胰蛋白酶消化收集细胞,杜氏磷酸缓冲液(DPBS)洗涤细胞2 次,加入500 μL 去离子水稀释好的结合缓冲液(1×)重悬细胞,上机前加入5 μL 膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和10 μL 碘化丙啶(PI),室温避光反应10 min,细胞流式仪量化检测,检测条件为激发波长488 nm,发射波长530 nm。对按照1.5 节方法培养好的细胞进行预保护后伤害组、模型组、空白对照组3 组处理后,向每个细胞处理组的培养基中加入40 μL AO-EB 染液,室温放置5 min,荧光显微镜拍照观察。
2 结果和讨论
2.1 朝鲜蓟副产物的中萜类及甾醇类化合物
倍半萜烯类化合物及三萜是朝鲜蓟中主要的亲脂类化合物。倍半萜烯类化合物主要集中分布在叶片中,在茎干以及花蕾中含量较少,相反,三萜类化合物在叶片中含量较低[4,27]。本试验共鉴定出13 种萜类及甾醇类化合物,其中包括3 种倍半萜内脂、2 种甾醇及8 种五环三萜(表1)。
由表1可知,朝鲜蓟副产物中愈创木烷型倍半萜内脂主要包括菜蓟苦素、去酰基菜蓟苦素和大海米菊素。菜蓟苦素是朝鲜蓟副产物中主要的倍半萜内脂,也是朝鲜蓟中一种主要的苦味成分,被视为朝鲜蓟类植物的化学分类标志[28],在朝鲜蓟中含量高达13 309.10 mg/kg DM,占总萜类及甾醇类化合物的64.90%,占总倍半萜内脂的82.18%。研究表明菜蓟苦素具有抗光老化[29-30]、抗痉挛[31]、抗高血脂[32]等药理作用。
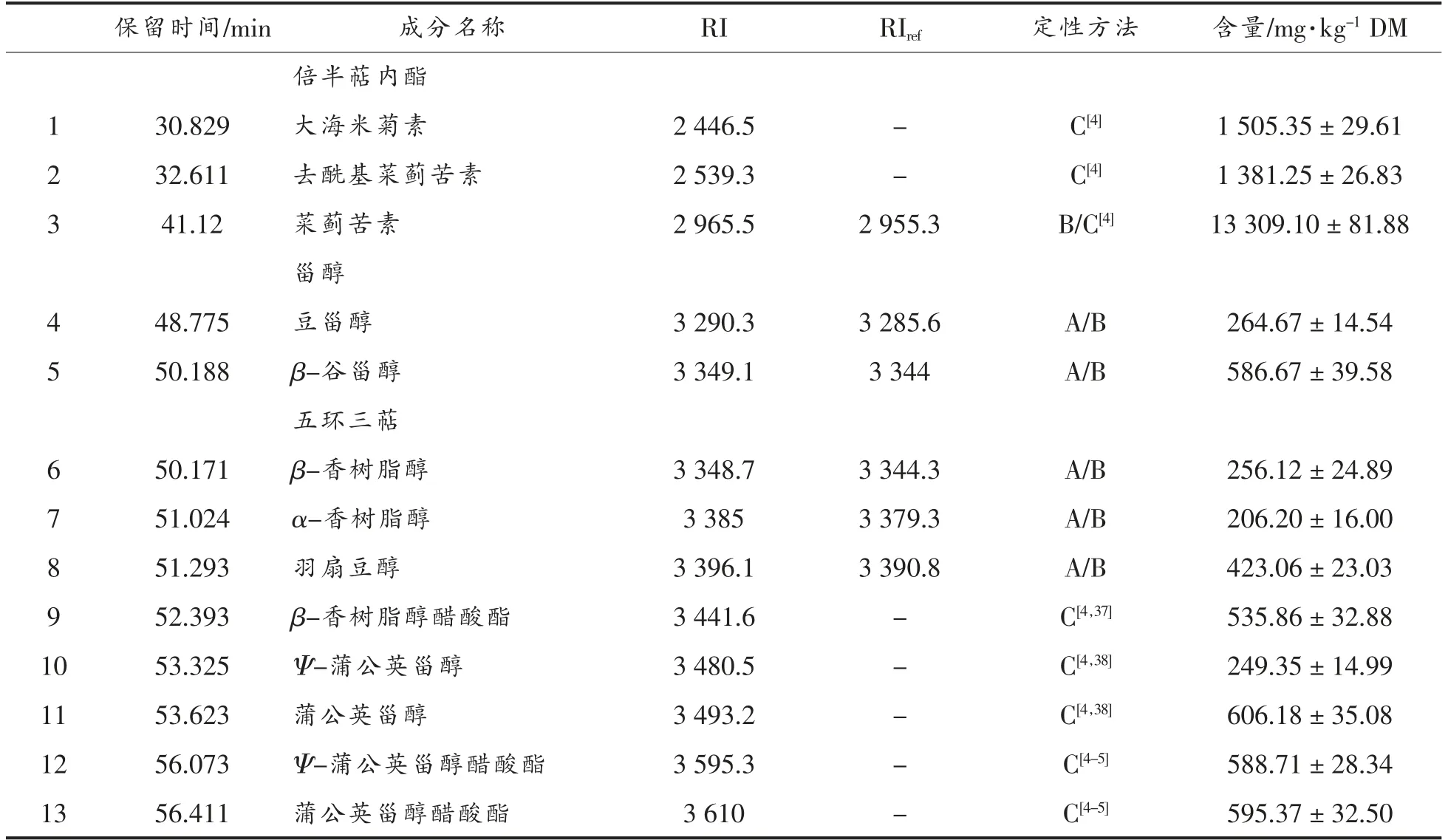
表1 朝鲜蓟副产物脂溶性提取物中萜类及甾醇类化合物定性及定量Table 1 Qualitative and quantitative analysis of terpenoids and sterols in lipophilic extract from by-product of artichoke
朝鲜蓟茎叶副产物中豆甾醇含量为264.67 mg/kg DM,β-谷甾醇含量为586.67 mg/kg DM,均属于甾醇类化合物。植物甾醇是一种天然的植物活性物质,是植物细胞膜的组成部分,具有较强的抗炎、降低胆固醇及预防动脉粥样硬化等功效,而β-谷甾醇在减少血清胆固醇吸收方面作用显著,在减少冠心病及控制肿瘤生长方面起着重要作用。
五环三萜类物质是朝鲜蓟副产物脂溶性提取物中含量较高的一类,占总萜类及甾醇类化合物的16.88%,其结构主要分为羽扇豆烷型、蒲公英甾烷型和齐墩果烷型。其中,蒲公英甾烷型含量最高,占五环三萜总含量的58.93%,并且其两种醋酸酯衍生物的总量为1 184.08 mg/kg DM,高于蒲公英甾醇和Ψ-蒲公英甾醇的总量(855.53 mg/kg DM),蒲公英甾醇和Ψ-蒲公英甾醇及其醋酸酯衍生物曾在朝鲜蓟的花蕾中检测出,具有显著的抗炎活性[33];羽扇豆醇含量为423.06 mg/kg DM,Noldin 等[34]也曾在朝鲜蓟中发现羽扇豆醇,该化合物已被证实具有抗炎、抗氧化、抗肿瘤、抗关节炎及免疫调节功能[35]。齐墩果烷型五环三萜主要为α-香树脂醇、β-香树脂醇及β-香树脂醇醋酸酯,其中醋酸酯衍生物的含量为535.86 mg/kg DM,高于两种醇的含量,这与Romas 等[4]在刺菜蓟(栽培型)的不同形态部位中得到的结果一致。Piccolella 等[36]在乳香黄连木(Pistacia lentiscus L.)叶片的提取物中发现了羽扇烷醇、羽扇豆醇、β-香树脂醇、羽扇豆烯酮等萜类化合物,并且其粗提物具有预防或治疗神经母细胞瘤的潜在功能。
2.2 PC12 细胞的细胞活力
利用CCK8 法对细胞活力进行检测。细胞存活率受脂溶性提取物质量浓度和处理时间的影响(图1),低质量浓度(0.25 mg/L)下处理PC12 细胞,细胞存活率不受影响;随着脂溶性提取物质量浓度的增加(0.5~2 mg/L),PC12 细胞存活率显著提高,并呈现质量浓度依赖性,其中2 mg/L 的脂溶性提取物对细胞的保护作用最强,处理24 h后,存活率达到138.26%;然而,当利用高质量浓度的脂溶性提取物(8 mg/mL)处理细胞时,呈现出明显的质量浓度时间依赖性伤害作用。因此,选择0.5,1,2 mg/L 3 个质量浓度进行后续试验。
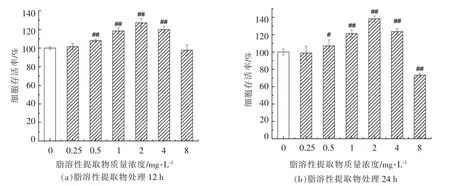
图1 朝鲜蓟副产物脂溶性提取物对PC12 细胞存活率的影响Fig.1 Effects of lipophilic extract of artichoke by-product on the cell viability of PC12 cells
与空白对照组相比,90 μmol/L H2O2处理PC12 细胞4 h 后,细胞存活率为48.05%(图2)。经脂溶性提取物预处理后,H2O2对PC12 细胞的损伤作用受到显著抑制(P<0.01),其中2 mg/L 的脂溶性提取物预处理细胞8 h 后,细胞存活率达到66.90%,因此在一定质量浓度范围内,脂溶性提取物都可以显著保护PC12 细胞免受H2O2 的损害作用。
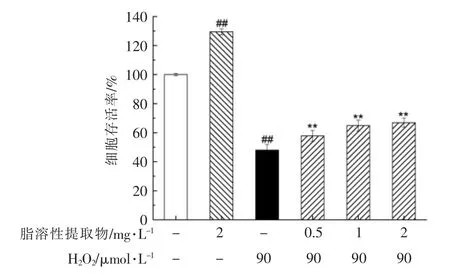
图2 朝鲜蓟副产物脂溶性提取物预处理对H2O2诱导损伤的PC12 细胞存活率的影响Fig.2 Effects of pretreatment with lipophilic extract of artichoke by-product on the cell viability of H2O2-induced PC12 cells
2.3 PC12 细胞的LDH 漏出率
为了对脂溶性提取物的保护作用做进一步研究,检测了PC12 细胞的LDH 漏出率,即溶解细胞中释放出的乳酸脱氢酶的含量,用该指标评价细胞膜的受损程度。与空白对照组相比,90 μmol/L H2O2处理PC12 细胞4 h 后,其LDH 漏出率显著增大(P<0.01),达到194.69%(图3);经脂溶性提取物预处理后,PC12 细胞的LDH 漏出率与模型组相比有显著降低(P<0.01),其中,2 mg/L 脂溶性提取物预处理细胞8 h 后,LDH 漏出率为110.28%,因此脂溶性提取物可以显著地缓解H2O2对神经细胞的损害作用。
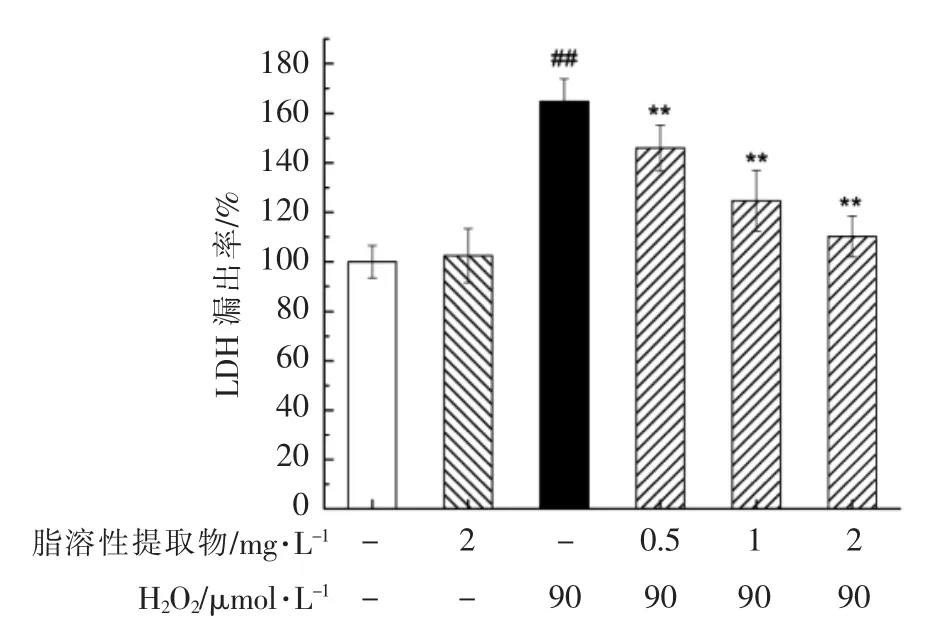
图3 朝鲜蓟脂溶性提取物预处理对H2O2 诱导的PC12 细胞LDH 漏出率的影响Fig.3 Effects of pretreatment with lipophilic extract of artichoke by-product on the cell LDH release of H2O2-induced PC12 cells
2.4 PC12 细胞中的ROS 水平及MDA 含量
ROS 主要来源于损伤的线粒体[39],当细胞内产生过量的ROS 或体内氧化剂含量超过细胞的抗氧化应答能力时,细胞就会产生氧化应激[40]。本试验以DCFH-DA 作为荧光探针,检测2′,7′-二氯荧光素(DCF)的荧光强度即可获知细胞内ROS的水平。与空白对照组相比,90 μmol/L H2O2处理PC12 细胞4 h 后,细胞内ROS 水平显著增加(P<0.01),达到460.43%(图4a),使细胞产生严重的氧化损伤;经脂溶性提取物预处理后,能够显著地抑制PC12 细胞内ROS 的产生(P<0.01),其中2 mg/L 脂溶性提取物预处理细胞8 h 后,ROS 含量为208.37%。荧光显微镜观察染色后的PC12 细胞发现,细胞呈现的荧光强度变化与细胞内ROS 水平变化趋势一致(图4b)。因此,脂溶性提取物可以有效地清除ROS,缓解H2O2引发的线粒体功能障碍。
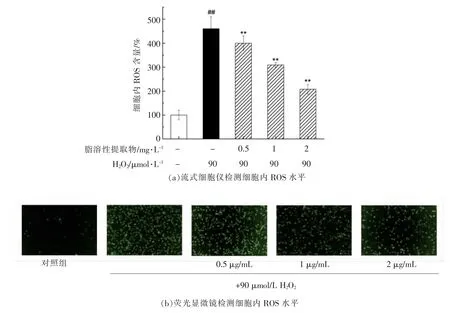
图4 朝鲜蓟脂溶性提取物预处理对H2O2 诱导的PC12 细胞内ROS 水平的影响Fig.4 Effects of pretreatment with lipophilic extract of artichoke by-product on the intracellular ROS level of H2O2-induced PC12 cells.
当动物或植物体产生氧化应激时,会发生脂质氧化,而MDA 是一种生物体脂质氧化的天然产物,可以用来确定脂质氧化水平。与空白对照组相比,90 μmol/L H2O2处理PC12 细胞4 h 后,MDA含量显著增多(P<0.01),达到192.98%(图5);经脂溶性提取物预处理8 h 后,能够显著地阻止MDA 的产生(P<0.01);而正常细胞经脂溶性提取物处理后,在无H2O2伤害的情况下,其MDA 含量可降低至25.71%。
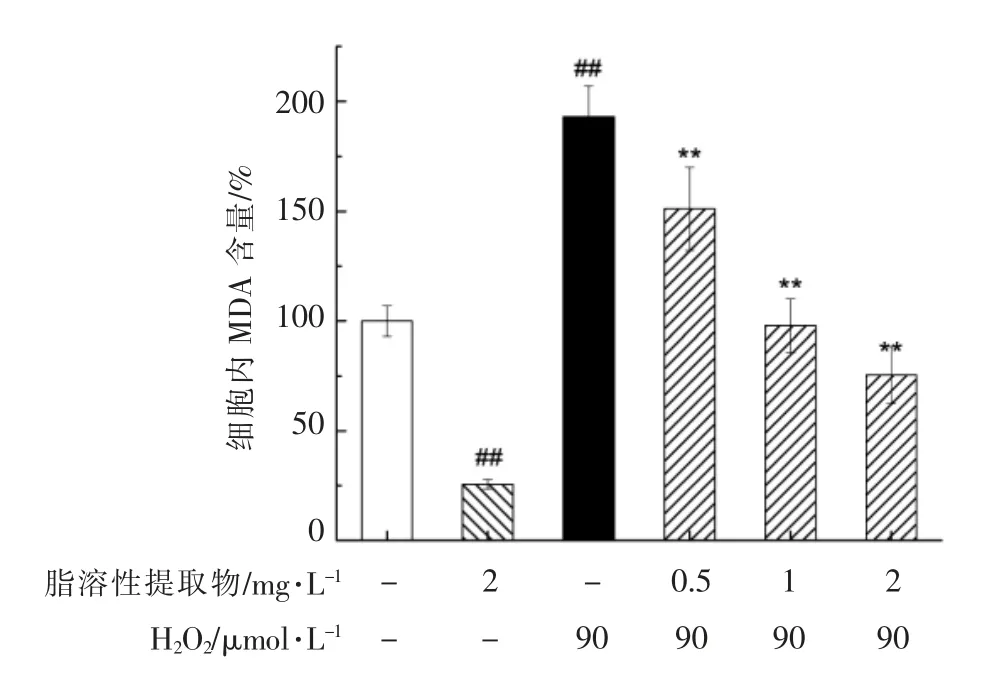
图5 朝鲜蓟脂溶性提取物预处理对H2O2诱导的PC12 细胞内MDA 含量的影响Fig.5 Effects of pretreatment with lipophilic extract of artichoke by-product on the intracellular MDA production of H2O2-induced PC12 cells
2.5 脂溶性提取物对PC12 细胞凋亡的影响
为了进一步探究脂溶性提取物能否有效地抑制细胞凋亡,利用Annexin V-FITC/PI 进行染色,经流式细胞术检测细胞凋亡率(图6a)。如图6b所示,与空白对照组(8.14%)相比,H2O2处理显著增加了细胞凋亡率(23.66%),经朝鲜蓟脂溶性提取物预处理后,PC12 细胞的凋亡得到显著抑制。其中,经过2 mg/L 脂溶性提取物预保护后,细胞凋亡率降低至8.75%。
为了更加直观地比较不同处理组的细胞凋亡情况,利用AO-EB 对细胞进行染色,通过荧光显微镜观察细胞形态。如图6c所示,空白对照组的细胞因为吖啶橙(AO)透过其完整的细胞膜嵌入DNA,几乎全部呈现绿色荧光,细胞形态正常,没有明显的凋亡相关形态学改变;经H2O2处理的模型组的细胞发生了边缘化、核凝集等发绿色荧光的早期凋亡现象,并且因为溴化乙锭(EB)透过其破损的细胞膜嵌入DNA,呈现出橘黄色荧光的晚期凋亡现象;而经过朝鲜蓟脂溶性提取物预处理的PC12 细胞呈现出早期凋亡和晚期凋亡细胞皆有减少的现象,并呈现质量浓度依赖性。
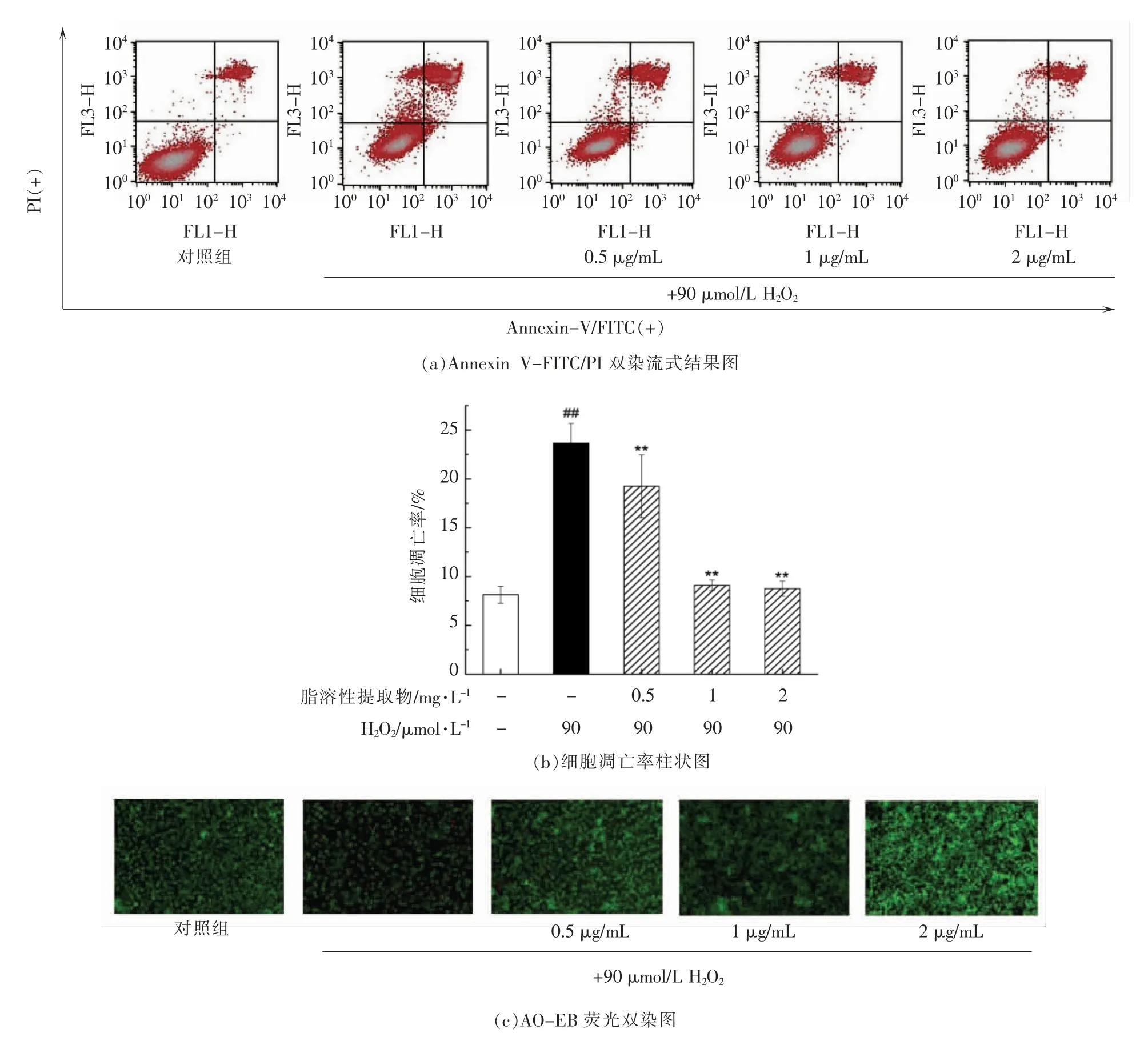
图6 朝鲜蓟脂溶性提取物预处理对H2O2 诱导的PC12 细胞凋亡的影响Fig.6 Effects of pretreatment with lipophilic extract of artichoke by-product on cell apoptosis of H2O2-induced PC12 cells
3 结论
本试验探究了朝鲜蓟副产物中脂溶性提取物对PC12 神经细胞的保护作用。利用GC-MS 对朝鲜蓟副产物中萜类及甾醇类化合物进行定性与定量分析,结果表明,主要含有3 种倍半萜内脂,2种甾醇及8 种五环三萜。试验以H2O2 作为氧化损伤诱导剂,探究朝鲜蓟副产物脂溶性提取物的生理活性,发现该提取物可降低PC12 神经细胞的氧化损伤,并且伴随细胞内LDH 漏出率、MDA 含量及ROS 水平的降低。经过Annexin V-FITC/PI 双染及AO-EB 双染后发现,经脂溶性提取物处理的PC12 细胞凋亡率显著降低,与荧光显微镜的观察结果一致。综上,朝鲜蓟副产物脂溶性提取物对PC12 神经细胞具有抗凋亡及保护作用,值得进一步的开发利用与研究。

