新型壳聚糖-岩藻聚糖硫酸酯纳米粒子研究
刘 雪,姜竹茂,毕浩然,,贾爱荣,刘 新,张绵松,史亚萍,刘昌衡*
(1 齐鲁工业大学(山东省科学院)山东省科学院生物研究所 济南250103 2 烟台大学生命科学学院 山东烟台264005)
口服药物给药方式简单,不损伤皮肤和黏膜,无交叉感染,是目前药物疗法最常用的给药途径[1-2]。然而,药物在胃、肠道环境中的稳定性极大地限制了药物的利用率[1]。许多药物仍需以注射的方式给药[3]。如何提高药物的口服利用率,构建口服药物载体,仍是现阶段亟待解决的问题[4]。近年来提出的纳米载药体系主要是利用具有一定特性的纳米载体,将药物包裹入内,提高其稳定性和利用率,现已成为国内外药剂学研究的热点[5]。为了防止药物进入肠道之前在胃中分解,纳米口服药物载体的构建需要考虑胃、肠道pH 值的变化,使用对pH 值敏感的载体系统[1]。壳聚糖-岩藻聚糖硫酸酯纳米载体系统是常用的活性物质运载体系。壳聚糖是一种天然阳离子多糖,具有良好的安全性、生物相容性、pH 值敏感性,可以通过增强细胞旁路的药物转运,促进药物的吸收利用,这使其在口服药物领域具有一定优势[6-8]。岩藻聚糖硫酸酯是褐藻和海洋无脊椎动物中常见的硫酸化多糖,含有大量的硫酸基团,可与带正电的壳聚糖通过聚电解质自组装的方式形成纳米粒子[4]。岩藻聚糖硫酸酯自身具有抗氧化、抗炎、抗肿瘤等多种活性,进入体内后不仅很少引起副反应,而且还可以辅助所运载的活性物质发挥作用,是一种良好的载药纳米粒子构建材料[9]。据报道,壳聚糖-岩藻聚糖硫酸酯纳米粒子已作为多种生物活性物质的运载体,如生长因子、抗肿瘤药物等[10]。Pinheiro 等[11]采用自组装法制备壳聚糖-岩藻聚糖硫酸酯纳米粒子,用其运载生物活性物质;Huang 等[12]将封装有碱性成纤维细胞生长因子的壳聚糖-岩藻聚糖硫酸酯纳米粒子应用于神经组织工程;Huang 等[13]将制备的壳聚糖-岩藻聚糖硫酸酯纳米粒子用于抗肿瘤药物姜黄素的运载,增加了姜黄素的生物利用度。目前,纳米粒子的制备多采用商品化的海带、墨角藻等来源的岩藻聚糖硫酸酯,对于其它褐藻来源的岩藻聚糖硫酸酯的研究较少[9,14]。本文从常见、易得的大型海藻羊栖菜中提取得到岩藻聚糖硫酸酯,制备新型壳聚糖-岩藻聚糖硫酸酯纳米粒子,测定不同岩藻聚糖硫酸酯/壳聚糖比例的纳米粒子在人工胃、肠液中的稳定性,寻找适用于运载口服药物的新型壳聚糖-岩藻聚糖硫酸酯纳米粒子。
1 材料与方法
1.1 材料与仪器
羊栖菜购于浙江温州海虎海藻养殖有限公司。葡聚糖标准品(重均分子质量分别为21.1,47.1,107,200,344,708 ku),美国Flu-ka 公司;10种单糖标准品(甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、木糖、岩藻糖、氨基葡萄糖、葡萄糖醛酸、半乳糖醛酸)、1-苯基-3-甲基-5-吡唑啉酮和标准牛血清白蛋白,美国Sigma 公司;乙腈(色谱纯级),美国Tedia 公司;壳聚糖(脱乙酰度80%~95%),国药集团化学试剂有限公司;其它试剂均为国产分析纯级。
Agilent 1260 高效液相色谱仪、Aglient Elipse XDB-C18(4.6 mm×250 mm,5 μm),美国Agilent公司;Shodex ohpak SB-804HQ 高效凝胶渗透色谱柱,日本Shodex 公司;Infinite M200 PRO 酶标仪,瑞士Tecan 公司;800Y 高速多功能粉碎机,永康市铂欧五金制品有限公司;超声波破碎仪,德国Bandelin 公司;Brookhaven 粒度仪,美国布鲁克海文仪器公司。
1.2 试验方法
1.2.1 羊栖菜岩藻聚糖硫酸酯的提取 羊栖菜岩藻聚糖硫酸酯的提取参照Silchenko 等[15]和刘雪等[16]的方法。将新鲜羊栖菜洗净,40℃干燥72 h,粉碎。取适量藻体粉末,95%乙醇脱脂(料液比1∶30),室温搅拌24 h。脱脂后进行提取,提取条件:2% CaCl2溶液,料液比1∶30,60℃提取3 h。提取完毕后,冷却离心,收集上清液,超滤浓缩,截留分子质量100 ku。液体浓缩至原体积的1/10,加入4倍体积95%乙醇,醇沉,沉淀经无水乙醇脱水、烘干后得到羊栖菜岩藻聚糖硫酸酯,命名为SFP。
1.2.2 分子质量测定 多糖分子质量的测定采用高效凝胶渗透色谱法(HPGPC 法)[17]。色谱条件:Shodex ohpak SB-804HQ 分析柱(7.6 mm×300 mm);流动相为0.1 mol/L Na2SO4;流速0.5 mL/min;柱温35℃;进样量20 μL;检测器采用示差折光检测器。以标准品分子质量的对数为纵坐标,保留时间为横坐标,绘制标准曲线,计算样品的分子质量。
1.2.3 单糖组成分析采用PMP 柱前衍生高效
液相色谱法测定SFP 的单糖组成[18]。多糖完全酸水解:准确称取2 mg 样品,加入1 mL 三氟乙酸(2 mol/L),110℃降解6 h,去除多余三氟乙酸,得到完全酸水解的样品。多糖PMP 衍生:多糖降解产物及单糖标准品溶于100 μL 蒸馏水中,随即加入100 μL NaOH 溶液(0.3 mol/L)及120 μL PMP 甲醇溶液(0.5 mol/L),70℃水浴反应100 min。反应结束后加入100 μL HCl 溶液(0.3 mol/L)中和,二氯甲烷萃取3 次,上层液体经0.22 μm 的微孔滤膜过滤后备用。色谱条件:Agilent Eclipse XDBC18 色谱柱(4.6 mm×250 mm,5 μm);流动相为CH3CN:PBS(磷酸盐缓冲液,pH 6.7)=17∶83(体积比);进样量10 μL;柱温35℃;紫外检测器检测波长254 nm;流速1.0 mL/min。
1.2.4 理化性质分析SFP 的总糖含量[19]、蛋白质含量[20]、硫酸基含量[21]、糖醛酸含量[22]分别按照相应的文献进行测定。
1.2.5 壳聚糖-岩藻聚糖硫酸酯纳米粒子(Cs-Fuc NPs)的制备 配制1 mg/mL 的壳聚糖(Cs)溶液(0.2%醋酸溶液溶解)和岩藻聚糖硫酸酯(Fuc)溶液(蒸馏水溶解)。采用聚电解质自组装方法制备纳米粒子,按照不同的Fuc/Cs 体积比(0.6∶1,0.8∶1,1∶1,1.2∶1,1.4∶1)将壳聚糖溶液滴入岩藻聚糖硫酸酯溶液中,同时使用超声波破碎仪(每开启15 s,暂停10 s,共40 s)混合,得到纳米粒悬浮液[1]。
1.2.6 Cs-Fuc NPs 的理化性质 采用Brookhaven粒度仪测定纳米粒子的粒径、Zeta 电位和多分散系数(PDI)。岩藻聚糖硫酸酯复合率(Fuc 复合率):参考文献[23]的方法,纳米粒子溶液经14 000 r/min 离心15 min 后取上层清液0.5 mL,加入0.5 mL 蒸馏水,混匀。继续加入0.5 mL 亚甲基蓝溶液(0.4 mmol/L),混匀,放置5 min,于波长560 nm 处测定吸光度。
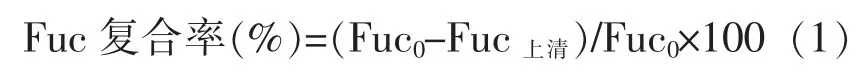
式中,Fuc0——纳米粒子溶液中岩藻聚糖硫酸酯的总量,mg;Fuc上清——离心后上清液中岩藻聚糖硫酸酯的总量,mg。
1.2.7 Cs-Fuc NPs 的体外模拟消化稳定性研究
1.2.7.1 体外消化液配制 模拟过程中使用的人工胃液和人工肠液按照王忠元等[24]的方法配制。
1)模拟胃液的配制 按照《中国药典》2015年版第4 部,取稀盐酸16.4 mL,添加约800 mL 水与10 g 胃蛋白酶,摇匀使其充分溶解后,调节pH值至1.3,加水稀释定容至1 000 mL,即为人工胃液。
2)模拟肠液的配制 按照《中国药典》2015年版第4 部,取磷酸二氢钾6.8 g,加500 mL 水使其溶解,用0.1 mol/L 氢氧化钠溶液调节pH 值至6.8;另外称取10 g 胰蛋白酶加适量水溶解,将两液混合后,加水定容至1 000 mL,即为人工肠液。
1.2.7.2 体外模拟消化 取制备好的纳米乳液15 mL 于50 mL 灭菌离心管,加入模拟胃液15 mL(37℃预热),置于恒温振荡器(37℃)中,分别在0,1,2,4,6 h 取出3 mL 反应液,在100℃水浴中灭酶,4 000 r/min 离心10 min,取离心后溶液2 mL 测定上清液中纳米微粒的粒径、Zeta 电位、PDI等指标。剩余溶液经14 000 r/min 离心15 min 后,取上清液测定Fuc 复合率。上步反应全部结束后,取剩余样液,用0.1 mol/L 碳酸钠调节pH 值至6.8。向管中继续加入肠液15 mL(37℃预热),置于恒温振荡器(37℃)中,分别在0,1,2,4,6 h 取出3 mL,在100℃水浴中灭酶,4 000 r/min 离心10 min 后取2 mL 上清液测定其中纳米微粒的粒径、Zeta 电位、PDI 等指标,剩余溶液经14 000 r/min 离心15 min 后按上述方法取上清液测定Fuc复合率[4]。
2 结果与分析
2.1 多糖的理化性质及分子质量测定
根据表1所示,SFP 的分子质量在101.5~701.0 ku 之间,总糖含量为56.42%,蛋白质含量为3.26%,硫酸基含量为21.07%,未检测到糖醛酸。根据单糖组成的结果可知,糖醛酸含量极低,因此化学法未能检测到糖醛酸,这与以往的研究有所不同,可能是由于藻类生长环境、岩藻聚糖硫酸酯处理方法的不同造成的[25-26]。
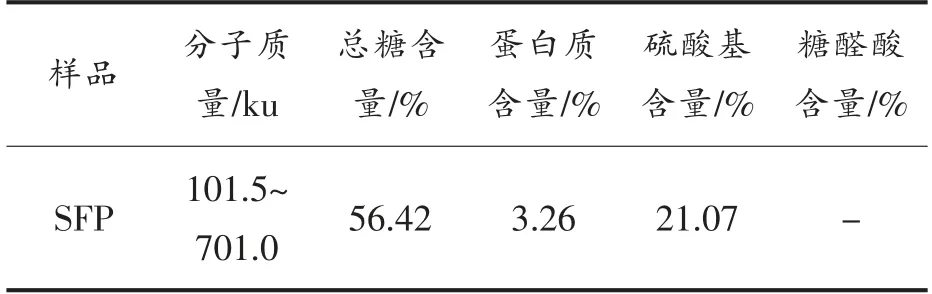
表1 SFP 的理化性质测定结果Table 1 The results of physico-chemical analysis of SFP
2.2 单糖组成
由图1可知,SFP 由甘露糖、氨基葡萄糖、葡萄糖醛酸、半乳糖、岩藻糖组成,物质的量比分别为3.96%,0.37%,0.42%,27.20%,68.05%。其中,岩藻糖含量最高,半乳糖、甘露糖的含量次之,这与近年来报道的海藻岩藻聚糖的单糖组成相近[25],表明SFP 为岩藻聚糖的一种。
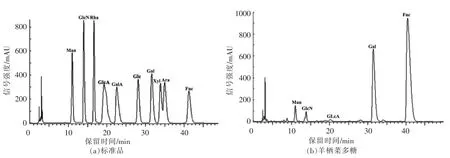
图1 SFP 的单糖组成分析Fig.1 The monosaccharide composition of SFP
由表2可知,不同Fuc/Cs 比例下制备的纳米粒子粒径在330~450 nm 之间。当Fuc/Cs 比例为1.4∶1 时,纳米粒子粒径最小;当比例为0.6∶1 时,粒径最大。Zeta 电位的范围为27~31 mV,PDI 的范围为0.2~0.29,表明纳米溶液体系稳定。Fuc 复合率的范围为85%~93%,并随着Fuc/Cs 比例的增大总体呈现下降趋势,这可能是因为Fuc 与Cs的结合量达到饱和[4]。
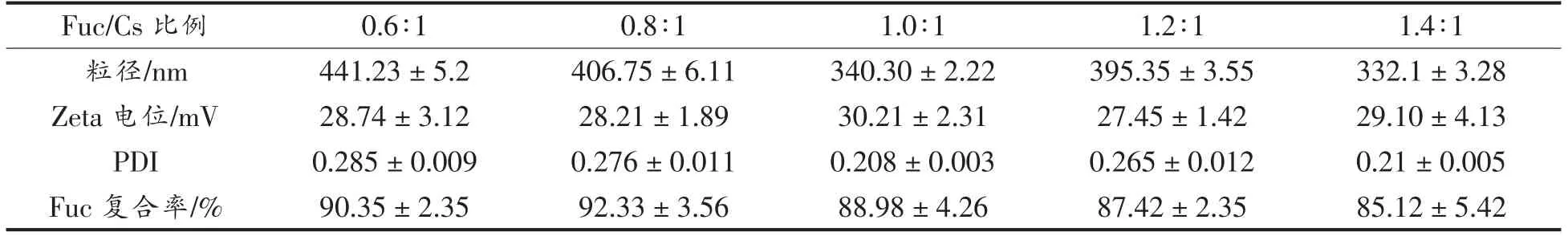
表2 不同Fuc/Cs 比例的纳米粒子的理化性质Table 2 Physico-chemical of nanoparticles with different Fuc/Cs ratios
2.3 体外模拟胃液消化
测定制备的纳米粒子在人工胃液中粒径、Zeta 电位、PDI、Fuc 复合率的变化,结果如图2~5所示。在0,1,2,4,6 h 时,纳米粒子的粒径为330~470 nm,Zeta 电位为25~32 mV,PDI 为0.18~0.29,Fuc 复合率为84%~95%,相对于初始状态变化不大,说明纳米粒子在人工胃液环境中呈现出良好的稳定性。
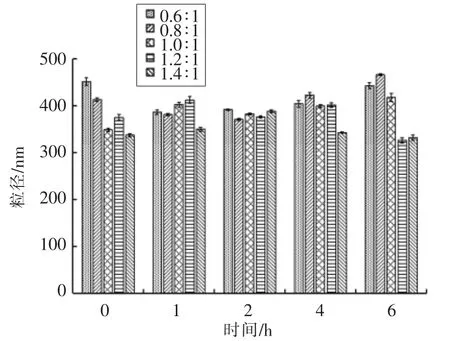
图2 人工胃液中纳米粒子粒径变化Fig.2 Changes of diameter of the nanoparticles in the artificial gastric juice
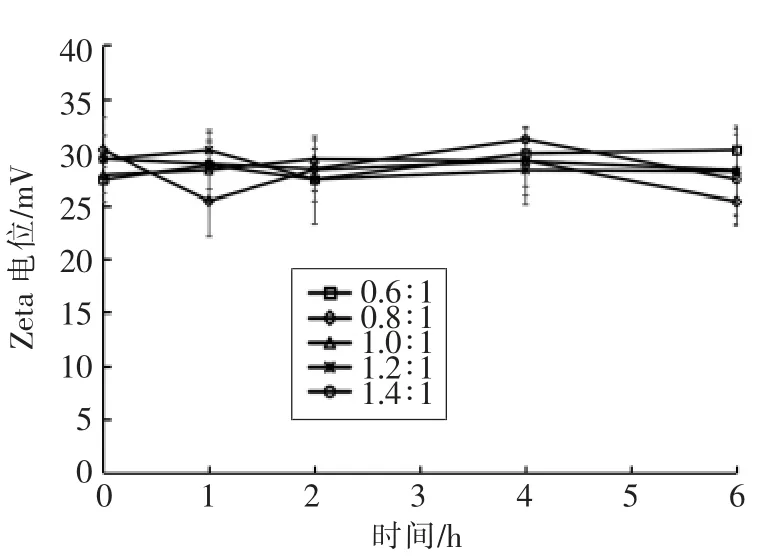
图3 人工胃液中纳米粒子Zeta 电位变化Fig.3 Changes of Zeta potential of the nanoparticles in the artificial gastric juice
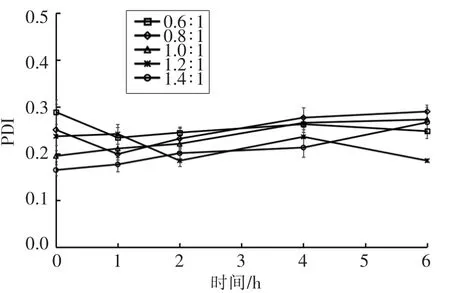
图4 人工胃液中纳米粒子PDI 变化Fig.4 Changes of polydispersity of the nanoparticles in the artificial gastric juice
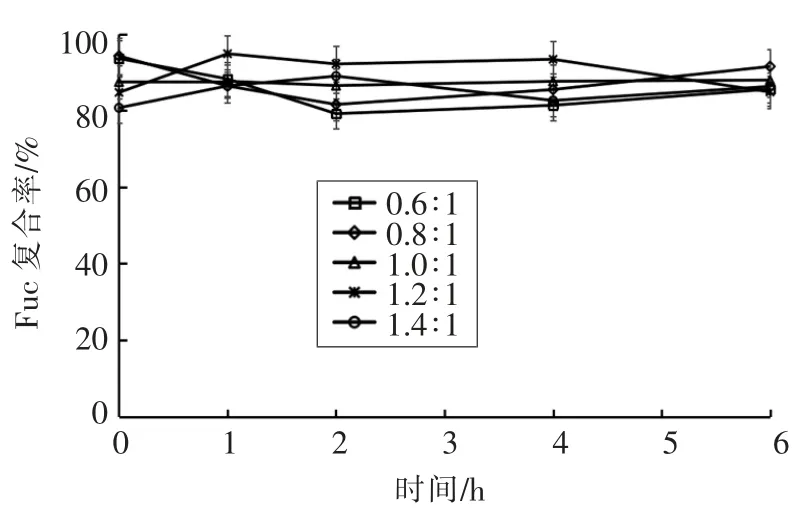
图5 人工胃液中Fuc 复合率的变化Fig.5 Changes of Fuc loading rate of the nanoparticles in the artificial gastric juice
2.4 体外模拟肠液消化
测定制备的纳米粒子在人工肠液中粒径、Zeta 电位、PDI、Fuc 复合率的变化,结果如图6~9所示。粒径在1 h 后均增大至1 μm 以上,表明纳米粒子发生膨胀。Zeta 电位绝对值减小、PDI 增大,表明纳米体系不稳定。当Fuc/Cs 比例为0.6∶1,0.8∶1,1.4∶1 时,Fuc 复合率显著降低,这是由于在碱性环境中,壳聚糖质子化消失致使纳米粒子膨胀或裂解。当Fuc/Cs 比例为1.4∶1 时,复合率最低降至36%,说明大量岩藻聚糖硫酸酯被释放出来,纳米粒子被破坏。当Fuc/Cs 比例为1.0∶1 和1.2∶1时,Fuc 复合率相对稳定。
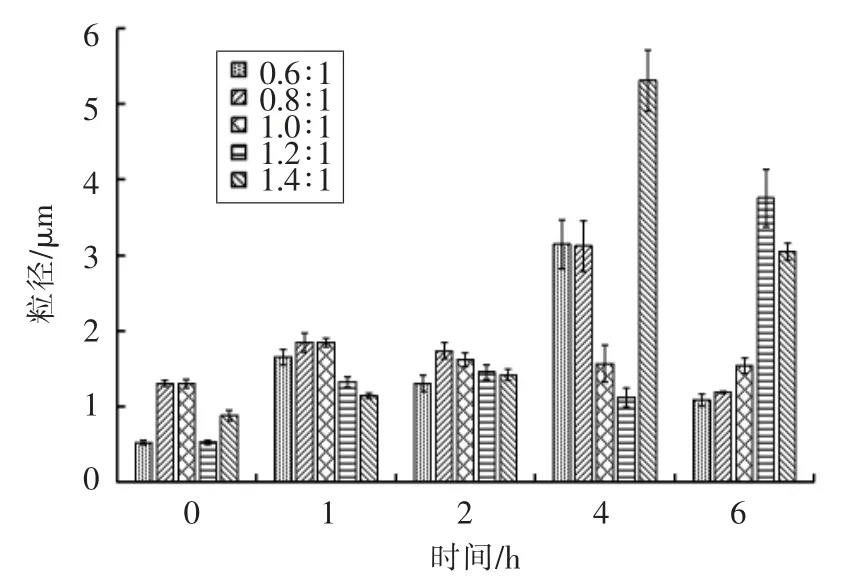
图6 人工肠液中纳米粒子粒径变化Fig.6 Changes of average diameter of the nanoparticles in artificial intestinal juice
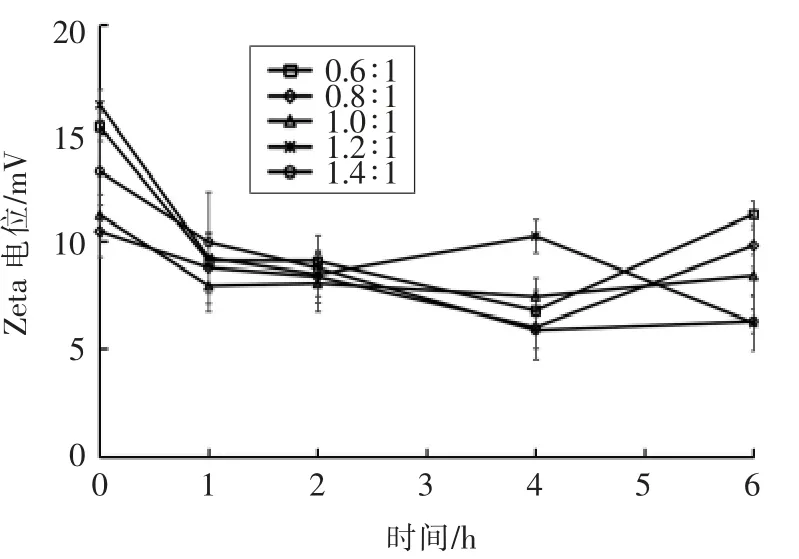
图7 人工肠液中纳米粒子Zeta 电位变化Fig.7 Changes of Zeta potential of the nanoparticles in artificial intestinal juice
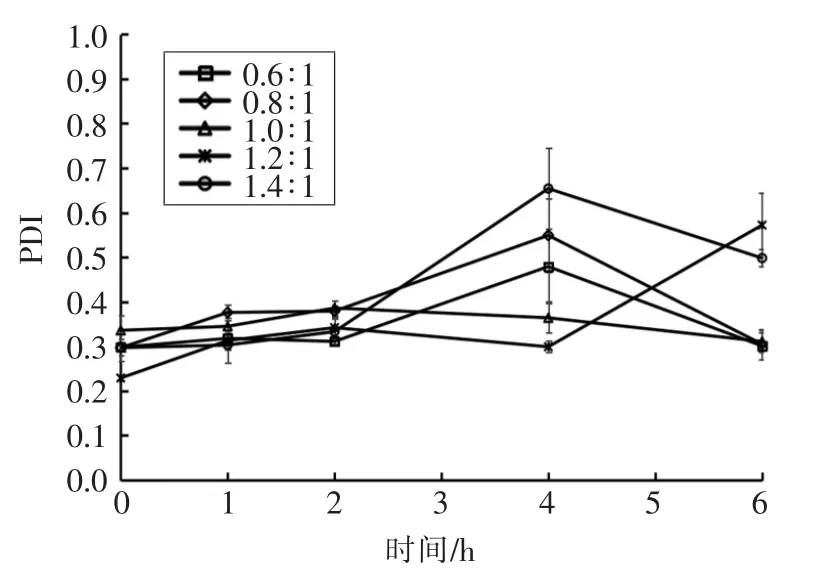
图8 人工肠液中纳米粒子PDI 变化Fig.8 Changes of polydispersity of the nanoparticles in artificial intestinal juice
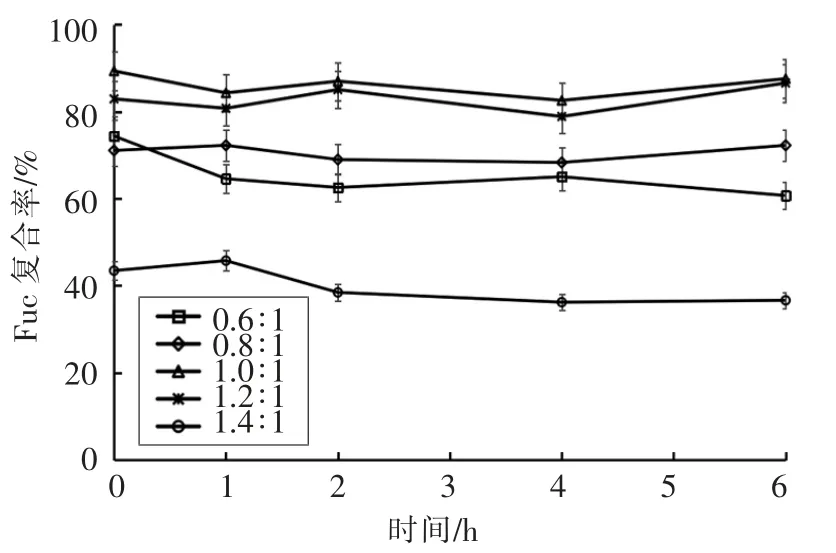
图9 人工肠液中Fuc 复合率的变化Fig.9 Changes of Fuc loading rate of the nanoparticles in artificial intestinal juice
3 结论
本文从羊栖菜中提取得到岩藻聚糖硫酸酯,通过测定分子质量、单糖组成、总糖含量、蛋白质含量、硫酸基含量和糖醛酸含量,初步表征其结构特点。以此岩藻聚糖硫酸酯和壳聚糖为原料,采用聚电解质自组装的方法制备不同岩藻聚糖硫酸酯/壳聚糖比例的纳米粒子。通过测定纳米粒子在人工胃、肠液中的粒径、Zeta 电位、PDI、岩藻聚糖硫酸酯复合率的变化来评价纳米粒子的稳定性,筛选出在人工胃液中稳定性良好,在人工肠液中解聚性良好的纳米粒子。根据模拟消化的结果可知,在人工胃液环境中,当Fuc/Cs 比例为0.6∶1,0.8∶1,1.4∶1 时,制备得到的纳米粒子溶液粒径、Zeta 电位、PDI、Fuc 复合率变化不大,表现出良好的稳定性。但是在人工肠液环境中,粒径、Zeta 电位、PDI、Fuc 复合率变化显著,纳米粒子稳定性大大降低,尤其是当比例为1.4∶1 时,Fuc 复合率降至36%,纳米粒子被显著破坏。因此,当羊栖菜岩藻聚糖硫酸酯/壳聚糖纳米粒子Fuc/Cs 比例为0.6∶1,0.8∶1,1.4∶1 时,在人工胃液中表现出良好的稳定性,在人工肠液中表现出良好的解聚性,可作为潜在的口服药物运载体系,具有良好的市场前景。

