干酪乳杆菌发酵及热加工方式对小麦蛋白抗原性的影响
付文慧,刘成龙,田 阳,陶 莎,薛文通*
(1 中国农业大学 北京食品营养与人类健康高精尖中心 北京100083 2 中国农业大学食品科学与营养工程学院 北京100083)
小麦过敏、乳糜泻、非乳糜泻小麦敏感(NCGS)等“小麦相关疾病”在世界各地的发病率在不断上升[1]。对于这些疾病患者而言,避免摄入小麦致敏蛋白是唯一且有效的方法[2]。除探究过敏机制、寻找治疗的突破点外,研发低致敏性的小麦食物成为当前亟待解决的问题。乳酸菌在发酵过程中通过自身的蛋白质水解系统降解相关蛋白质及多肽,并通过产酸改变发酵面团的pH 值以激活面粉的内源性蛋白酶,进一步加强蛋白质的降解[3]。在蛋白质降解为多肽及氨基酸时,既改变了面团风味,也改变了致敏蛋白的含量。此外,乳酸菌代谢产生的抗真菌物质可以延长产品货架期,产生的胞外多糖可以改善面团的品质[4]。鉴于此,乳酸菌发酵作为一种很有前景的发酵方式,值得进一步的探究。乳酸菌种类繁多,目前对于其降低小麦蛋白抗原性的研究多集中于植物乳杆菌发酵方面。干酪乳杆菌被证实具有细胞被膜蛋白酶,而这种酶在降解蛋白质的过程中起到很重要的作用[3,5-7]。此外,大量研究表明加工方式影响食物蛋白的抗原性,目前用于降低食物蛋白抗原性的加工方法主要有热加工(蒸煮、烘烤等)和非热加工(发酵、酶解、超声等)[8]。蒸煮等热加工方式会改变食物蛋白的构象结构,从而改变抗原的构象表位,而抗原蛋白线性表位的破坏主要发生在发酵和酶解过程中[8-9]。Rao 等[10]研究发现低温烘烤和水煮能够产生较低致敏性的花生。Rui 等[11]利用植物乳杆菌发酵降低了大豆分离蛋白的抗原性。Li 等[12]利用碱性蛋白酶和木瓜蛋白酶连续酶解降低了小麦中致敏谷蛋白含量。本研究利用分离自老面中的1 株干酪乳杆菌发酵面团,研究其对小麦致敏蛋白含量及抗原性的影响,研究加工条件与抗原性之间的关系,为开发低致敏性小麦制品提供理论依据。
1 材料与方法
1.1 材料与试剂
革兰氏染色试剂盒、细菌组DNA 提取试剂盒、乳酸杆菌选择性琼脂、Bradford 蛋白浓度测定试剂盒、SDS-PAGE 分离/浓缩胶缓冲液、预染蛋白Maker、SDS-PAGE 蛋白上样缓冲液、AP-羊抗兔二抗、BCIP/NBT 碱性磷酸酯酶显色试剂盒,北京索莱宝科技有限公司;EL-TMB 显色试剂盒,上海生工生物;试验所用试剂均为分析纯级,兔过敏血清由实验室自制。
1.2 主要仪器
PCR 热循环仪,杭州晶格科学仪器有限公司;凝胶成像系统,上海勤翔科学仪器有限公司;Multiskan FC 酶标仪,上海赛默飞公司;mini-proteanⅡ凝胶仪,美国伯乐公司。
1.3 试验方法
1.3.1 干酪乳杆菌的分离鉴定 称取酸面团样品5 g 于无菌均质袋中,加入45 mL 灭菌后的蛋白胨水(1%蛋白胨,0.43% NaCl,0.72% Na2HPO4,0.36% KH2PHO4,pH 7.0),混匀后梯度稀释,取10-5~10-7稀释梯度,涂布于乳酸杆菌选择性琼脂培养基,37℃培养24 h,随机挑取菌落进行过氧化氢酶和革兰氏染色试验。取过氧化氢酶阴性、革兰氏阳性且镜检为杆状的菌株进行进一步分子鉴定。
采用细菌组DNA 提取试剂盒提取所分离菌株的DNA,利用细菌通用引物27F(5’-AGCGGATCACTTCACACAGGACTACGGCTACCTTGTAC GA-3’)和1492R(5’-GCAGAGTTCTCGGAGTCACGAAGAGTTTGATCCTGGCTCAG-3’)通 过PCR 反应对16S rRNA 基因进行扩增。PCR 反应条件为:94℃预变性5 min:94℃变性30 s,55℃退火30 s,72℃延伸5 min,35 个循环;72℃充分延伸10 min。扩增产物经琼脂糖凝胶电泳检测后送于北京生工生物工程有限公司测序。所得序列与NCBI 文库比对后,用MegaX 构建进化树。
1.3.2 菌株生长曲线和菌落数与OD 值对应关系的测定 取一支冻存菌种于MRS 液体培养基中,37℃下活化24 h。取0.5 mL 活化菌液于6 个分别装有30 mL MRS 肉汤的三角瓶中,37℃培养0,4,8,12,16,20 h,在波长600 nm 处测量各时段菌液吸光度值,绘制生长曲线。
取活化菌液用MRS 肉汤稀释2,2.5,3,4,5,6倍,测定OD600nm值,并梯度稀释,倾注于MRS 琼脂中,37℃培养48 h 后计算活菌数。
1.3.3 酸面团的制备 取指数生长期菌液,6 000×g 离心10 min,生理盐水洗涤2 次,双蒸水重悬浮至50 mL,调节OD600nm值为0.8。100 g 面粉与50 mL 菌悬液投入和面机,和面15 min,面团内菌体数量约为108CFU/g。发酵温度30℃,相对湿度80%,发酵24 h,定时取样。
1.3.4 发酵过程中pH 值、可滴定酸度(TTA)和面团蛋白含量的测定 每隔2 h 取样,于无菌均质袋中10 倍稀释后混合均匀,测定pH 值并用0.1 mol/L NaOH 滴定至pH 值为8.3,记录所消耗NaOH 的体积数即TTA 值。
将发酵面团样品冻干后磨粉于-20℃保存。蛋白提取参照Prado 等[13]的方法,具体操作如下:向500 mg 面粉中加入10 mL Tris-HCl 缓冲液(50 mmol/L,pH 8.8),于4℃下搅拌1 h,20 000×g,4℃离心20 min,收集上清液(清蛋白和球蛋白);沉淀用5 mL 缓冲液洗涤3 次,加入10 mL 75%乙醇,室温下搅拌1 h,离心20 min,收集上清液(醇溶蛋白);采用5 mL 75%乙醇洗涤沉淀3 次,加入10 mL 50 mmol/L Tris-HCl(pH 8.8,1% SDS,0.5%DTT),4℃搅拌2 h,离心20 min,收集上清液(谷蛋白)。采用考马斯亮蓝法测蛋白质质量浓度。
1.3.5 SDS-PAGE 电泳及免疫印迹分析 参照Rao 等[10]的方法,具体操作如下:制备12%的分离胶和5%的浓缩胶,样品溶液稀释为相同浓度后与5x 上样缓冲液混合并沸水加热5 min,进样后进行垂直电泳(浓缩胶电压80 V,分离胶电压110 V),电泳结束后采用考马斯亮蓝R250 染色,脱色后于凝胶成像系统拍照。
未染色的电泳胶转移至硝酸纤维素膜上(300 mA 冰浴下转膜90 min),丽春红染色确认转膜成功。加入5%脱脂奶粉,摇床上摇动封闭2 h;加入稀释的一抗(抗小麦蛋白兔血清),4℃下孵育过夜;TBST 缓冲液(0.02 mol/L TBS,0.05% Tween-20,pH 7.6)洗膜后,加入稀释的AP-羊抗兔二抗,室温下孵育90 min;洗膜后,利用BCIP/NBT 碱性磷酸酯酶显色试剂盒显色。
1.3.6 不同发酵方式及热加工方法制作馒头 向100 g 面粉(乳酸菌菌落数108~109CFU/g)中加入50 mL 菌悬液和0.35 g 安琪酵母调制面团后分别发酵。冷藏发酵条件为:4℃发酵3 d 后于37℃,80%相对湿度发酵60 min;一次发酵条件为:37℃,80%相对湿度发酵60 min;二次发酵条件为:中种面团(60 g 面粉,0.35 g 酵母,30 mL 菌悬液)于37℃发酵4 h 后加入40 g 面粉和20 mL 水继续发酵1 h。发酵好的3 种面团用于烤制(180℃,20 min)和蒸制(沸水蒸制20 min)。取样冻干,磨粉备用。
1.3.7 蛋白含量及酶联免疫吸附试验测定 总蛋白提取参照Akagawa 等[14]的方法,具体操作如下:25 mg 面粉加入1 mL 蛋白提取液【40 mmol/L Tris,8 mol/L 尿素,4% 3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)】,冰浴下超声提取30 s,6次;4℃下16 000×g 离心20 min,收集上清液,考马斯亮蓝法测蛋白质量浓度。
采用酶联免疫吸附试验评价样品抗原性[15]。使用50 mmol/L,pH 9.6 的碳酸盐缓冲液稀释蛋白至5 μg/mL,按100 μL/孔加入酶标板,4℃静置过夜;用TBST 洗板4 次,按150 μL/孔加入1%BSA封闭液,37℃温育2 h;TBST 洗板后按100 μL/孔加入使用1% BSA 稀释的抗小麦蛋白兔血清稀释液(1∶10 000),37℃温育2 h,洗板;按100 μL/孔加入500 倍稀释的羊抗兔HRP-IgG,37℃温育1 h,洗板;使用TMB 显色试剂盒显色,于波长450 nm 处测OD 值。
1.4 数据分析
试验数据用SPSS 软件处理,图由GraphPad Prism 绘制。
2 结果与分析
2.1 干酪乳杆菌的分离鉴定
从培养基中随机挑选白色、圆形的凸起菌落,经过氧化氢酶和革兰氏染色试验后,选出过氧化氢酶阴性、革兰氏阳性菌株进行16S rRNA 基因测序,经同源序列比对后,共鉴定出4 株干酪乳杆菌和2 株粪肠球菌。由图1的系统发育进化树可以看出,共检测到2 个属:肠球菌属(Enterococcus)和乳杆菌属(Lactobacillus)。MM1(干酪乳杆菌)、MM6(干酪乳杆菌)、MM8(副干酪乳杆菌)、MM9(干酪乳杆菌)和YL1(屎肠球菌)、YM2(屎肠球菌)形成了2 个类群并与对应的模式菌株聚在一起,进一步验证了分子学鉴定结果的可靠性。
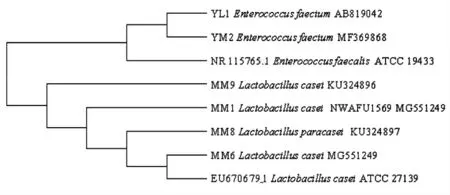
图1 乳酸菌16S rRNA 序列系统发育树Fig.1 Phylogenetic tree based on 16S rRNA gene sequences of lactic acid bacteria
2.2 菌株生长曲线和菌落数与OD 值对应关系的测定
选择与模式菌株亲缘关系最近的MM6 菌株进行发酵试验。如图2所示,干酪乳杆菌MM6 在2~14 h 处于指数生长期,在14~20 h 进入生长稳定期,20 h 以后由于营养物质不足和代谢物的积累,菌体死亡数量增多。试验收集指数生长后期菌体进行发酵试验,此时菌株生长旺盛,酶等代谢相关物质活性较高。通过倒平板记取菌落数,得到其与OD600nm值的对应关系(图2b),纵坐标为稀释106后的菌落数,双蒸水重悬浮菌泥至相应OD600nm值以保证发酵面团中活菌体的含量为108CFU/g。

图2 干酪乳杆菌菌落数变化Fig.2 Changes of number of Lactobacillus casei MM6 colonies
2.3 发酵过程中pH 值、TTA 值的变化
如图3所示,随着发酵时间延长,空白组(K)pH 值和TTA 值变化不大,然而干酪乳杆菌添加组(LAB)的pH 值逐渐降低,24 h 后低至3.9,TTA值与pH 值变化呈相反的趋势。干酪乳杆菌属于异型发酵乳酸菌,发酵过程中乳酸、醋酸等有机酸的代谢导致面团pH 值下降、TTA 值增加。
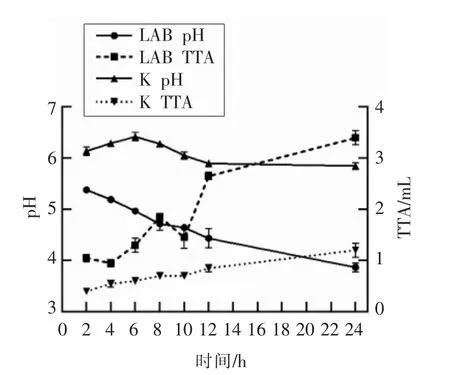
图3 面团发酵过程中pH 值和TTA 值的变化Fig.3 Changes of pH and TTA during dough fermentation
2.4 发酵过程中蛋白组分及抗原性的变化
采用SDS-PAGE 试验对发酵过程中面团蛋白的变化进行了评估。如图4所示,在发酵24 h后,清蛋白、球蛋白、醇溶蛋白、谷蛋白的组分和含量均有变化。随着发酵的进行,清、球蛋白中25~35,15~25,10~15 ku 条带变浅;醇溶蛋白条带无明显变化;谷蛋白80 ku 和40 ku 左右的条带发酵后明显变浅。12,15~25,40,88 ku 区域分别对应着小麦过敏原Tri a 37,Tri a 18,Tri a 36 和Tri a 26,从图4可以看出,这些区域的蛋白在发酵24 h 后均有一定程度的降解。
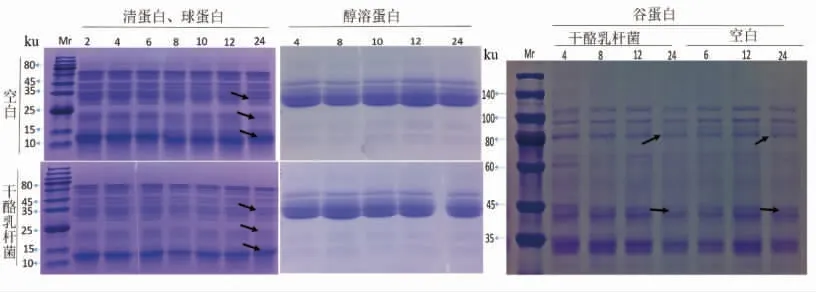
图4 干酪乳杆菌MM6 发酵对蛋白组分的影响Fig.4 Effects of Lactobacillus casei MM6 fermentation on wheat protein composition
图5显示,发酵后的大部分蛋白样品仍与抗小麦蛋白兔血清发生了较为强烈的反应。清蛋白和球蛋白中12 ku 和15~25 ku 区域的Tri a 37 和Tri a 18 含量大大降低,与抗体结合反应随着发酵时间的延长而减弱。醇溶蛋白和谷蛋白在25~30 ku 区域内逐渐出现了新的免疫结合条带,说明一些免疫肽段可被降解成更小分子质量的蛋白质,但是仍具有抗原性,可能是由于过敏原线性表位仍未被破环。发酵过程中面团蛋白组分及蛋白抗原性变化表明,大部分小麦过敏原难以通过发酵得到降解,Loponen 等[16]和Gänzle[17]的研究指出,酸面团发酵过程中一部分谷蛋白会被降解成30 ku 左右的醇溶蛋白,这与本试验结果相符。发酵是一种缓慢酶解的过程,乳酸菌发酵产酸能将面团的pH 值降至4 左右,可激活面团中主要的蛋白酶(天冬氨酸蛋白酶)分解大分子蛋白。面粉中的内源蛋白酶以及乳酸菌中的肽酶等均能起到水解面团蛋白的作用。已有研究表明干酪乳杆菌具有膜蛋白酶,可将体系中的大分子蛋白水解为多肽,膜上的多肽转运系统会将多肽转移至胞内,胞内肽酶将继续水解肽段[3,18]。因此,相比于空白组,添加干酪乳杆菌的面团,小麦蛋白被部分水解。
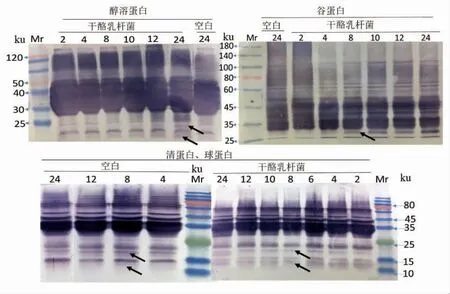
图5 干酪乳杆菌MM6 发酵对过敏原抗原性的影响Fig.5 Effects of Lactobacillus casei MM6 fermentation on wheat allergens
2.5 不同加工方式对干酪乳杆菌降低小麦蛋白抗原性的影响
已有研究表明,加工方式对食物抗原性变化有较强的影响[8-9],为进一步探究干酪乳杆菌对小麦蛋白抗原性的影响,本试验中采用不同发酵方式制作面团后蒸制或烤制,并取样测定蛋白质量浓度及抗原性的变化。由图6a 和6b 可知,热加工后蛋白含量降低。已有研究证实,热加工可使蛋白质发生降解或聚集,导致含量下降[19-20]。由图6c~e 可知,未经热加工时,干酪乳杆菌添加组并未起到明显地降低小麦蛋白抗原性的作用(与未添加组相比),可能是由于发酵作为一种缓慢地发生方式,体系中的蛋白酶、肽酶需要时间和适宜的环境发挥酶解作用降解致敏原蛋白,而本研究所用的3 种发酵方式时间均相对较短,虽然冷藏发酵时间较长,但是4℃的低温并不能使酶充分发挥作用。经发酵后烘烤处理,部分处理组抗原性略有增高。已有研究证实,烘焙时美拉德反应产物可能会增高小麦蛋白的过敏原性[20-21]。如图6e所示,经冷藏发酵后蒸制,干酪乳杆菌添加组的抗原性明显降低(与未添加组相比),可能是由于发酵降解了部分难溶过敏原,经蒸制后,水溶性小分子蛋白发生聚集,掩盖了抗原线性表位从而进一步降低了混合发酵面团的抗原性。如图6f所示,颜色由红到绿代表抗原性逐渐降低。仅发酵、发酵后蒸制、发酵后烘烤分别聚成了3 类,然而干酪乳杆菌添加组)与干酪乳杆菌空白组并未聚成2 类,快速发酵、中种发酵和冷藏发酵聚成了2 类,说明干酪乳杆菌作为发酵种时加工方式对小麦蛋白抗原性的影响大于干酪乳杆菌发酵。中种发酵和冷藏发酵之间无显著差异但是区别于快速发酵。此外,蒸制位于加工聚类图的最下方,与图6c 和6d 一致。无论是干酪乳杆菌空白组还是添加组,蒸制都有别于发酵和烤制,具有更好地降低面团抗原性的能力。在所有处理中,具有显著优势的是干酪乳杆菌添加组冷藏/中种发酵后蒸制。
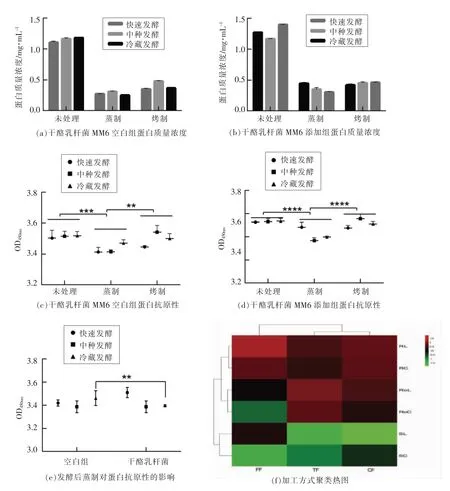
图6 加工方式对面团蛋白质量浓度及抗原性的影响Fig.6 Effects of processing on mass concentration and antigenicity of wheat protein
3 讨论
乳酸菌在发酵过程中通过自身的蛋白质水解系统水解相关蛋白质及多肽,并通过产酸改变发酵面团的pH 值以激活面粉的内源性蛋白酶,增加麸质蛋白的溶解性,进一步促进蛋白质的降解[3,22]。发酵作为一种天然安全的加工方式,已被很多研究者用来制作品质较好的低敏性食物。然而仍需要探索更优质的菌种及加工方式之间的相互作用规律,为规模化、标准化的生产低敏性食物提供基础。Rizzello 等[23]、Zannini 等[24]和Rashmi等[25]利用希式乳杆菌、消化乳杆菌、短小乳杆菌和旧金山乳杆菌复配物发酵面团,发现长时间发酵可以显著降低面团蛋白的IgE 结合能力。此外,植物乳杆菌和类食品乳杆菌也被应用到低敏性产品——无麸质食品的制作中。
本次试验结果显示,干酪乳杆菌发酵能显著降低过敏原Tri a 37,Tri a 18,Tri a 36 和Tri a 26 的含量,降低Tri a 37 和Tri a 18 的抗原性。然而,发酵后产生的一些新的小分子质量的条带仍具有抗原性,推测可能是由于抗原线性表位未被破坏。为进一步探究干酪乳杆菌对小麦蛋白抗原性的影响,采取不同的发酵方式及热加工方式处理面团。结果显示:中种发酵和冷藏发酵对小麦蛋白抗原性的影响无显著差异但是区别于快速发酵;蒸制区别于发酵和烤制,具有显著地降低小麦蛋白抗原性的能力;干酪乳杆菌添加组经冷藏或中种发酵后蒸制,显著地降低了小麦蛋白的抗原性。得到这种结果的主要原因可能是:1)长时间的发酵能使菌种生长充分,有机酸等代谢产物积累,从而充分发挥自身蛋白水解系统的作用,激活面粉内源酶,并增加难溶蛋白的溶解性;2)蛋白质受热后其空间构象发生改变,可能破坏了部分过敏原蛋白的构象表位,然而烘烤过程中产生的美拉德产物增强了蛋白的抗原性,此外蒸制过程中水溶性小分子蛋白聚集,掩盖了抗原线性表位,进一步降低了蛋白的抗原性。
4 结论
干酪乳杆菌发酵24 h 能降低小麦中致敏原Tri a 37,Tri a 18,Tri a 36 和Tri a 26 的含量,并降低Tri a 37 和Tri a 18 的抗原性。相比于中种发酵和冷藏发酵,快速发酵对于小麦蛋白的抗原性影响较小;蒸制区别于发酵和烤制,具有显著地降低小麦蛋白抗原性的能力。面团经干酪乳杆菌发酵后蒸制,抗原性得到了进一步的降低,接下来将从复合加工方式对于小麦蛋白抗原性的影响进一步进行研究。

