小檗碱对高脂加链脲佐菌素诱导的糖尿病大鼠的影响*
郭志利,姚克青,姚玉英
1.石家庄医学高等专科学校,河北 石家庄050000;2.北京市朝阳区桓兴肿瘤医院,北京050599
糖尿病是一种由体内胰岛素分泌不足或靶细胞对胰岛素敏感性降低而引起的糖、脂代谢紊乱的慢性疾病[1],其主要特征为高血糖。糖尿病是世界性公共卫生问题,主要分为Ⅰ型糖尿病和Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM),其中T2DM约占糖尿病患者总数90%左右[2]。随着人们生活水平的提高和生活习惯的改变,全球T2DM发生率呈上升趋势,是继心脑血管疾病后危害人类健康的第二大杀手[3]。国际糖尿病联盟报道显示,我国糖尿病确诊人数为1.1亿,是世界第一糖尿病大国[4],预计到2040年T2DM患者人数会达到1.5亿。T2DM作为一种终身性慢性疾病,需要患者长期服药并定期门诊随访,多种原因会导致患者血糖控制不佳,引起各种并发症,累及多个器官和系统损伤。T2DM发病机制复杂,其中胰岛素抵抗(insulin resistance,IR)和胰岛β细胞功能障碍在T2DM发病中作用显著[5];近年来研究发现,慢性低度炎症也是T2DM重要的发病机制之一[6],炎症因子长期保持高水平不但损害血管内皮,而且增加血液黏度,激活急性反应,加重血脂紊乱,加速T2DM的进展[7],因此,控制炎症也是T2DM治疗的途径之一。当前对于T2DM的治疗一般采取运动饮食干预、二甲双胍、胰岛素等治疗。中医对糖尿病的治疗历史悠久,经验丰富,在临床治疗中亦逐渐普及。黄连是常用的清热解毒药,研究显示其有效成分小檗碱对炎症反应具有明显作用[8],本研究将其作用于高脂加链脲佐菌素(streptozotocin,STZ)诱导的T2DM大鼠,观察其对大鼠糖代谢、脂代谢及相关炎症因子的影响。
1 材料
1.1 动物健康清洁级SD大鼠70只,5周龄,雌性,体质量(140±6.8)g,由江苏省动物实验中心提供,许可证号:SCXK(苏)2018-0015,实验动物饲养设施使用许可证号:SYXK(苏)2017-0006。专人看管,分笼饲养,环境温度20~25℃,相对湿度50%~70%,定期消毒。无外界干扰下常规饲养,自由摄食、饮水,12 h/12 h昼夜循环,适应性喂养1周后开始实验。本实验获得石家庄医学高等专科学校实验动物伦理委员会批准,符合中国伦理委员会有关动物研究指导原则。
1.2 试剂与药品STZ(美国Sigma公司,批号:S0103);盐酸二甲双胍(深圳市中联制药有限公司,国药准字:H44024853,批号:1207340);小檗碱注射液(国药准字:H43021804,批号:110857,山东优维药业有限公司);血清胰岛素ELISA试剂盒(fasting insulin,FINS,欣博盛生物有限公司,货号:Z12317);Trizol试剂(Thermo Fisher Scientific公司,批号:ARB12952);总胆固醇试剂盒(total cholesterol,TC,上海羽朵生物科技有限公司,货号:A12931);三酰甘油测定试剂盒(triglycerides,TG,基蛋生物科技股份有限公司,货号:J-2473);血清脂联素(adiponectin,ADPN)检测试剂盒、瘦素(leptin,LEP)检测试剂盒(北京杰辉博高生物技术有限公司,货号:YAD1732、YD-D30630);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒、白细胞介素-6(interleukin-6,IL-6)检测试剂盒(北京百奥莱博科技有限公司,货号:ARB13606、ARB13449);即用型PBS粉剂(武汉谷歌生物科技有限公司,批号:gg13275);柠檬酸、柠檬酸钠(山东省中创柠檬生化有限公司,批号:ab1357、ab49237);荧光定量RNA逆转录试剂盒(武汉基因美生物科技有限公司,批号:ab72468);大鼠TNF-α、IL-6 qPCR引物由上海杏园瑞民生物工程有限公司合成;常规饲料(江苏省动物实验中心,主要包括70%碳水化合物、20%蛋白质、10%脂肪以及必要微量元素,热量为300 Kcal/100 g);在常规饲料的基础上加入猪油、大豆等,经调整后的高脂饲料配方如下:55%脂肪、25%蛋白质、20%碳水化合物以及必要微量元素,热量为610 Kcal/100 g。
1.3 仪器电子天平(成都倍赛克仪表研究所);超净工作台(苏州净化设备仪器公司);MH550冰冻切片机(美国Thermo Fisher公司);RT-2100C自动酶标仪、RT 200C全自动生化分析仪(美国Rayto公司);CytoFLEX流式细胞仪(美国Beckman Coulter公司);快速实时荧光定量PCR仪(广州华峰生物科技有限公司);罗氏卓越型血糖仪ACCU-CHEK Performa(Roche Diagnostics)。
2 方法
2.1 试液配制①柠檬酸缓冲液:称取柠檬酸1.9 g和柠檬酸钠2.8 g,分别溶解于100 mL蒸馏水中,取柠檬酸溶液30 mL和柠檬酸钠溶液20 mL混合,并加入蒸馏水定容至100 mL,得到柠檬酸缓冲液。②STZ溶液:称取0.4 g STZ溶于50 mL柠檬酸缓冲液中,置于冰水浴中,使用前5 min完成溶液配制,1 h内注射完毕。
2.2 T2DM大鼠模型制备及分组给药70只大鼠从1号~70号进行编号,采用随机数字表法随机选取10只作为空白对照组(A组),其余60只作为造模组。根据相关文献记录方法造模[9]:适应性饲养一周后禁食4 h,监测血糖使其处于正常范围;A组大鼠给予常规大鼠饲料喂养,造模组大鼠给予高脂饮食。饲养4周后禁食12 h,造模组大鼠给予STZ溶液腹腔注射,剂量为50 mg·kg-1,A组大鼠给予等量柠檬酸缓冲液腹腔注射。注射过程约10~15 min,避免过快注射。造模组大鼠注射30 min后给予15%葡萄糖溶液灌胃,剂量10 mL·kg-1。注射60 min后给予4 mL 4℃生理盐水灌胃,避免因长时间禁食而引起低血糖休克和酮症酸中毒。A组大鼠仅给予4 mL 4℃生理盐水灌胃。分别于注射72 h及1周后采集静脉血测量空腹血糖(fasting blood glucose,FBG),取3次测量平均值作为最终结果,若2次FBG≥16.7 mmol·L-1则认为糖尿病大鼠造模成功。造模后7 d内4只大鼠死亡,病死率为6.67%,6只大鼠造模失败,剔除上述大鼠后剩余50只大鼠,采用随机数字表法分为5组,分别为T2DM模型组(B组)、阳性对照组(C组)、小檗碱低剂量组(D组)、小檗碱中剂量组(E组)、小檗碱高剂量组(F组),每组10只大鼠。
造模成功后第3天开始给药,连续12周。A组:常规饲料喂养,同体积生理盐水灌胃;B组:高脂饲料喂养,同体积生理盐水灌胃;C组:高脂饲料喂养,盐酸二甲双胍临床等效剂量0.250 mg·g-1灌胃给药;D组:高脂饲料喂养,小檗碱注射液0.125 mg·g-1灌胃给药;E组:高脂饲料喂养,小檗碱注射液0.250 mg·g-1灌胃给药;F组:高脂饲料喂养,小檗碱注射液0.375 mg·g-1灌胃给药。治疗期间A、D、E组未有大鼠死亡,B组2只大鼠死亡,C、F组1只大鼠死亡,解剖判定均系感染死亡。
2.3 糖脂代谢指标检测分别于造模后及治疗后禁食12 h采集颈动脉血,进行生化指标测定。葡萄糖氧化酶法检测FBG、TC、TG的水平;酶联免疫法(enzyme-linked immjunosorbent assay,ELISA)检测FINS、ADPN及LEP的水平,计算胰岛素抵抗指数(homeostasis model-insulin resistance,HOMA-IR)和胰岛素敏感指数(homeastasis model-insulin sensitivity,HOMA-IS)。
2.4 炎症相关指标检测采用ELISA法检测大鼠血清TNF-α、IL-6水平;采用PCR检测大鼠脾脏组织中TNF-α、IL-6的mRNA水平,具体如下:取脾脏组织切片碾碎成粉末状,加入1 mL Trizol溶液混匀,一步法获取脾脏组织总RNA,反转录获得cDNA样品。PCR反应条件设置为95℃下30 s使其变性,60℃退火,90℃下使其延伸,通过Poly core软件,对其循环数进行计算,获得TNF-α、IL-6的mRNA水平。
2.5 统计学方法采用SPSS 22.0软件进行数据分析,计量数据资料以均数±标准差(±s)的形式表示,组间比较采用LSD-t检验,P<0.05时,差异具有统计学意义。
3 结果
3.1 小檗碱对T2DM模型大鼠血糖及胰岛素指标的影响与A组比较,造模后B、C、D、E、F组大鼠FBG、HOMA-IR水平显著升高(P<0.05),FINS、HOMA-IS水平显著降低(P<0.05),提示糖尿病大鼠造模成功;与B组比较,治疗后C、D、E、F组大鼠FBG、HOMA-IR的水平显著降低(P<0.05),FINS、HOMA-IS的水平显著升高(P<0.05),提示小檗碱对血糖及胰岛素指标均有一定的调控效果;其中,F组FBG、FINS、HOMA-IR、HOMA-IS水平与D、E组比较有显著差异(P<0.05),与C组比较无显著差异(P>0.05),提示高剂量小檗碱对血糖及胰岛素调控效果优于低、中剂量,与二甲双胍效果相当。结果见表1。
表1 各组大鼠血糖及胰岛素指标比较 (±s)

表1 各组大鼠血糖及胰岛素指标比较 (±s)
注:与本组造模后比较,*P<0.05;与同期A组比较,#P<0.05;与同期B组比较,$P<0.05;与同期D、E组比较,&P<0.05
FBG(c/mmol·L-1)-1 FINS/mU·L HOMA-IR HOMA-IS组别 n造模后 治疗后A组 10 4.71±0.88 4.68±0.85 30.25±4.73 30.46±4.59 6.33±0.88 6.34±0.90 0.158±0.025 0.158±造模后 治疗后造模后 治疗后造模后 治疗后0.26 B组 8 24.86±5.41# 25.06±5.87# 13.14±2.75# 13.05±2.28# 14.52±2.41# 14.53±2.43# 0.069±0.014# 0.069±0.011#C组 9 25.03±5.64# 5.83±1.18*$&13.46±2.81# 25.78±4.83*$&14.97±2.53# 6.68±1.13*$&0.068±0.011# 0.150±0.010*$&D组 10 24.75±5.83# 8.64±1.74*#$13.29±2.64# 20.26±5.95*#$14.62±2.52# 7.78±1.18*#$0.068±0.013# 0.129±0.011*#$E组 10 25.26±6.05# 7.86±1.59*#$13.54±2.73# 22.76±6.03*#$15.20±2.47# 7.95±1.23*#$0.066±0.012# 0.126±0.012*#$F组 9 24.89±5.78# 6.03±1.28*$&13.48±2.68# 26.03±5.72*$&14.91±2.56# 6.97±1.18*$&0.067±0.012# 0.143±0.013*$&
3.2 小檗碱对T2DM模型大鼠脂代谢指标的影响
与A组比较,造模后B、C、D、E、F组大鼠血清TC、TG、LEP水平显著升高(P<0.05),ADPN水平显著降低(P<0.05),提示糖尿病大鼠造模成功;与B组比较,治疗后C、D、E、F组大鼠血清TC、TG、LEP的水平显著降低(P<0.05),ADPN水平显著升高(P<0.05),提示小檗碱对脂代谢指标有一定的调控效果;其中,F组血清TC、TG、ADPN、LEP水平与D、E组比较有显著差异(P<0.05),与C组比较无显著差异(P>0.05),提示高剂量小檗碱对血脂代谢调控效果优于低、中剂量,与二甲双胍效果相当。结果见表2。
表2 各组大鼠脂代谢指标比较 (±s)

表2 各组大鼠脂代谢指标比较 (±s)
注:与本组造模后比较,*P<0.05;与同期A组比较,#P<0.05;与同期B组比较,$P<0.05;与同期D、E组比较,&P<0.05
组别 n TC(c/mmol·L-1)TG(c/mmol·L-1)ADPN(ρ/mg·L-1)LEP(ρ/μg·L-1)造模后 治疗后A组 10 0.85±0.12 0.86±0.11 0.40±0.08 0.41±0.08造模后 治疗后造模后 治疗后造模后 治疗后7.74±1.12 7.81±1.15 1.42±0.21 1.43±0.21 B组 8 2.24±0.35#2.63±0.36# 1.53±0.24#1.82±0.28# 5.62±1.04#5.67±1.08# 1.86±0.35# 1.91±0.36#C组 9 2.20±0.31#1.51±0.27*$&1.46±0.27#0.89±0.22*$&5.76±0.95#7.62±1.05*$&1.83±0.36# 1.48±0.25*$&D组 10 2.18±0.29#1.97±0.22*#$1.52±0.27#1.25±0.24*#$5.68±1.98#6.87±1.15*#$1.85±0.34# 1.67±0.35*#$E组 10 2.27±0.33#1.84±0.23*#$1.56±0.29#1.13±0.21*$5.61±1.03#7.06±1.12*#$1.82±0.32# 1.59±0.32*#$F组 9 2.21±0.32#1.56±0.21*$&1.51±0.28#0.92±0.19*$&5.65±1.06#7.57±1.16*$&1.85±0.32# 1.50±0.33*$&
3.3 小檗碱对T2DM模型大鼠血清炎症因子的影响与A组比较,造模后B、C、D、E、F组大鼠血清TNF-α、IL-6水平显著升高(P<0.05),提示高脂加STZ诱导的糖尿病大鼠模型体内炎症反应加剧;与B组比较,治疗后C、D、E、F组大鼠血清TNF-α、IL-6水平显著降低(P<0.05),提示小檗碱对炎症反应有一定的调控效果;其中,F组血清TNF-α、IL-6的水平与D、E组比较有显著差异(P<0.05),与C组比较无显著差异(P>0.05),提示高剂量小檗碱对炎症反应的调控效果优于低、中剂量,与二甲双胍效果相当。结果见表3。
3.4 小檗碱对T2DM模型大鼠脾脏中炎症因子mRNA表达的影响与A组比较,造模后B组大鼠脾脏TNF-α、IL-6的mRNA表达水平显著升高(P<0.05);与B组比较,治疗后C、D、E、F组大鼠脾脏TNF-α、IL-6的mRNA表达水平显著降低(P<0.05);其中,F组大鼠脾脏TNF-α、IL-6的mRNA表达水平与D、E组比较有显著差异(P<0.05),与C组比较无显著差异(P>0.05),提示高剂量小檗碱对炎症反应的调控效果优于低、中剂量,与二甲双胍效果相当。结果见表4。
表3 各组大鼠血清炎症因子比较 (±s,ng·L-1)
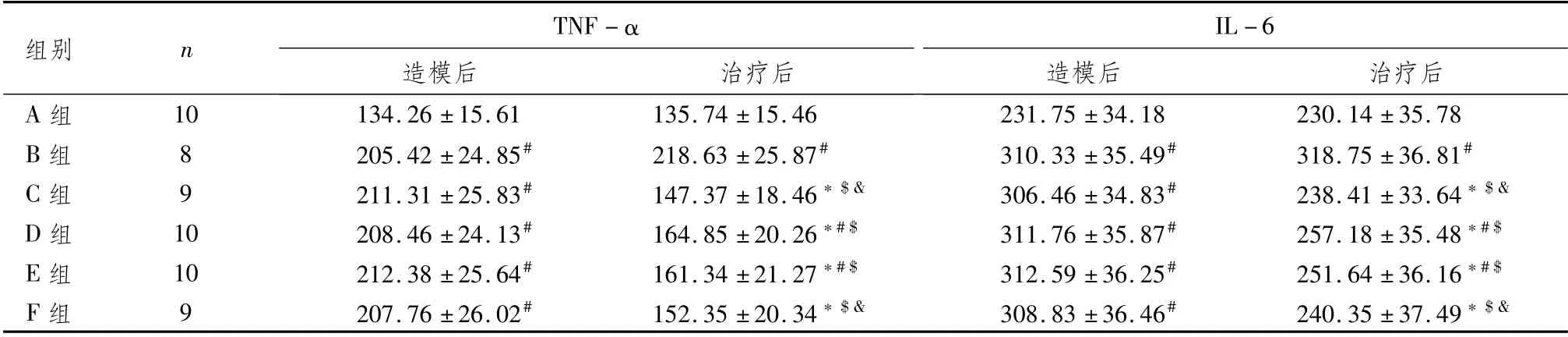
表3 各组大鼠血清炎症因子比较 (±s,ng·L-1)
注:与本组造模后比较,*P<0.05;与同期A组比较,#P<0.05;与同期B组比较,$P<0.05;与同期D、E组比较,&P<0.05
组别 n TNF-α IL-6造模后 治疗后A组 10 134.26±15.61 135.74±15.46 231.75±34.1造模后 治疗后230.14±35.78 B组 8 205.42±24.85# 218.63±25.87# 310.33±35.49# 318.75±36.81#C组 9 211.31±25.83# 147.37±18.46*$& 306.46±34.83# 238.41±33.64*$&D组 10 208.46±24.13# 164.85±20.26*#$ 311.76±35.87# 257.18±35.48*#$E组 10 212.38±25.64# 161.34±21.27*#$ 312.59±36.25# 251.64±36.16*#$F组 9 207.76±26.02# 152.35±20.34*$& 308.83±36.46# 240.35±37.49*$&8
表4 各组大鼠脾脏中炎症因子比较 (±s)

表4 各组大鼠脾脏中炎症因子比较 (±s)
注:与A组比较,#P<0.05;与B组比较,$P<0.05;与D、E组比较,&P<0.05
组别 n TNF-αmRNA IL-6 mRNA A组10 15.74±2.74 9.46±1.89 B组 8 40.68±5.03# 21.23±3.46#C组 9 18.64±3.14$& 11.75±2.21$&D组 10 27.16±3.86#$ 16.67±3.05#$E组 10 24.51±3.53#$ 13.85±2.87#$F组 9 19.13±3.23$& 12.05±2.26$&
4 讨论
T2DM在中医中属于“消渴”病的范畴,基本病机总结为阴津亏损、阴虚为本、燥热偏盛。热为始动因素,阴虚为基本病理,二者贯穿于消渴发生发展的整个过程中[10-11];临床治疗以“清热润燥、养阴生津、活血化瘀”为基本原则,再根据具体病情,补以滋阴、补肾、温阳、健脾、益气等治法。《本草纲目》记载“黄连主治消渴、尿多”,黄连属于清热药下属分类的清热燥湿药,入口极苦,具有清热燥湿、泻火解毒之功效。黄连的化学成分包括小檗碱、黄连碱、甲基黄连碱、小檗红碱等,其中小檗碱是其主要有效成分;现代药理学研究表明,小檗碱具有抗菌、抗病毒、降血糖、抗炎等作用[12]。为了阐明黄连的降糖机制,笔者采用不同剂量小檗碱治疗高脂加STZ诱导的T2DM大鼠模型,观察其对T2DM大鼠多种作用效果,进而探讨其可能的作用机制。
肥胖和先天性胰腺功能障碍是导致T2DM发生的主要诱因[13]。高脂饮食是肥胖患者的主要特点,过量的脂肪摄入会导致脂质异位堆积,阻碍正常细胞氧化代谢,降低胰岛素敏感性,加重机体糖脂代谢紊乱[14]。脂肪主要集中于肝脏和肌肉,该部位是糖脂代谢的重要部位,脂肪含量过高会启动IR[15]。高脂饮食是T2DM造模中的重要步骤,但其存在诱导效果不稳定[16],因此笔者在实验中加入了STZ,其作为一种DNA烷化剂,能作用于胰腺细胞中磷酸烟酰胺腺嘌呤二核苷酸,参与细胞辅酶的糖和脂肪的氧化作用,导致细胞辅酶糖脂代谢异常,加快胰腺细胞凋亡[17],同时STZ对胰岛β细胞的损害明显,因此高脂饮食加STZ诱导的大鼠符合人类T2DM的发病模式,符合本实验的要求。
血糖升高是T2DM最直观的体现,而胰岛素是体内唯一能够降低血糖的激素,一旦胰岛素信号通路中的任意环节出现异常,就会导致胰岛素无法正常发挥作用,导致IR的发生[18],IR发生后会增加胰岛β细胞的负担,最终导致其枯竭,引起T2DM的发生。HOMA-IR和HOMA-IS是临床评价胰岛素调控水平的常用指标。本研究通过检测血糖和胰岛素水平,计算HOMA-IR和HOMA-IS后发现,经过小檗碱治疗后,T2DM模型大鼠的FBG、HOMA-IR显著降低(P<0.05),FINS、HOMA-IS显著升高(P<0.05),其中以高剂量组效果最为显著,提示小檗碱可改善T2DM大鼠血糖及胰岛素水平。
肥胖是IR发生的常见诱因,脂代谢紊乱伴随T2DM发生和发展[19]。本研究显示,经过小檗碱治疗后,大鼠TC、TG水平显著降低,提示小檗碱具有降低高脂血症的作用。治疗后各组TC、TG水平仍高于空白对照组(P<0.05),未恢复到正常水平,其原因可能与对造模组大鼠进行高脂饮食喂养有关。肥胖时,ADPN、LEP等特异性脂肪因子和TNF-α、IL-6等非特异性炎症因子分泌异常均会引起炎症反应,阻碍胰岛素信号传导,诱发IR[20]。TNF-α、IL-6均可下调IRS-1表达,抑制胰岛素受体信号通路和葡萄糖转运,在维持糖脂代谢和内皮功能中作用明显[21]。LEP可影响葡萄糖代谢与胰岛素释放过程,同时可以调节脂肪合成与分解过程,通过负反馈机制调控生物体体质量与能量平衡[22]。肥胖时,LEP受体水平降低,负反馈机制遭到破坏,无法抑制胰岛β细胞分泌胰岛素,引起高胰岛素血症和IR。ADPN可通过提高HOMA-IS,加快葡萄糖利用和脂肪酸氧化等途径改善IR。本研究显示,经小檗碱治疗后ADPN显著升高(P<0.05),LEP显著降低(P<0.05),说明小檗碱能提高ADPN水平,降低LEP水平,提示小檗碱对脂代谢水平调控效果显著,且与剂量有关,随着剂量的增加,调控作用增强。
研究证明,慢性低度炎症状态是T2DM的重要发病机制[23],也是患者体内的常见状态,表现为血清中多种炎症细胞因子和其他组织中炎症标志物的表达升高。本研究对大鼠造模后血清TNF-α、IL-6检测发现,造模组大鼠血清TNF-α、IL-6的水平显著高于空白对照组(P<0.05),证实T2DM模型大鼠中存在炎症状态。治疗后血清TNF-α、IL-6的水平均显著降低(P<0.05),证实小檗碱对炎症因子具有调控作用。由于血清中炎症因子的表达量少,且易受到其他物质的干扰,导致检测结果的准确性受到影响。因此,笔者通过PCR对脾脏部位的炎症因子TNF-α、IL-6的mRNA水平进行测定,获得准确的相对表达量,进一步加强实验结果的准确性。研究显示,治疗后大鼠脾脏中TNF-α、IL-6的mRNA相对表达量均显著降低(P<0.05),且高剂量组调控效果最为显著。
小檗碱可降低高脂加STZ诱导的糖尿病大鼠血糖,调控胰岛素水平和脂代谢,减轻机体的炎症反应,具有一定的临床应用价值。

