黄秋葵盐胁迫下的转录组分析
练冬梅 赖正锋 姚运法 洪建基
(福建省农业科学院亚热带农业研究所,福建漳州 363005)
土壤盐渍化是影响植物生长和威胁农业生产的主要非生物胁迫之一,也是一个在世界范围内不断蔓延的问题(Campbell et al.,2015;Ozfidan-Konakci et al.,2015)。盐渍化土壤中高浓度的NaCl 在不同生理水平上影响植物生长,导致植株水分缺失、离子毒性、营养失衡和活性氧(reactive oxygen species,ROS)产生,引起蛋白质和核酸损伤,生长和产量下降,甚至导致植株死亡(Xiong et al.,2017)。植物已经进化出对不同程度盐胁迫的耐受性,例如,在盐胁迫下植物通过积累可溶性渗透保护物质如脯氨酸、多醇甜菜碱和可溶性糖进行渗透调节(Sun et al.,2017)。
黄秋葵(Abelmoschus esculentusL.)为锦葵科一年生或多年生特色保健蔬菜,主要分布于热带亚热带地区,具有生长势强、割茎再生能力强(刘勇 等,2015)、抗逆性较强(Chandra et al.,2016)等特点,适宜在轻、中度盐碱区种植,因此黄秋葵在我国沿海地区种植面积较大(刘雅辉 等,2017)。近年来,国内外学者研究了盐胁迫对黄秋葵生态特征、生理生化的影响(王永慧 等,2015,2016;Jeyapraba et al.,2016;刘雅辉 等,2017;王继玥 等,2017;Azeem et al.,2017;Guealia et al.,2017),还进行了蛋白质组分析(Yu et al.,2019;Zhan et al.,2019),但对盐胁迫下黄秋葵幼苗转录组分析鲜见报道。在高等植物盐胁迫研究中,转录组测序技术已应用于冰菜(练冬梅 等,2019)、偃麦草(卢锐和李培英,2020)、长豇豆(Pan et al.,2019)等植物中。前人研究表明,盐对植物地上部生长的抑制作用大于地下部(朱义 等,2007;谷艳芳 等,2009)。本试验以福建漳州沿海地区常年种植的黄秋葵品种助农2 号为试验材料,对400 mmol·L-1NaCl胁迫24 h后的黄秋葵地上部进行转录组分析,以期获得与耐盐性状相关的调控基因,为黄秋葵耐盐基因组学和分子生物学研究提供参考。
1 材料与方法
1.1 试验材料
试验于2019年5 月在福建省农业科学院亚热带农业研究所进行。黄秋葵(AbelmoschusesculentusL.)品种助农2 号的种子购于福建漳州种子商店。
1.2 盐胁迫处理
黄秋葵种子经10%次氯酸钠消毒10 min,蒸馏水冲洗3 次,置于恒温箱中催芽。种子露白后播于装有泥炭土∶珍珠岩∶蛭石=3V∶1V∶1V干净基质的7 cm × 7 cm × 10 cm(长×宽×高)花盆中,共播种6 盆,每盆播1 粒,置于人工气候箱中培养,发芽7 d 后开始每2 d 浇1 次1/2 Hoagland营养液,待幼苗长至三叶一心时,选择生长一致的幼苗用400 mmol·L-1NaCl 进行胁迫处理24 h,对照用清水处理24 h。
1.3 采样
分别取盐胁迫处理和对照24 h 后的黄秋葵幼苗地上部分,各3 次重复。盐胁迫处理的3 次生物学重复分别记为T01、T02、T03;对照的3 次生物学重复分别记为T04、T05、T06。迅速放入液氮速冻,存于-80 ℃超低温冰箱备用。
1.4 转录组测序和分析
采用RNAprep Pure Plant Kit 试剂盒提取黄秋葵幼苗地上部分总RNA。分别采用Nanodrop、Qubit 2.0、Aglient 2100 技术检测RNA 样品的纯度、浓度和完整性,构建cDNA 文库,再使用Q-PCR方法对文库的有效浓度进行准确定量,以保证文库质量。库检合格后,用Illumina HiSeq TM2500 进行高通量测序。运用生物信息学技术和方法对测序数据进行前期处理、序列比对、基因及基因组的注释、基因表达分析等。按照FPKM 法计算差异基因的表达量,若log2Fold change >0,则上调表达,反之,下调表达。
2 结果与分析
2.1 数据组装和分析
盐胁迫处理和对照的黄秋葵幼苗经高通量测序和质量控制,共获得70.17 Gb 有效数据(Clean data),Q30 碱基百分比均在93.21%以上(表1),表明测序结果可靠,可用于后续的分析。对组装结果进行统计(表2),共产生60 177 条单基因序列(Unigene)和342 407 条转录本序列(transcipt),N50 分别为1 569 bp 和1 870 bp,组装完整性较高;其中长度为300~500 bp 的单基因序列数量最多,为24 506 条,占40.72%,且随着长度的增加,单基因序列的数目减少。

表1 有效数据评估统计

表2 组装结果统计
2.2 单基因序列功能注释
为获得Unigene 的功能注释信息,通过COG、GO、KEGG、KOG、Pfam、Swiss-Prot、eggNOG 和NR 等8 个数据库进行注释分析(表3),在60 177 条Unigene 中,共获得38 087 条(63.29%)注释,以上8 个数据库分别获得9 879(16.42%)、22 205(36.90%)、14 417(23.96%)、20 320(33.77%)、23 009(38.24%)、25 661(42.64%)、34 294(56.99%)、37 176 条(61.78%)注释。
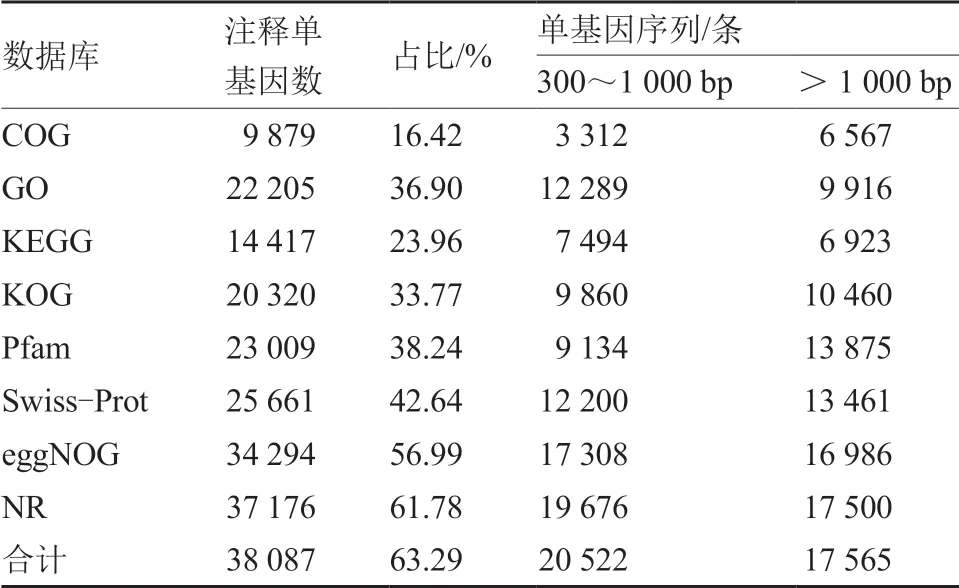
表3 单基因序列的功能注释
2.3 差异表达基因分析
通过对黄秋葵幼苗盐胁迫处理和对照24 h后地上部分差异基因的表达分析,共获得1396个差异表达基因(differential expression genes,DEGs),包括588 个上调基因,808 个下调基因,将其DEGs 单基因序列分别在8 个数据库中进行注释,共获得1 266 个基因功能注释,COG、GO、KEGG、KOG、Pfam、Swiss-Prot、eggNOG 和NR数据库分别注释405、743、421、581、918、994、1 197 个和1 263 个,其中以NR 数据库注释比率最高,达99.76%。
2.3.1 差异表达基因的GO 功能注释 黄秋葵幼苗盐胁迫处理和对照24 h 后地上部分差异基因GO功能注释的743 个DEGs 共分为3 大类,分别为生物过程、细胞组分和分子功能,又划分为43 个功能小类(图1),生物过程的DEGs 以代谢过程(43.1%)、细胞过程(35.5%)和单一生物过程(30.6%)3 个功能小类的数量最多;细胞组分的DEGs 以内膜(43.2%)、内膜组分(36.5%)、细胞(33.5%)、细胞组分(33.0%)和细胞器(21.1%)5 个功能小类的数量最多;分子功能的DEGs 以催化活性(49.7%)和结合活性(46.4%)2 个功能小类的数量最多。以上注释较多的过程涉及到的基因可能参与了黄秋葵盐胁迫响应过程,进一步挖掘这些差异表达基因有助于研究其抗逆机制。
2.3.2 差异表达基因的KOG 功能注释 对黄秋葵幼苗盐胁迫处理和对照24 h 后地上部分差异基因KOG 数据库注释的581 个DEGs 进行直系同源分类,获得24 个功能分类(图2),主要集中在一般性功能预测(23.1%)。植物生长发育过程有大量基因表达,在盐胁迫下,部分涉及到信号转导机制(13.3%),以及次生代谢产物的合成、转运和分解代谢(11.9%),翻译后修饰、蛋白质转换和伴侣(10.5%)等过程,说明这些生物学过程对于黄秋葵生命活动的重要性。
2.3.3 差异表达基因的KEGG 功能注释 KEGG分析可以从功能的角度聚焦到通路及基因,也可以从基因的角度锁定功能和互作关系,直观地显示黄秋葵在盐胁迫下差异表达基因的代谢过程和信号通路,有助于更好地研究黄秋葵响应盐胁迫的分子机制。由表4 可知,黄秋葵幼苗盐胁迫处理和对照24 h 后地上部分差异基因分别富集在421 个KEGG代谢通路,主要分为5 类:第1 类为细胞过程,涉及到1 个通路,为内吞作用;第2 类为环境信息处理,共有2 个通路,分别为植物激素信号转导和ABC 转运蛋白;第3 类为遗传信息处理,涉及到5 个通路,以内质网蛋白加工最多;第4 类为新陈代谢,共有40 个通路,最多的为淀粉和蔗糖代谢(8.9%),其次为苯丙素的生物合成(6.7%);第5类为有机系统,共有2 个通路,分别为植物病原菌互作和昼夜节律-植物。这说明盐胁迫下黄秋葵幼苗的各种代谢途径都发生了变化。
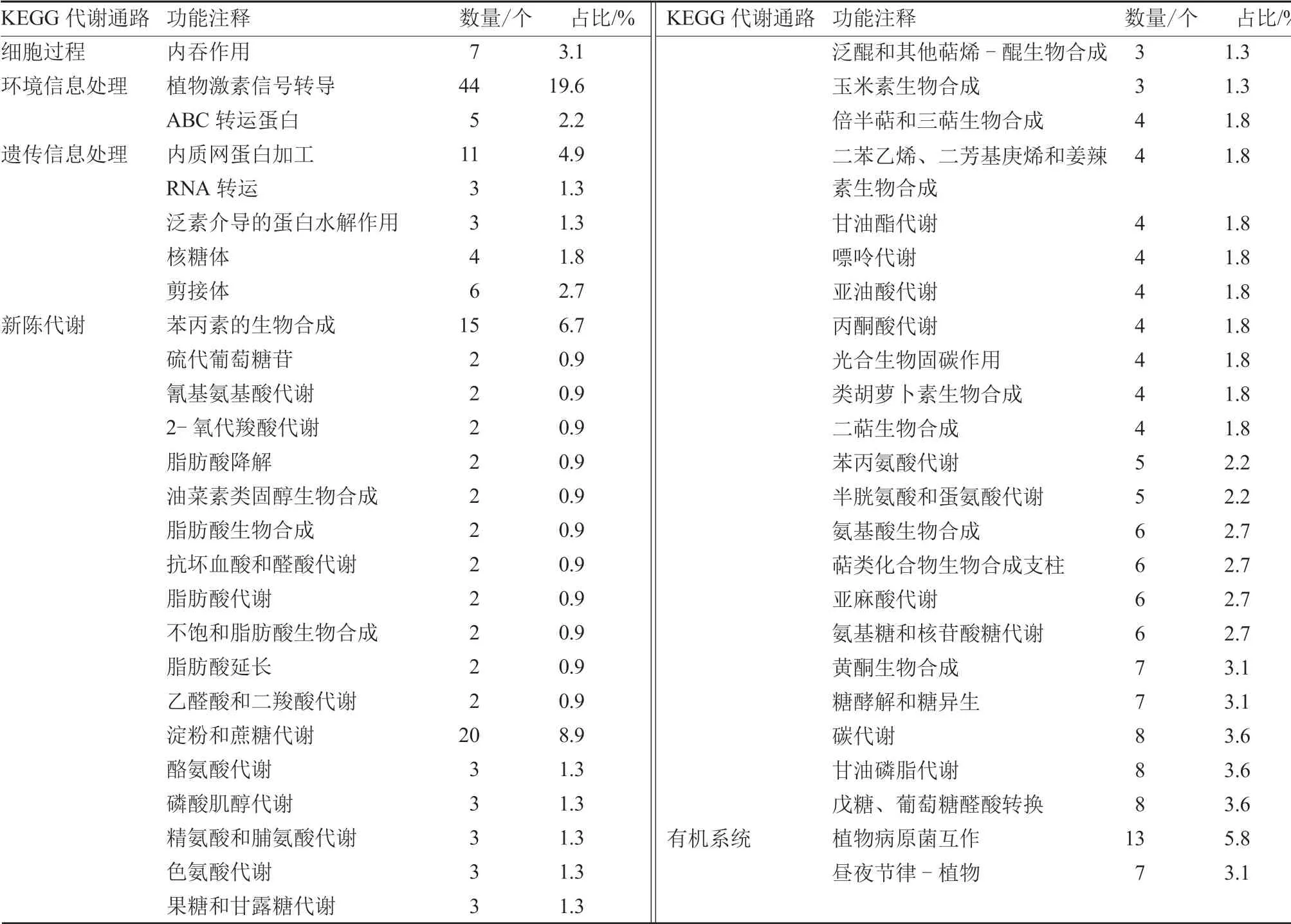
表4 差异表达基因KEGG 功能注释
2.4 关键基因差异分析
通过对黄秋葵幼苗盐胁迫处理和对照24 h 后地上部分转录组测序结果进行功能注释、功能分类及代谢途径分析表明(表5),过氧化物酶55 基因、超氧化物歧化酶基因、谷胱甘肽S-转移酶基因、4-羟基肉桂酸基因、黄酮醇合成酶基因、查尔酮合成酶基因上调表达,主要参与植物体内抗氧化及活性氧清除过程;WRKY21 转录因子基因、ERF2 转录因子基因、NAC29 转录因子基因、GATA22 转录因子基因、MYB4 转录因子基因、生长素响应蛋白基因上调表达,主要参与植物生长发育过程;海藻糖-磷酸酶基因、磷酸乙醇胺N-甲基转移酶1 基因上调表达,主要参与植物渗透调节过程。

表5 盐胁迫下黄秋葵幼苗差异基因的表达
3 讨论与结论
土壤盐分是限制植物生长的主要非生物胁迫之一,研究植物耐盐机制将有助于改进植物耐盐性。黄秋葵具有复杂的异源多倍体基因组(2n=130~140),近年来,人们开始关注黄秋葵种质的遗传改良(Zhang et al.,2018)。本试验利用Illumina HiSeq TM2500 高通量测序技术构建了黄秋葵幼苗盐胁迫处理和对照24 h 后地上部分转录组数据库,借助其他物种数据库的已有信息,对差异表达的基因进行比对分析,表明盐胁迫后黄秋葵幼苗地上部分的植物活性氧清除、植物生长发育及植物渗透调节相关功能蛋白基因的表达发生了改变。
盐胁迫导致植物体内活性氧(ROS)积累,过量的ROS 氧化植物细胞,对植物造成不可逆的伤害(Sekmen et al.,2014)。植物可能通过合成大量的ROS 清除相关的酶类和其他次生代谢物质,来降低植物受到的氧化损伤。研究表明,过氧化物酶体、黄酮、谷胱甘肽等抗氧化剂在植物体内具有抗氧化和ROS 清除能力(孙静,2006;Watkins et al.,2014;Silva et al.,2016)。盐胁迫下,黄秋葵幼苗中过氧化物酶55 基因、超氧化物歧化酶基因、谷胱甘肽S-转移酶基因、4-羟基肉桂酸基因、黄酮醇合成酶基因、查尔酮合成酶基因上调表达,有利于合成过氧化物酶、超氧化物歧化酶、谷胱甘肽和黄酮,促进黄秋葵体内ROS 清除,提高黄秋葵的盐胁迫耐受性。
植物中各类转录因子在调控植物生长发育、适应环境中起到主要作用(赵航 等,2014)。屈兴红和曾洪学(2019)研究发现,金冕草受到盐胁迫后会引起MYB 和WRKY 转录因子的强烈表达。田林等(2020)研究表明,比拉底白刺通过WRKY、ERF、NAC、GATA 转录因子调控来增加耐盐性。本试验通过转录组测序发现,黄秋葵幼苗盐胁迫处理和对照24 h 后WRKY21 转录因子基因、MYB4 转录因子基因、ERF2 转录因子基因、NAC29 转录因子基因、GATA22 转录因子基因均上调表达,有利于增强黄秋葵幼苗耐盐性,与前人研究结果一致。植物激素在盐胁迫下植物生长发育中也起到重要作用(练冬梅 等,2019)。本试验中,生长素响应蛋白基因上调表达,促进细胞分裂,加速细胞伸长生长,提高黄秋葵的盐胁迫耐受性。本试验发现的几个转录因子需要进一步挖掘其功能,以期探究黄秋葵的耐盐机理。
盐胁迫下,植物通过自身合成小分子有机溶质(糖类、甜菜碱、醇类等)维持细胞渗透势,从而减少盐胁迫损伤(黎裕,1994)。在本试验的关键差异表达基因中,海藻糖-磷酸酶基因、磷酸乙醇胺N-甲基转移酶1 基因上调表达,分别有利于合成海藻糖和甜菜碱,以提高细胞内的渗透势,从而提高黄秋葵的盐胁迫耐受性。
植物是通过一系列基因相互协调发挥作用来实现耐盐性的(Zhou et al.,2013)。黄秋葵经400 mmol·L-1盐胁迫后,在一系列关键基因共同作用下进行自我调节,能够正常生长发育,抵抗盐胁迫的危害。本试验中所筛选的抗氧化及活性氧清除相关基因、植物生长发育相关基因和渗透调节相关基因均为上调基因,证明黄秋葵能够通过增强活性氧清除、促进生长发育和渗透调节来提高盐胁迫适应能力。本试验从分子水平上研究了对应的耐盐基因及其差异表达,为筛选黄秋葵耐盐关键基因和功能验证提供重要的分子基础,同时为改善土壤盐渍化具有重要意义。

