股骨粗隆间骨折三种内侧支撑的力学分析△
鲁成军,高 旭,韩 亮,池玉磊,高 升,梁彦虎,田荣华,吴 彬,孟纯阳*
(1.青岛大学青岛医学院,山东青岛266071;2.济宁医学院附属医院骨科,山东济宁272000;3.济宁骨伤医院骨科,山东济宁272000)
股骨粗隆间骨折多见于老年人,骨折后患者因需要长期卧床,坠积性肺炎和下肢深静脉血栓发生率增加,1年内死亡率高达36%[1]。目前随着内固定材料和手术技术及康复理念的进步,手术内固定治疗已成为首选方式。对于稳定性骨折,髓内固定和髓外固定治疗均可获得满意的疗效,而对于不稳定性骨折,由于股骨内侧皮质支撑的破坏,约10%~27%的患者会发生内固定相关并发症,如内固定切出、髋内翻以及股骨颈短缩等[2,3]。骨折治疗的三大原则是复位、固定与康复治疗,其中充分可靠的骨折复位是保证一切后续治疗可能性的前提,为此张世民等[4]针对A2.1型粗隆间骨折,首次提出了内侧皮质阳性支撑复位理论,认为阳性支撑下头颈骨块经过有限的滑动能获得与股骨干的内侧皮质接触相抵,形成二次稳定,而后较多的临床研究报道以及生物力学试验进一步验证了该理论的有效性。但是目前对于A1及A3型骨折何种复位状态下的固定力学稳定性最佳,相关研究报道较少,因此本研究拟通过生物力学试验,分析三种不同类型股骨粗隆间骨折(A1.1/A2.1/A3.2)中不同内侧皮质复位支撑的稳定性差异,旨在为临床治疗提供理论依据。
1 材料与方法
1.1 试验材料
为了避免个体之间的多样性及其产生的误差,试验标本选择第4代Synbone人工股骨标准试验骨(Malans Synbone公司,瑞士),均为左侧,共36具。材料均有相同的特性和几何形状,全长337 mm,股骨头直径48 mm,颈干角135°,前倾角15°。
1.2 骨折模型建立
根据AO骨科创伤学会(AO/Orthopaedic Trauma Association,AO/OTA)股骨粗隆间骨折分型标准,建立骨折模型:切除模型骨远端干骺端部分,保留近端约27 cm,从股骨大粗隆斜行向内下40°用摆据锯断,制作内侧皮质完整的AO/OTA A1.1粗隆间骨折模型(图1a~1c);截取后内侧小粗隆骨块,制作内侧皮质缺损的AO/OTA A2.1粗隆间骨折模型(图1d~1f);自股骨小粗隆顶点为起始点,作一条垂直于股骨远端的骨折线,制作AO/OTA A3.2横形反粗隆间骨折模型(图1g~1i)。

图1 3种AO骨折分型与3种骨折支撑模式测试标本 1a:A1.1型阳性支撑 1b:A1.1型中性支撑 1c:A1.1型阴性支撑 1d:A2.1型阳性支撑 1e:A2.1型中性支撑 1f:A2.1型阴性支撑1g:A3.2型阳性支撑 1h:A3.2型中性支撑 1i:A3.2型阴性支撑
模型制作由创伤骨科高年资专科医师制作,且由同一组人员完成。另外,本研究统一将所有骨折模型中的前侧皮质解剖复位,根据头颈骨块内侧皮质与股骨干的内侧皮质的对位关系,分为阳性支撑组(上盖下),中性支撑组(解剖复位)以及阴性支撑组(下盖上),头颈骨块往内下移动一个皮质厚度(约3 mm)为阳性支撑,头颈块往外上方向移动一个皮质厚度则认为是阴性支撑。骨折模型均使用股骨近端抗旋髓内钉(proximal femoral nail anti-rotation,PFNA)髓内固定(型号:9*170 MM标准型近端髓内钉,威曼公司,中国),每组骨折模型各4具,每种骨折类型12具,共计36具。
1.3 力学检测
本研究选择天津市威曼生物材料有限公司牛顿实验室(该实验室获得中国合格评定国家认可委CNAS认可),具有相应的资质和条件。首先使用牙托粉对骨折模型进行底端包埋固定,使其在冠状面保持内收约15°。生物力学测试采用微机控制电子万能试验机(MTS公司,美国)进行载荷加载,测试前先加载至200 N持续1~2 min,使模型与生物力学测试机紧密接触,减少因弹性蠕变效应带来的误差。然后选择静态轴向压缩试验,设定加载速率为5 mm/min,压盘间距为50 mm,数据采集频率为10 Hz,由0 N逐渐轴向加载至1 500 N,记录模型在 400 N、800 N、1 200 N、1 500 N载荷下的股骨近端下沉位移值;在弹性形变阶段载荷与位移成线性正比关系,根据载荷-位移曲线斜率计算在1 500 N载荷条件下的模型轴向刚度值。
1.4 统计学方法

2 结果
2.1 AO/OTA A1骨折模型
A1骨折模型轴向载荷测试结果见表1,随载荷增加,3种支撑模式股骨近端下沉位移均显著增加(P<0.05)。在400 N、800 N、1 500 N载荷下,位移由大到小依次为:阴性支撑>阳性支撑>中性支撑,阳性支撑与中性支撑的位移均显著小于阴性支撑(P<0.05),但阳性支撑组与中性支撑组间比较差异无统计学意义(P=0.130、P=0.230、P=0.200);在 1 200 N载荷下,位移由大到小依次为:阴性支撑>中性支撑>阳性支撑,阳性支撑与中性支撑的位移均显著小于阴性支撑(P<0.05),而阳性支撑与中性支撑间的位移差异无统计学意义(P=0.636)。支撑模式间刚度由大到小依次为:中性支撑>阳性支撑>阴性支撑,其中,中性支撑与阳性支撑的刚度均显著大于阴性支撑(P<0.05),但中性支撑与阳性支撑间的差异无统计学意义(P=0.772)。
表1 A1.1型骨折3种支撑模式不同载荷下股骨近端下沉位移及刚度值(±s)与比较
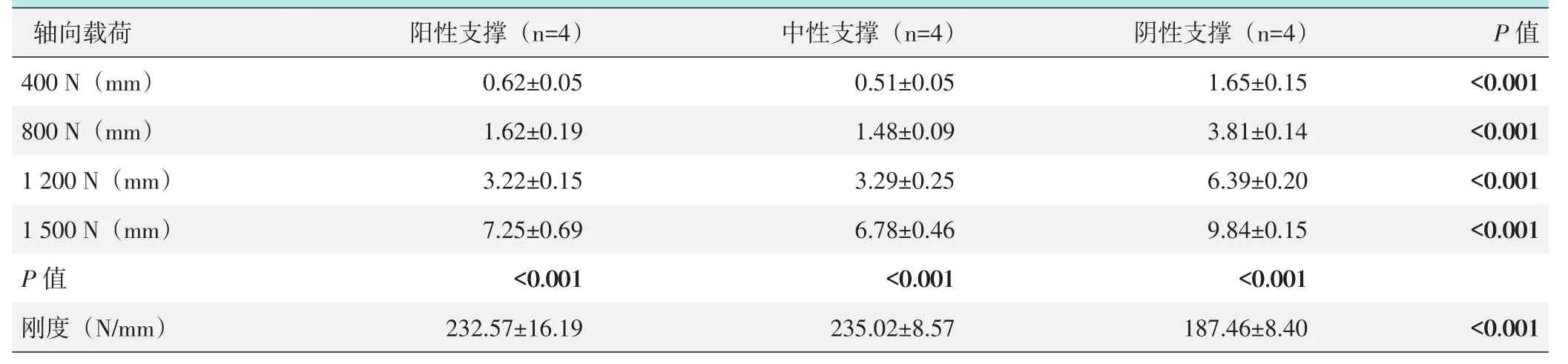
表1 A1.1型骨折3种支撑模式不同载荷下股骨近端下沉位移及刚度值(±s)与比较
轴向载荷400 N(mm)800 N(mm)1 200 N(mm)1 500 N(mm)P值刚度(N/mm)阳性支撑(n=4)0.62±0.05 1.62±0.19 3.22±0.15 7.25±0.69<0.001 232.57±16.19中性支撑(n=4)0.51±0.05 1.48±0.09 3.29±0.25 6.78±0.46<0.001 235.02±8.57阴性支撑(n=4)1.65±0.15 3.81±0.14 6.39±0.20 9.84±0.15<0.001 187.46±8.40 P值<0.001<0.001<0.001<0.001<0.001
2.2 AO/OTA A2.1骨折模型
A2.1骨折模型轴向载荷测试结果见表2,随载荷增加,3种支撑模式股骨近端下沉位移均显著增加(P<0.05)。在400 N、800 N、1 200 N和1 500 N载荷下,位移由大到小依次为:阴性支撑>中性支撑>阳性支撑,3种支撑模式间的差异均有统计学意义(P<0.05)。支撑模式间刚度由大到小依次为:阳性支撑>中性支撑>阴性支撑,3者间两两比较的差异均有统计学意义(P<0.05)。
表2 A2.1型骨折3种支撑模式不同载荷下股骨近端下沉位移及刚度值(±s)与比较
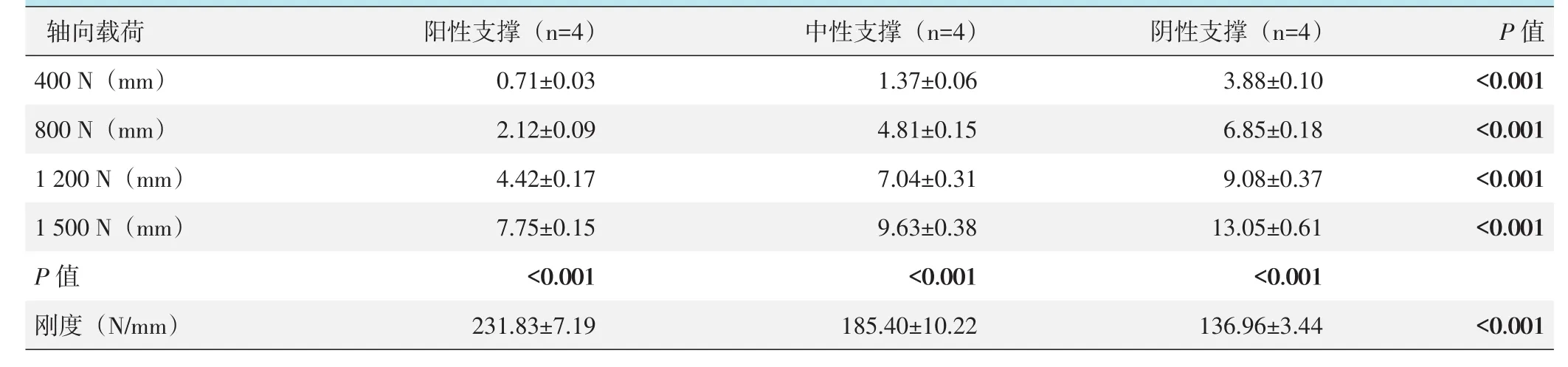
表2 A2.1型骨折3种支撑模式不同载荷下股骨近端下沉位移及刚度值(±s)与比较
轴向载荷400 N(mm)800 N(mm)1 200 N(mm)1 500 N(mm)P值刚度(N/mm)阳性支撑(n=4)0.71±0.03 2.12±0.09 4.42±0.17 7.75±0.15<0.001 231.83±7.19中性支撑(n=4)1.37±0.06 4.81±0.15 7.04±0.31 9.63±0.38<0.001 185.40±10.22阴性支撑(n=4)3.88±0.10 6.85±0.18 9.08±0.37 13.05±0.61<0.001 136.96±3.44 P值<0.001<0.001<0.001<0.001<0.001
2.3 AO/OTA A3.2骨折模型
A3.2骨折模型轴向载荷测试结果见表3,随载荷增加,3种支撑模式股骨近端下沉位移均显著增加(P<0.05)。在400 N载荷下,位移由大到小依次为:阳性支撑>阴性支撑>中性支撑,阳性与阴性支撑的位移均显著大于中性支撑(P<0.05),而阳性与阴性支撑模式间的差异无统计学意义(P=0.152)。在800 N、1 200 N、1 500 N载荷下,位移由大到小依次为:阴性支撑>阳性支撑>中性支撑,阳性与阴性支撑的位移均显著大于中性支撑(P<0.05),但阳性与阴性支撑模式间的差异无统计学意义(P=0.202、P=0.822、P=0.409)。
表3 A3.2型骨折3种支撑模式不同载荷下股骨近端下沉位移及刚度值(±s)与比较

表3 A3.2型骨折3种支撑模式不同载荷下股骨近端下沉位移及刚度值(±s)与比较
轴向载荷400 N(mm)800 N(mm)1 200 N(mm)1 500 N(mm)P值刚度(N/mm)阳性支撑(n=4)1.90±0.10 4.40±0.26 8.20±0.11 12.29±0.13<0.001 180.35±4.11中性支撑(n=4)1.04±0.16 2.19±0.13 4.58±0.26 7.67±0.33<0.001 242.92±10.42阴性支撑(n=4)1.76±0.07 4.62±0.26 8.24±0.28 12.50±0.45<0.001 170.48±6.93 P值<0.001<0.001<0.001<0.001<0.001
支撑模式间刚度由大到小依次为:中性支撑>阳性支撑>阴性支撑,中性支撑的刚度显著大于阳性与阴性支撑(P<0.05),但是,阳性与阴性支撑模式间刚度的差异无统计学意义(P=0.100)
2.4 3种骨折类型间轴向刚度比较
阳性支撑模式轴向刚度由大到小依次为,A1.1>A2.1>A3.2,A1.1和A2.1骨折模型的轴向刚度显著大于A3.2(P<0.001),但A1.1与A2.1骨折模型间轴向刚度的差异无统计学意义(P=0.923)。中性支撑模式轴向刚度由大到小依次为A3.2>A1.1>A2.1,两两比较,A3.2和A1.1骨折模型的刚度均显著大于A2.1(P<0.001),但A3.2与A1.1骨折模型间轴向刚度的差异无统计学意义(P=0.282)。阴性支撑模式轴向刚度由大到小依次为A1.1>A3.2>A2.1,两两比较差异有统计学意义(P<0.001)。
3 讨论
关于A2型骨折阳性支撑理论的有效性已经得到证实,本研究通过分析A2.1骨折模型内侧皮质不同复位状态下的生物力学差异,其研究结果与以往报道具有一致性[5,6]。但对于内侧皮质完整的A1型粗隆间骨折,相关研究较少。理论而言,在内侧骨皮质完整的情况下(A1型),相比较阳性支撑下头颈内侧皮质与股骨内侧皮质的端侧相抵,中性支撑解剖复位下的端端接触相抵应该提供更强的支撑力,但本研究发现两种复位方式下的生物力学稳定性相近,且均优于阴性支撑,提示对于股骨近端内侧皮质完整的粗隆间骨折,中性及阳性支撑均可获得良好的生物力学稳定性。然而实际手术操作过程中,通过闭合复位获取真正的解剖复位较难,中性支撑有可能包括轻微的阳性支撑及阴性支撑,在术后头颈骨块滑动得到二次稳定的过程中,残存的骨折间隙以及滑动过程中受到阻力、旋转、摆动、倾斜等因素都有可能使轻微的负性对位演变为真正的负性对位[7]。因此对于内侧皮质完整的股骨粗隆间骨折,阳性支撑更为可靠安全。
既往报道未涉及股骨反粗隆间骨折的阳性支撑理念,而本研究发现A3.2骨折模型在中性支撑下的生物力学稳定性最佳,因此笔者分析阳性支撑理念并不适用于反转子间骨折,这与其骨折本身的特殊性有直接关系。对于顺转子间骨折,研究认为内侧皮质支撑和完整的外侧壁支撑是决定骨折稳定性的重要因素[8,9],故对于反转子间骨折而言,当骨折线从股骨外侧皮质横行至内侧皮质时,其内侧支撑及外侧壁均受到破坏,其骨折稳定性更差[10]。另外研究表明骨折复位不良会导致股骨反转子间骨折内固定失败率增加[11]。郝有亮等[12]基于 Kim[13]报道的反转子间骨折复位质量评估方法,提出骨折前侧及内侧皮质移位程度均小于1个皮质厚度为复位质量好,均大于1个皮质厚度为复位质量差。基于上述观点,反转子间骨折无论阳性支撑还是阴性支撑复位,其骨折复位质量均亚于中性支撑解剖复位。另外股骨外侧壁的完整性是不稳定型股骨转子间骨折预后的重要因素,Palm等[14]研究表明股骨转子间骨折合并外侧壁骨折的内固定失败率显著升高,故阳性支撑及阴性支撑均无法恢复外侧壁的解剖对位,其固定后的生物力学稳定性也较差。综上笔者认为阳性支撑下的反转子间骨折无法形成二次稳定,随着载荷的增加,只能使骨折趋向于不稳定,所以解剖复位中性支撑是A3型反转子间骨折最为稳定可靠的复位方式,内侧皮质支撑复位理论不适用于股骨反转子间骨折。
本研究将前侧皮质复位成中性支撑,分析不同内侧皮质支撑下的稳定性差异,为三种股骨粗隆间骨折提出了合理的复位选择方式,即内侧皮质阳性支撑可视为A1和A2型粗隆间骨折的最优复位状态,而A3型反粗隆间骨折应最大程度获得解剖复位中性支撑。但是在真实手术过程中必须考虑前侧皮质支撑的重要性,因为前侧皮质中性支撑是内侧皮质阳性支撑的基础,若前侧皮质为阴性支撑,则临床中有极高的内侧皮质支撑丢失率[15]。因此为更全面的阐述不同复位状态下股骨粗隆间骨折术后固定的生物力学稳定性,该实验还需进一步的生物力学测试分析,更好的为治疗提供临床指导意义。

