补肾健骨方含药血清对ROBs和rBMSCs增殖、分化和矿化的影响
周湘琳 王冬含 施根根 赵良功 封士兰*
1.兰州大学药学院,甘肃 兰州 730000
2.兰州大学第二医院,甘肃 兰州 730000
骨质疏松症是一种由多种原因引发的骨骼退化性疾病,以骨微观结构退化、骨脆性增加为特色[1]。该病在西医治疗方面主要用药有钙剂、雌激素、降钙素、氟制剂等,均具有很大的不良反应或疗效不显著等问题[2]。随着研究不断地深入,在治疗骨质疏松方面中医药展现出一定的临床价值,并且能够有效避免西药所产生的一系列不良反应[3]。补肾健骨方是由从事中药及骨质疏松研究的权威专家拟得的经验方,在长期临床实践中发现具有疗效确定、安全性好的特点。笔者前期的研究结果表明[4],补肾健骨方能显著提高骨质疏松模型大鼠的骨密度,增强骨质疏松大鼠的骨断裂点的最大载荷和弹性模量。因此本实验以大鼠颅骨成骨细胞和骨髓间充质干细胞为研究对象,检测补肾健骨方对其增殖和成骨分化、矿化的影响,从细胞水平探讨补肾健骨方治疗骨质疏松症的作用机制。
1 材料和方法
1.1 材料
1.1.1实验动物:3月龄 SD 雌性大鼠,体质量180~220 g;2月龄 SD 雄性大鼠,体质量 120~170 g;出生48 h 以内SD 大鼠乳鼠,体质量 25~30 g;动物许可证号 SCXK(甘)2013-0002,均由兰州大学实验动物中心提供。
1.1.2试剂:胎牛血清(上海翊圣生物科技有限公司,批号:20190502);DMEM 高糖培养基(批号:B4296)、DMEM/F12(批号:B5172)培养基均购自Hyclone公司;地塞米松(批号:A5903-16)、抗坏血酸(批号:A3033-27)、β-甘油磷酸钠(批号:A5719-52)均购自索莱宝公司;ALP 试剂盒(批号:20180614)购自南京建成生物工程研究所;CD45、CD29、CD44 抗体(赛默飞世尔科技中国有限公司,批号:4226388,1937542,1974258)兔抗小鼠Ⅰ型胶原和山羊抗兔IgG-cy3抗体(武汉博斯特生物工程有限公司,批号:D397,B332)。
1.1.3仪器:Vaioskan Flash 多功能酶标仪(美国赛默飞世尔公司);Attune Nxt 流式细胞仪(赛默飞世尔科技中国有限公司)。
1.2 实验方法
1.2.1大鼠实验分组及补肾健骨方含药血清的制备[5]:3月龄雌性SD大鼠30只,随机分成无药血清对照组、补肾健骨方含药血清组、阳性药含药血清组,每组10只。补肾健骨方依据处方量(红芪∶熟地∶女贞子∶枸杞∶怀牛膝=2∶1∶1∶1∶1)称取药材,用10倍量的水煎煮3次,前两次每次1.5 h,第3次1 h,合并3次滤液浓缩至浸膏。阳性药对照组给予戊酸雌二醇,以0.2 mg/(kg·d)的剂量每日灌胃。补肾健骨方给药剂量按照体表面积的方法折算人体等效计量,以9 g/kg生药计算用药量,连续灌胃 7 d,每日灌胃 2 次,于末次给药后2 h,经眼眶静脉丛采血。所得血液静置1 h 后,3 000 r/min离心10 min,分离上层血清。为了减轻大鼠的个体差异,同组动物血清合并。56 ℃ 水浴 30 min灭活补体,0.22 μm微孔滤膜除菌,分装,-20 ℃储存备用。传统诱导组给予细胞的药物为普通胎牛血清。
1.2.2ROBs细胞的分离培养与鉴定[6]:10只SD大鼠乳鼠,无菌分离颅骨。PBS漂洗颅骨2遍,用剪刀将其剪碎为1~2 mm3。将含有碎骨片的培养瓶中加入0.25%胰蛋白酶2 mL,恒温震荡10 min于37 ℃水浴锅中,弃去消化液,共重复2次。加入1 mg/mL Ⅱ型胶原酶2 mL,恒温震荡消化15 min于37 ℃水浴锅中,共重复6次,合并最后4次的上清液。将上清液通过200目细胞筛过滤并加入含有10%胎牛血清的DMEM高糖培养基,吹打均匀。利用免疫组织化学技术对分离的成骨细胞进行鉴定。
1.2.3rBMSCs分离培养与鉴定:5只Wistar雄性大鼠被脱颈处死,无菌环境中剔出股骨和胫骨,两端骨骺被剪去,用针头从一侧切口向髓腔内滴注DMEM/F12培养液,当骨髓腔变为透明则为冲洗干净,合并冲出液,反复吹打以致细胞团块被打散[7]。200目的滤网反复过滤用来得到单细胞悬液,细胞密度调整至1.0×107个/mL。选取rBMSC细胞表面标志物CD29、CD44、CD45进行流式细胞仪分析,对rBMSC进行鉴定。
1.2.4细胞增殖实验:细胞以1×104细胞/孔接种于96孔板中。12 h后更换含不同浓度含药血清(5%、10%、15%、20%、25%)、空白对照大鼠血清以及阳性对照含药血清、胎牛血清的培养液,继续培养24、48、72 h,弃培养液,PBS洗2次。利用MTT法测试ROBs和rBMSCs增殖率。增殖率=A加药/A对照。
1.2.5细胞分化实验:24孔板中接种原代细胞,当细胞长至90%后,普通培养基更换为诱导成骨培养基(含有抗坏血酸50 mg/L,地塞米松 1×10-8mol/L和10 mmol/L β-甘油磷酸钠)[8],药物分组同上,诱导培养3、6、9 d后采用ALP试剂盒测定两种细胞的ALP活力。
1.2.6细胞矿化实验:12孔板中接种原代细胞,细胞长满后给予成骨培养基诱导,成骨性诱导分化 14 d后进行茜素红染色。拍照记录结果,Image-Pro Plus 6.0 软件处理图片。

2 结果
2.1 补肾健骨方含药血清对ROBs的作用
2.1.1ROBs的鉴定:ALP染色结果表明,成骨细胞经诱导的细胞质中存在浅棕色碱性磷酸酶颗粒,如图1A所示。茜素红染色显示,该细胞经成骨诱导后会产生橘红色或橙红色的矿化结节,如图1B所示。I型胶原免疫荧光染色结果表明,红色荧光存在于细胞质,细胞核为蓝色荧光,如图1C、1D所示。

图1 ROBs ALP、钙化结节、I型胶原免疫荧光染色(×300)Fig.1 Immunofluorescence staining was used to detect ALP, calcified nodules, and type I collagen(×300)
2.1.2补肾健骨方含药血清对ROBs增殖的影响:从图2可以看出,给药24、48、72 h后,不同浓度含药血清对ROBs 均没有细胞毒性作用,且随着含药血清浓度的增加,ROBs的增殖率也在逐渐增加。尤其当含药血清浓度为20%时,补肾健骨含药血清极大地促进了ROBs的增殖。但是当浓度增加到25%时,ROBs的增殖率表现出一个下降的趋势。
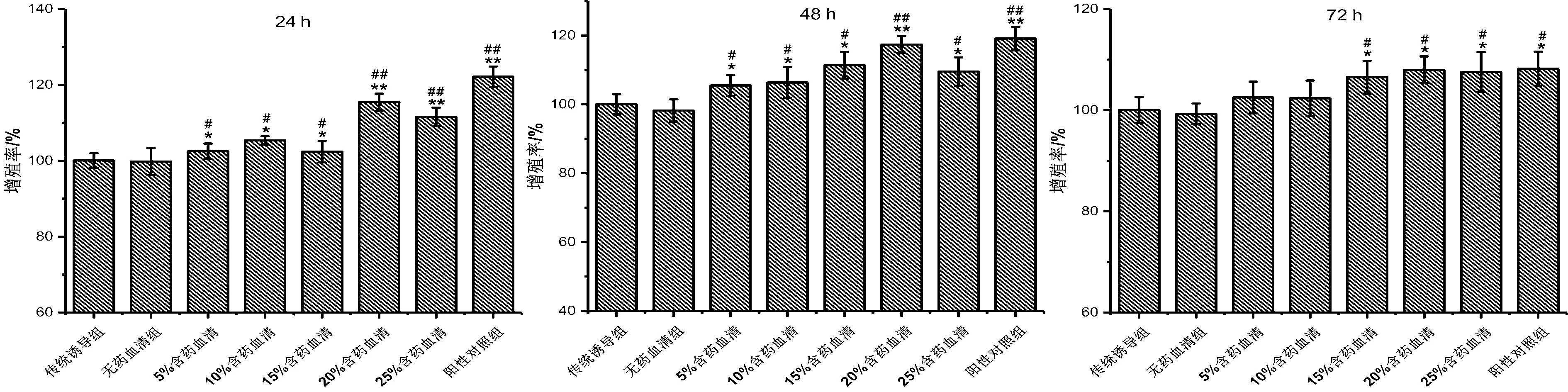
图2 不同浓度补肾健骨含药血清对ROBs增殖的影响Fig.2 Effect of different concentrations of nourishing kidney and strong bone recipe-containing serum on the proliferation of ROBs n=6)
2.1.3补肾健骨方含药血清对ROBs ALP活性的影响:成骨细胞表型分化包括两个阶段,即骨形成过程的早期阶段和后期阶段。分化的早期特征包括ALP和胶原蛋白的相对表达。从图3中可以看出,给药3、6、9 d后,各浓度含药血清均能够提高ROBs ALP 活性,并显著高于无药血清组和传统诱导组(P<0.05),其最佳浓度为20%。

图3 不同浓度补肾健骨含药血清对ROBs ALP活性的影响Fig.3 Effect of different concentrations of nourishing kidney and strong bone recipe-containing serum on ALP activity of ROBs
2.1.4补肾健骨方含药血清对ROBs钙化结节形成的影响:细胞内所含钙盐能够被茜素红所识别,给药后ROBs产生的钙化结节的数量和面积均极显著高于无药血清组和传统诱导组,20%的浓度对ROBs的钙化结节形成促进作用最强。见图4。

图4 不同浓度补肾健骨含药血清对ROBs钙化结节形成的影响Fig.4 Effect of different concentrations of nourishing kidney and strong bone recipe-containing serum on calcified nodules activity of ROBs
2.2 补肾健骨方含药血清对rBMSCs的作用
2.2.1rBMSCs的鉴定:流式细胞仪结果显示,rBMSCs经培养后能够均一表达CD29、CD44,阳性率分别为99.52%、99.31%;而CD45的阳性率为0.113%。见图5。

图5 rBMSCs表面标志物CD29、CD44、CD45的表达Fig.5 Expression of surface markers CD29, CD44, and CD45 in rBMSCs
2.2.2补肾健骨方含药血清对rBMSCs增殖的影响:给药 24、48、72 h后,不同浓度的补肾健骨含药血清对rBMSCs没有细胞毒性作用。补肾健骨含药血清浓度在10%时促进rBMSCs的增殖效果是最显著的。浓度继续增加,增殖率呈现出下降趋势,说明对于rBMSCs,10%含药血清为最佳给药浓度。见图6。
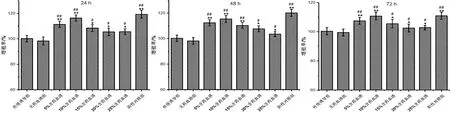
图6 不同浓度补肾健骨含药血清对rBMSCs增殖的影响Fig.6 Effect of different concentrations of nourishing kidney and strong bone recipe-containing serum on the proliferation of rBMSCs
2.2.3补肾健骨方含药血清对rBMSCs ALP活性的影响:rBMSCs经成骨性诱导3 d后,仅5%和10%含药血清组的ALP活性显著高于相应的无药血清组和传统对照组,其中10%含药血清组的ALP活性最高。给药6 d后,除25%含药血清组外,其余各组的ALP活性均显著高于相应的无药血清组。给药9 d后,不同浓度的含药血清均能提高rBMSCs ALP活性,并显著高于无药血清组和传统诱导组,其中以10%含药血清为最佳浓度。见图7。
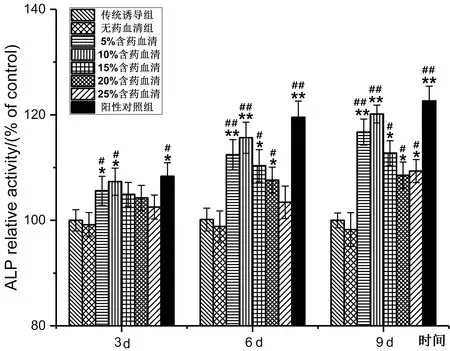
图7 不同浓度补肾健骨含药血清对rBMSCs ALP活性的影响Fig.7 Effect of different concentrations of nourishing kidney and strong bone recipe-containing serum on ALP activity of rBMSCs
2.2.4补肾健骨方含药血清对rBMSCs钙化结节形成的影响:给药14 d后的钙化结节染色结果与ALP活性检测结果具有相似的趋势。rBMSCs被不同浓度含药血清作用后,其产生的钙化结节的数量和面积均极显著高于无药血清组和传统诱导组,10%含药血清组对rBMSCs的钙化结节形成促进作用最强。见图8。

图8 不同浓度补肾健骨含药血清对rBMSCs钙化结节形成的影响Fig.8 Effect of different concentrations of nourishing kidney and strong bone recipe-containing serum on calcified nodules activity of rBMSCs
3 讨论
中医将绝经后骨质疏松症主要病因归属于骨痿、腰痛、骨痹等证[9]。补肾健骨方是由长期从事中药及骨质疏松研究的权威专家基于中医理论拟得的经验方,由红芪、熟地、女贞子、枸杞、怀牛膝组成,具有滋补肝肾、补肾壮骨、益精填髓之功效,标本兼顾[10],能有效缓解骨质疏松症状,已在临床上被广泛应用。
实验结果显示,20%的补肾健骨方含药血清更利于ROBs的生长增殖、分化矿化,10%的补肾健骨方含药血清最利于rBMSCs生长增殖、分化矿化。本研究证实了补肾健骨含药血清在体外能促进ROBs和rBMSCs的增殖、骨形成和矿化能力。
王艳等[11]发现牛膝通过降低尿羟脯氨酸/肌酐值含量来改善大鼠骨密度及骨生物力学性能。枸杞多糖含药血清通过激活β-catenin和Wnt10b等Wnt信号通路来改善BMSCs的成骨活性和矿化能力[12]。女贞子水提物能减少去卵巢诱发的大鼠股骨骨小梁形态破坏和BMD的降低[13]。林日阳等[14]发现熟地鳖甲含药血清可以通过提高成骨细胞增殖、ALP含量及cbfa1 mRNA的表达。陈宇等[15]发现红芪抗骨质疏松作用与其所含各种成分共同作用相关。因此,推测补肾健骨方含药血清对ROBs和rBMSCs的增殖、骨形成和矿化促进作用,与其单味药材治疗骨质疏松的作用有关。
总而言之,不同浓度的补肾健骨方含药血清对ROBs和rBMSCs的增殖、骨形成和矿化均具有一定的促进作用,其原因可能为此方剂在促进成骨细胞增殖的同时还能促进破骨细胞的凋亡,从而达到对骨质疏松进行治疗的目的。但本研究的药理作用为动物细胞体外培养实验的直接结果,关于补肾健骨方含药血清进一步作用于人体的效果还需深入探讨。

