二烯丙基二硫化物对MDCC-MSB-1细胞凋亡的影响
张佩琪,周鹏飞,叶正钦,刘进辉,王宜平,纪春晓
(湖南农业大学 动物医学院 湖南省兽药工程技术研究中心,湖南 长沙410000)
鸡马立克病(Marek's disease,MD)一直都是影响家禽健康的主要疾病,该疾病的严重程度不同,范围从慢性周围神经病变(以脱髓鞘和瘫痪为特征)到急性癌症,其中存在多个内脏淋巴瘤,是世界范围内家禽经济上最广泛的重要疾病之一[1]。20世纪60年代后期以来,规模化的家禽生产系统依赖于疫苗来控制疾病,但随着马立克病病毒(Marek's disease virus,MDV)毒力持续进化并出现更具毒力的致病型,使现有的疫苗保护力不足[2-3]。MDV感染鸡后会形成快速发病的淋巴瘤,导致鸡群病死率显著上升[4],所以在研发MDV新型疫苗的基础上,寻找有效的抗淋巴瘤药物也是降低养殖场经济损失和提高综合防控能力的途径。MDCC-MSB-1 细胞作为 MDV 诱导产生的淋巴瘤细胞系,当接种到易感鸡中时还可以诱导肿瘤,是广泛应用的抗 MD 肿瘤药物研究模型[5]。
大蒜(Alliumsativum)中的烯丙基硫化合物具有预防和/或控制癌症的生物效应,其中二烯丙基二硫化物(DADS)占大蒜油中脂溶性硫化物总量的40%~60%,具有更稳定的理化性质,且与水溶性烯丙基硫化物相比,脂溶性硫化物是一种更有效的抗肿瘤细胞增殖剂[6]。目前已有研究发现,DADS通过Bax触发的线粒体途径在人癌细胞中引起胱天蛋白酶依赖性细胞凋亡[7],LU等[8]也发现DADS可以激活线粒体途径诱导T24细胞凋亡。此外,据报道,DADS通过mTOR途径诱导K562和NB4髓样白血病细胞系的凋亡和自噬,Fas/FasL途径的激活可能在DADS诱导的K562细胞凋亡中起重要作用[9-10]。
1 材料与方法
1.1 细胞、培养基及主要试剂MDCC-MSB-1细胞株购自哈尔滨兽医研究所。DADS购自Alfa Aesar(纯度为80%)。胎牛血清、RPMI 1640培养基、青霉素和链霉素、CCK-8溶液、吖啶橙、JC-1染色试剂盒(恩樾生物科技有限公司)。Aneexin V-FITC/PI细胞凋亡检测试剂盒(凯基生物有限公司)。HRP标记山羊抗兔,Anti-P53 antibody(Servicebio)。cDNA反转录试剂盒、Q-PCR试剂盒(北京全式金生物技术有限公司)。其他试剂皆为国产分析纯。
1.2 MDCC-MSB-1细胞培养在含10%胎牛血清、1%双抗(100 U/mL青霉素和链霉素)和2 mmol/LL-谷氨酰胺的RPMI-1640完全培养液中,于37℃、5%CO2的饱和湿度细胞培养箱中培养,2~3 d传代1次,1 000 r/min离心5 min得到细胞沉淀。
1.3 药物准备与处理DADS和Tween-80以1∶2的比例配制成母液,母液的浓度为18 230 μmol/L,用0.9%无菌生理盐水稀释后-20℃保存备用。DADS作用于对数生长期的MDCC-MSB-1细胞,使药物终浓度为0,50,100,150 μmol/L,培养24 h后收集细胞。
1.4 AO染色观察细胞凋亡形态变化用RPMI1640培养基调整细胞浓度为6×105个/孔,接种于12孔板,DADS处理24 h后收集细胞,PBS洗涤,计数并调节细胞浓度至 106个/mL,取适量的细胞悬液,加入吖啶橙(acridine orange stain,AO),使AO终质量浓度为 8.5~17.0 mg/L,轻轻混匀,室温避光染色15~20 min,滴加于载玻片上并加盖玻片,荧光显微镜下观察。
1.5 Annexin V-FITC/PI双染检测细胞凋亡率DADS处理MDCC-MSB-1细胞24 h后,收集细胞,用PBS洗涤细胞2次,2 000 r/min离心5 min,500 μL 预冷的Binding Buffer悬浮细胞,加入13 μL Annexin V-FITC混匀后加入13 μL PI再次混匀,室温避光反应15 min。2 h内用流式细胞仪进行检测。
1.6 JC-1染色法检测线粒体膜电位的变化取对数生长期的MDCC-MSB-1细胞,用RPMI1640培养基调整细胞浓度为3×106个/mL,接种于6孔板,设置阴性对照和阳性对照。阴性对照:收集细胞后直接重悬于JC-1染色缓冲液。阳性对照:用10 μmol/L CCCP处理细胞20 min后,离心收集细胞后加入JC-1染色工作液,颠倒数次混匀并在37℃孵育20 min,染色完成后4℃ 600×g离心4 min,收集细胞用JC-1染色缓冲液洗涤2次,最后重悬于JC-1染色缓冲液。
1.7 Western blot检测P53蛋白表达用Bradford法进行蛋白定量,总蛋白经变性、电泳、转膜后,将转好的膜于室温下摇床上用5%脱脂牛奶(0.5% TBST配制)封闭1 h。按比例稀释一抗(P53兔抗),4℃孵育过夜,二抗(山羊抗兔)用TBST稀释3 000倍,室温下孵育1 h。ECL显影试剂溶液与膜充分反应1~2 min后开始曝光。将曝光胶片进行扫描存档,PhotoShop整理去色,Alpha软件处理系统分析目标带的光密度值。
1.8 Caspase-3和Caspase-9活性检测用反应缓冲液梯度稀释10 mmol/LpNA标准品,测定405 nm吸光度D值,以D值为横轴,对应的pNA浓度为纵轴制作标准曲线。根据活性测定说明书设置反应体系,Caspase-3特异水解的多肽底物为DEVD-pNA,Caspase-9特异水解的多肽底物为IETD-pNA。盖紧96孔板并用封口膜密封,在37℃培养箱中培养2 h,观察肉眼可见颜色变黄时的D405值为0.2,此时可上酶标仪检测,根据公式计算Caspase活性增加的百分比。Caspase活性增加的百分比= 样品试验组/对照组×100%。
1.9 Q-PCR检测Caspase-3和Caspase-9 mRNA表达水平根据GenBank中鸡β-actin(L08165)、Caspase-3(NM20475.1)和Caspase-9(AY057940.1)的基因序列,应用Primer 5软件设计引物(表1),引物由擎科生物有限公司合成。用TRIzol法提取总RNA,根据说明书逆转录成cDNA,反应体系为20 μL:1 μL cDNA,内参上、下引物各1 μL,10 μL 2×taq mix,剩下的用ddH2O补足。Q-PCR扩增条件:94℃ 30 s;94℃ 5 s,60℃ 30s,共30个循环。

表1 Caspase-3、Caspase-9以及内参引物序列
2 结果
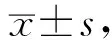
2.1 DADS诱导MDCC-MSB-1细胞发生凋亡的形态观察AO染色观察DADS作用MDCC-MSB-1细胞24 h后细胞的凋亡形态变化(图1)。空白组细胞质均染呈绿色,胞浆丰富,细胞界限清晰,随着DADS浓度的升高,细胞胞质内碎片增多,呈颗粒状。
A.0 μmol/L;B.50 μmol/L;C.100 μmol/L;D.150 μmol/L
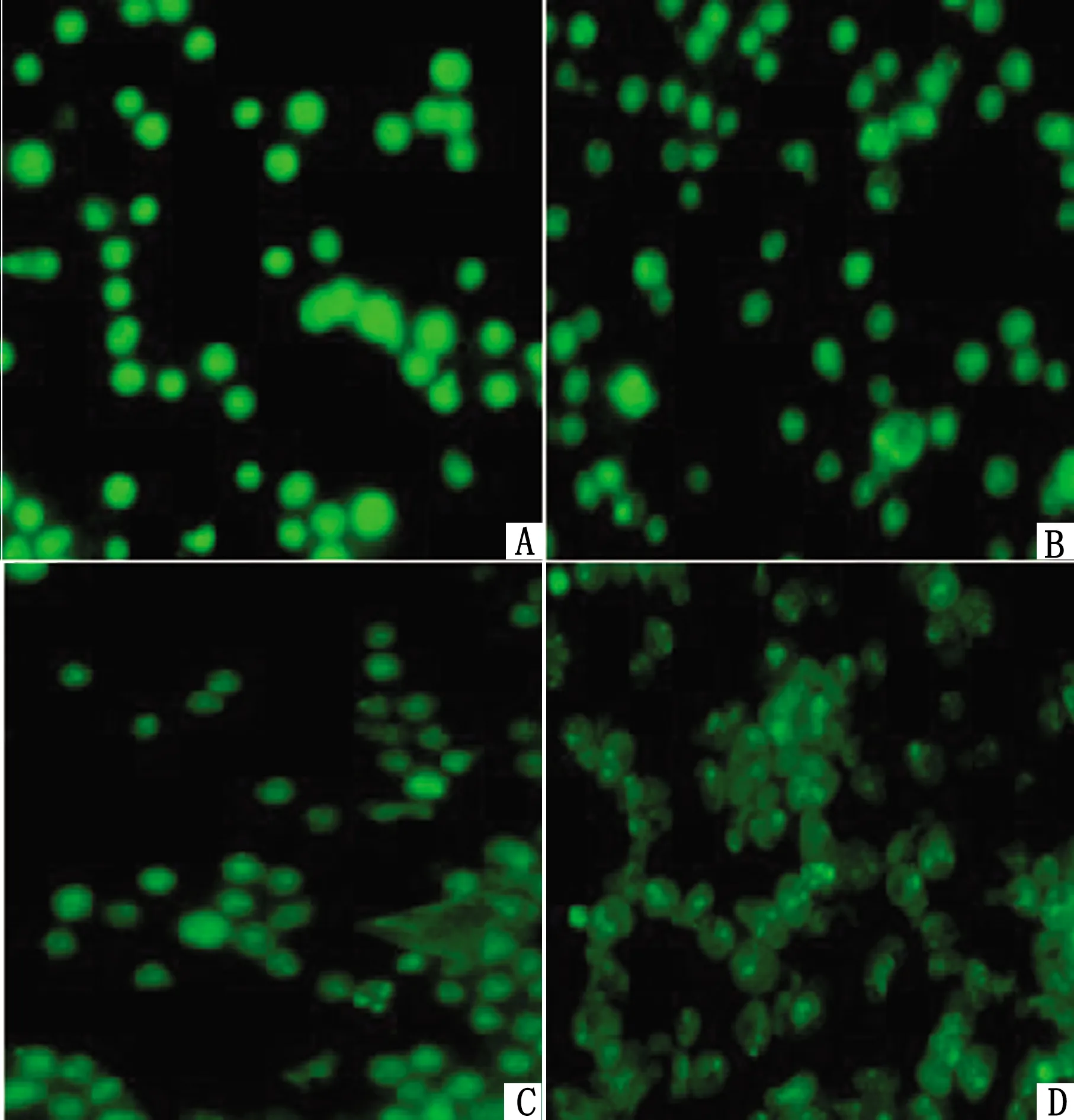
2.2 DADS诱导MDCC-MSB-1细胞凋亡加剧DADS作用MDCC-MSB-1细胞24 h后对细胞凋亡的影响见图2。随着DADS浓度的升高,(annexin V-FITC)+/PI+区域和(annexin V-FITC)+/PI-区域的荧光信号越来越强,细胞凋亡率呈剂量依赖性增多。
A.0 μmol/L;B.50 μmol/L;C.100 μmol/L;D.150 μmol/L。A~D.流式细胞图;E.柱状图。*示P<0.05, **示P<0.01。下同
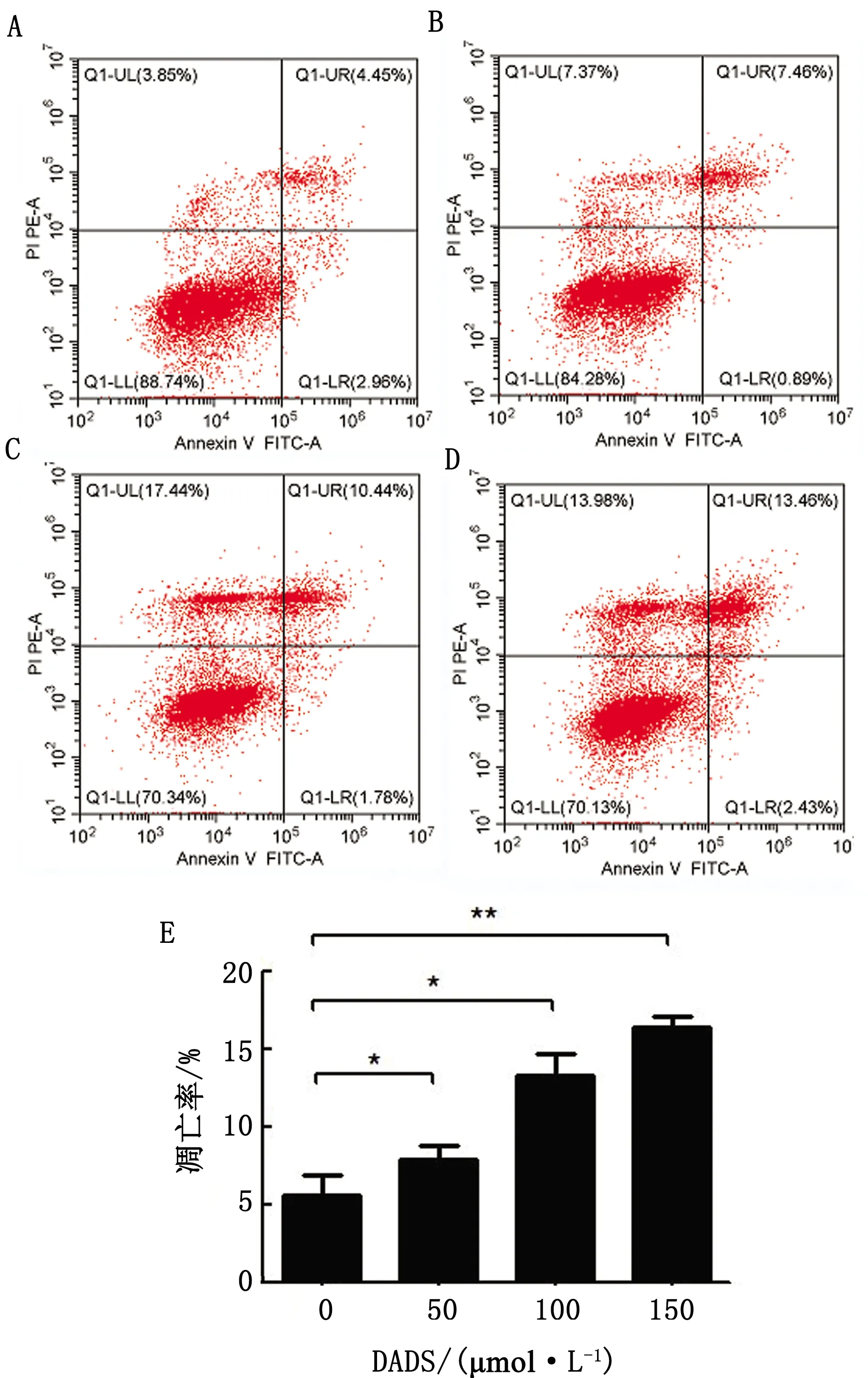
2.3 DADS诱导MDCC-MSB-1细胞线粒体膜电位下降JC-1通过正常细胞(0 μmol/L)的线粒体膜极性进入线粒体内,并因浓度升高而形成发射红色荧光的多聚体,主要集中在P2象限,随着DADS浓度的升高,线粒体跨膜电位去极化,JC-1从线粒体内释放,浓度降低,逆转为发射绿色荧光的单体形式,从红色向绿色进发(P2转向P4象限)(图3)。
A.0 μmol/L;B.50 μmol/L;C.100 μmol/L;D.150 μmol/L
2.4 DADS诱导MDCC-MSB-1细胞P53凋亡蛋白表达增多P53是重要的肿瘤抑制基因,参与细胞凋亡的进程。DADS在作用MDCC-MSB-1细胞24 h 后可诱导P53蛋白表达水平的增多(图4)。
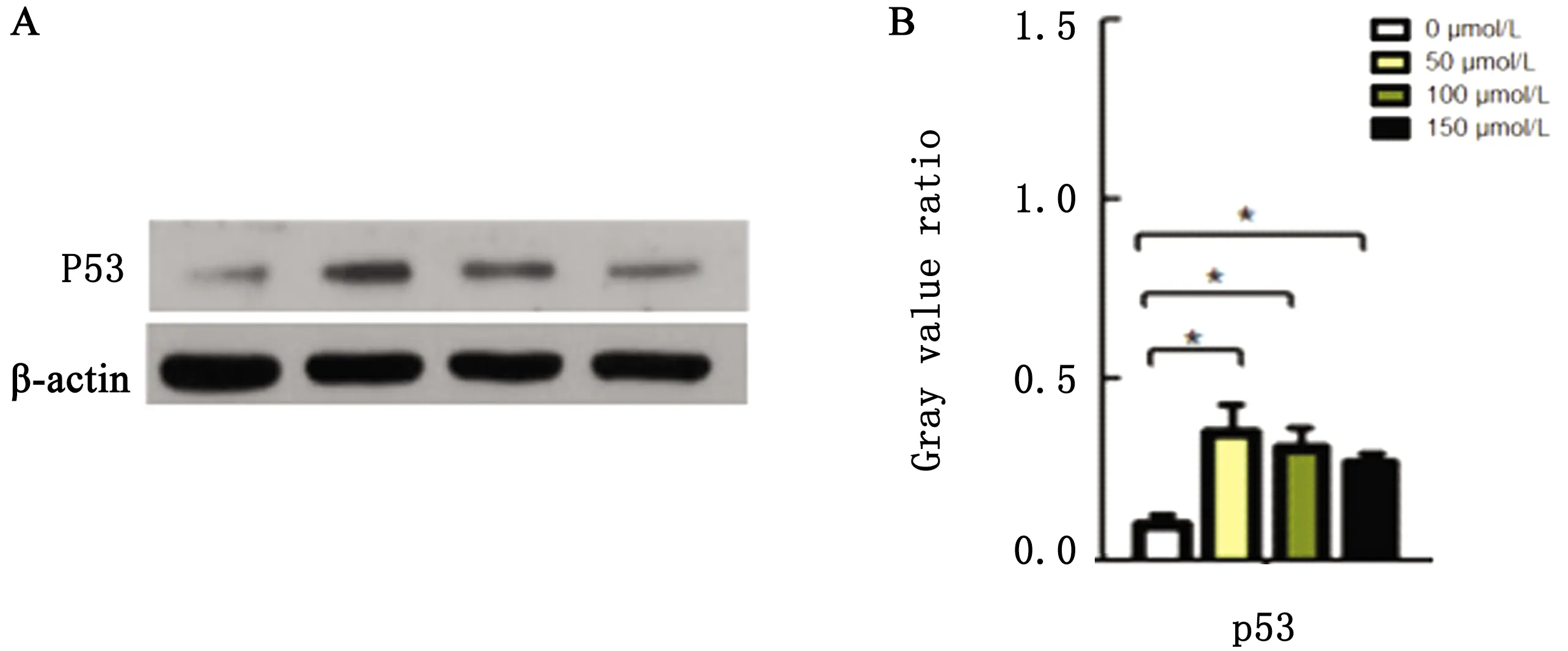
A.印迹图;B.柱状图
2.5 DADS诱导细胞Caspase-3和Caspase-9活性增强DADS作用MDCC-MSB-1细胞24 h后Caspase-3和Caspase-9的活性百分比呈极显著性增高(P<0.01)(图5),Caspase-9上调幅度更大,可能是因为激活Caspase-9的上游调控因子更为广泛,除线粒体凋亡途径外可能还受到内质网应激等通路的影响。
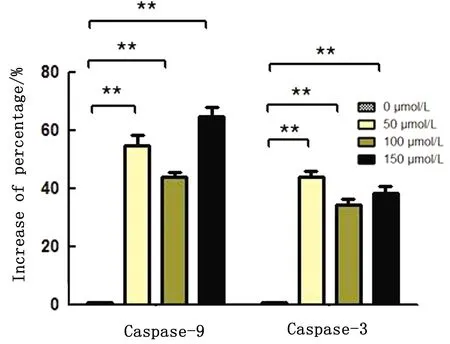
图5 DADS作用MDCC-MSB-1细胞24 h后Caspase-9、Caspase-3蛋白活性增加百分比变化
2.6 DADS上调细胞Caspase-3和Caspase-9 mRNA 表达水平所有3种浓度的DADS均诱导MDCC-MSB-1细胞中Caspase-3和Caspase-9 mRNA的相对表达增加,且Caspase-9 mRNA相对表达量的变化呈剂量依赖性(图6)。
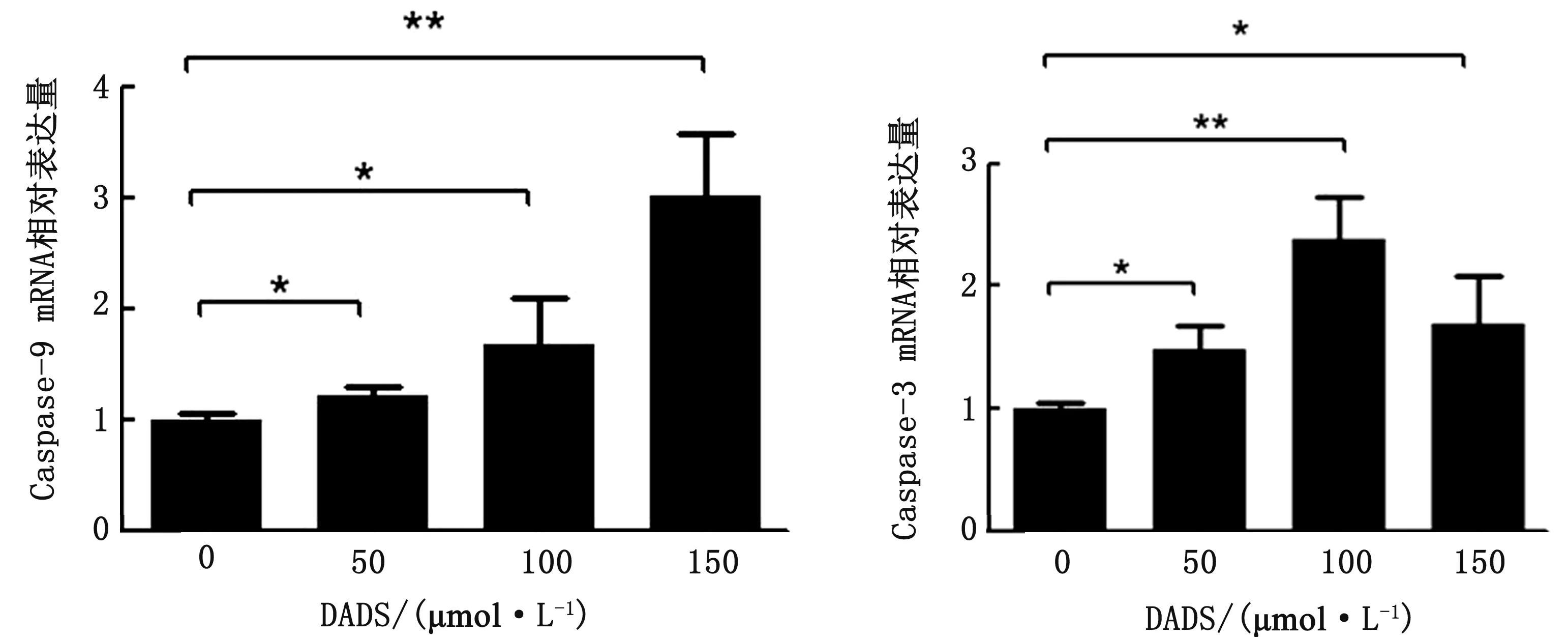
图6 DADS诱导MDCC-MSB-1细胞Caspase-9(左)和Caspase-3(右)mRNA的相对表达量的变化
3 讨论
MDV在长期的潜伏阶段躲避了免疫系统的攻击,入侵淋巴细胞后将其转化为肿瘤细胞,引发免疫抑制和继发性感染,导致鸡群较高的发病率和病死率[11-12]。DADS作为广泛的肿瘤抑制剂,对MD的治疗还少见报道。我们前期的试验发现,DADS可以诱导MDCC-MSB-1细胞活力的降低,并引起细胞周期阻滞(未发表结果),同时也发现DADS具有抑制MDV在鸡体内的复制作用[13],说明DADS可能是抗马立克病的候选药物,有继续研究的价值。
细胞凋亡是生物体内清除肿瘤细胞,遏制肿瘤形成和发展的重要机制。线粒体通过氧化磷酸化提供细胞所需的能量,细胞对线粒体的依赖也成为细胞的致命弱点,称为细胞凋亡重要生物过程的主要调节点[14],且线粒体在 MDV 诱导的细胞转化和随后的淋巴瘤形成(如鸡的 MD 发育)中不可或缺[15]。p53 是重要的肿瘤抑制基因,能调控细胞凋亡和细胞周期,有研究发现 MDV 编码的主要致瘤因子 meq 蛋白通过与宿主细胞中 p53 和 p21 蛋白相互作用来影响致瘤过程[16],Meq 的外源表达能抑制 p53 介导的转录活性和细胞凋亡[17],所以增强 p53 诱导肿瘤细胞凋亡的能力显得尤其重要。在凋亡细胞中,被激活的 p53 会快速移位到线粒体外膜并与膜上的 Bcl2 家族成员结合,增加膜的通透性,使线粒体内的促凋亡蛋白(细胞色素 c)释放进入胞浆,激活 Caspase 家族启动序列性酶解死亡程序导致 DNA 降解[18]。本试验在DADS 处理的 MDCC-MSB-1 细胞中也检测到 p53 蛋白的表达增多,线粒体膜电位的丧失,以及 Caspase-9 和 Caspase-3 基因的转录水平和蛋白活性的上调。因此,推测 DADS 通过 p53 介导的线粒体内源性凋亡途径来促进 MDCC-MSB-1 细胞的凋亡,但是否同时存在别的凋亡通路还需进一步证实。

