大蒜素衍生物烯丙基半胱氨酸壳寡糖亚微球的制备及其理化性质、体外释药特点和质量稳定性的考察
刘旭
(沈阳市红十字会医院,辽宁 沈阳 110013)
大蒜素衍生物烯丙基半胱氨酸(SAC)是一种含硫氨基酸,YEH等[1]认为SAC能抑制肝细胞中胆固醇的合成而具有降低血浆胆固醇的作用。体内和体外实验表明SAC具有抗肿瘤的作用[2]。此外,SAC具有清除自由基和抗氧化的作用[3]。壳聚糖(chitosan,CS)由于具有良好的生物相容性、生物降解性广泛用作药物载体[4],用于药物的缓释或控释,促进药物的吸收[5-6],但其分子量大,只能溶解于酸性水溶液,在生理pH下无法溶解[7-8]。消化道内水解糖苷的壳聚糖酶[9]缺乏,也导致其在体内吸收困难。壳寡糖又名壳聚寡糖,学名β-1,4-寡糖-葡萄糖胺,是壳聚糖经特殊的生物酶技术处理得到的全新产品,具有水溶性好、生物活性高、分子量低的特点,在一定程度上提高了其在生理条件下的溶解度[10-11]。壳寡糖因含有游离氨基,能结合氢离子带正电荷,其氨基亦能与芳香醛或脂肪醛反应生成希夫碱,交联产物不易溶解,溶胀小,性质稳定。壳寡糖具有生物粘附性,可完全吸收,生物相容性好,被多种酶类降解,降解产物安全无毒。烯丙基半胱氨酸由于极性较大,水溶性较大,在体内溶出快、吸收快、消除快,疗效维持时间较短,须多次给药维持体内有效血药浓度。本文利用无不良反应的三聚磷酸钠(TPP)对壳寡糖进行离子诱导凝胶化形成纳米粒[12]。在室温搅拌下,将TPP溶液滴加到壳寡糖水溶液中,通过带负电的磷酸根离子与壳寡糖分子链上带正电的质子化氨基发生分子内、间交联凝胶化,可迅速生成纳米粒。离子凝胶化法反应条件温和,易于调控反应结果,具有较高的包封率并能很好保持药物的生物活性[13]。
1 SAC壳寡糖亚微球的制备
1.1溶液的配置 将壳寡糖分散于蒸馏水溶液中,隔夜溶胀,5000 r/min离心除去不溶物质,配成10.0 mg/mL的壳寡糖贮备溶液。TPP溶于蒸馏水配成1.0 mg/mL的TPP贮备液溶液,分别经0.45 μm微孔滤膜滤过备用。
1.2亚微球制备过程 取2.5 mg/mL的壳寡糖溶液2 mL,置10 mL的西林瓶中。以1 mL注射器精密吸取适量体积的TPP含药溶液。在高速磁力搅拌下,以一定速度用注射器缓慢加入壳寡糖溶液中,搅拌30 min,即得SAC壳寡糖亚微球溶液。
2SAC壳寡糖亚微球处方研究 选择以壳寡糖(CS)浓度、SAC浓度、CS与TPP的质量比,反应溶液的pH值作为考察对象,以包封率和粒径为考察指标,筛选合适的处方。
2.1CS与TPP质量比的影响 固定CS浓度为2.5mg·mL-1,TPP浓度增加,成球越来越容易,TPP浓度增加到一定程度即生成沉淀,壳寡糖与TPP交联到一起形成较大直径的颗粒。用硫酸钠络合法和用戊二醛共价交联法制备壳寡糖亚微球(CS-SM),均是在特定浓度范围内,一定的质量比才生成亚微球[14-15]。
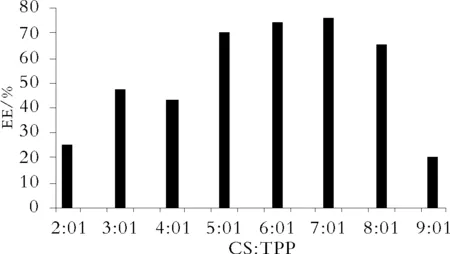
Fig.1 Influence of CS and TPP ratios on the EE(%)of CS-SM
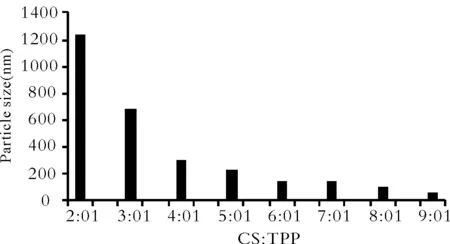
Fig.2 Influence of CS and TPP ratios on the mean particle size(nm)of CS-SM
由结果可知,当CS∶TPP在5∶1至7∶1时,可以形成粒径较小及包封率较高的壳寡糖亚微球,7∶1时包封率达到75%以上。包封率与CS与TPP的比值有显著的相关性,在一定范围内,随着比值的增大而增大,达到一定值时包封率下降。粒径随着CS与TPP的比值减小而增大,当增大至一定程度时,会形成沉淀。根据溶液的粒径分布情况以及包封率,确定CS∶TPP的质量比为7∶1。
2.2CS与TPP浓度的影响 CS浓度对亚微球的包封率与粒径影响较大。固定CS和TPP二者的质量比为7∶1,改变CS和TPP的浓度,试验中发现亚微球只在特定的CS和TPP浓度范围内形成[16]。两者浓度过低时,溶液呈清亮而无胶粒生成;两者浓度过高时,会生成较大粒径的聚集体,经放置后易沉淀。最终确定CS的浓度为2.5 mg·mL-1,此时包封率可达75%以上,粒径为149 nm。
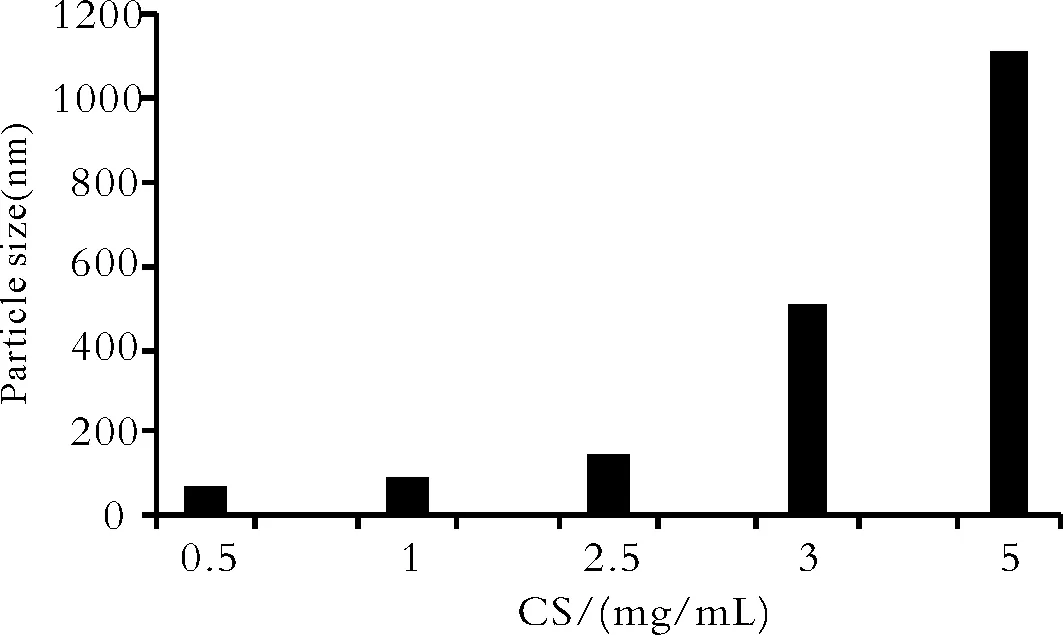
Fig.3 The effect of different concentration of CS on particle size(nm)of SPRC SM
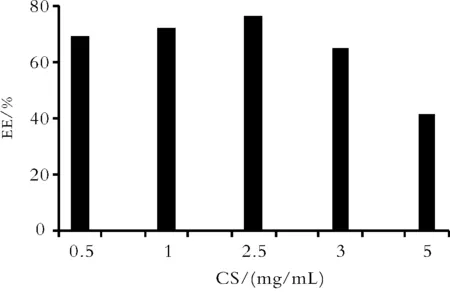
Fig.4 The effect of different concentration of CS on EE(%)of SPRC SM
2.3pH值的影响 配制浓度为2.5 mg·mL-1的壳寡糖溶液,CS/TPP质量比为7∶1,反应结束后以10%乙酸或NaOH调节体系pH值为3.0,4.0,5.0,6.0,结果见图5。随着pH值的增大,粒径略增加,使用蒸馏水作为溶剂即可得到较高的包封率,并达到较理想的粒径范围,所以选择蒸馏水作为溶剂。
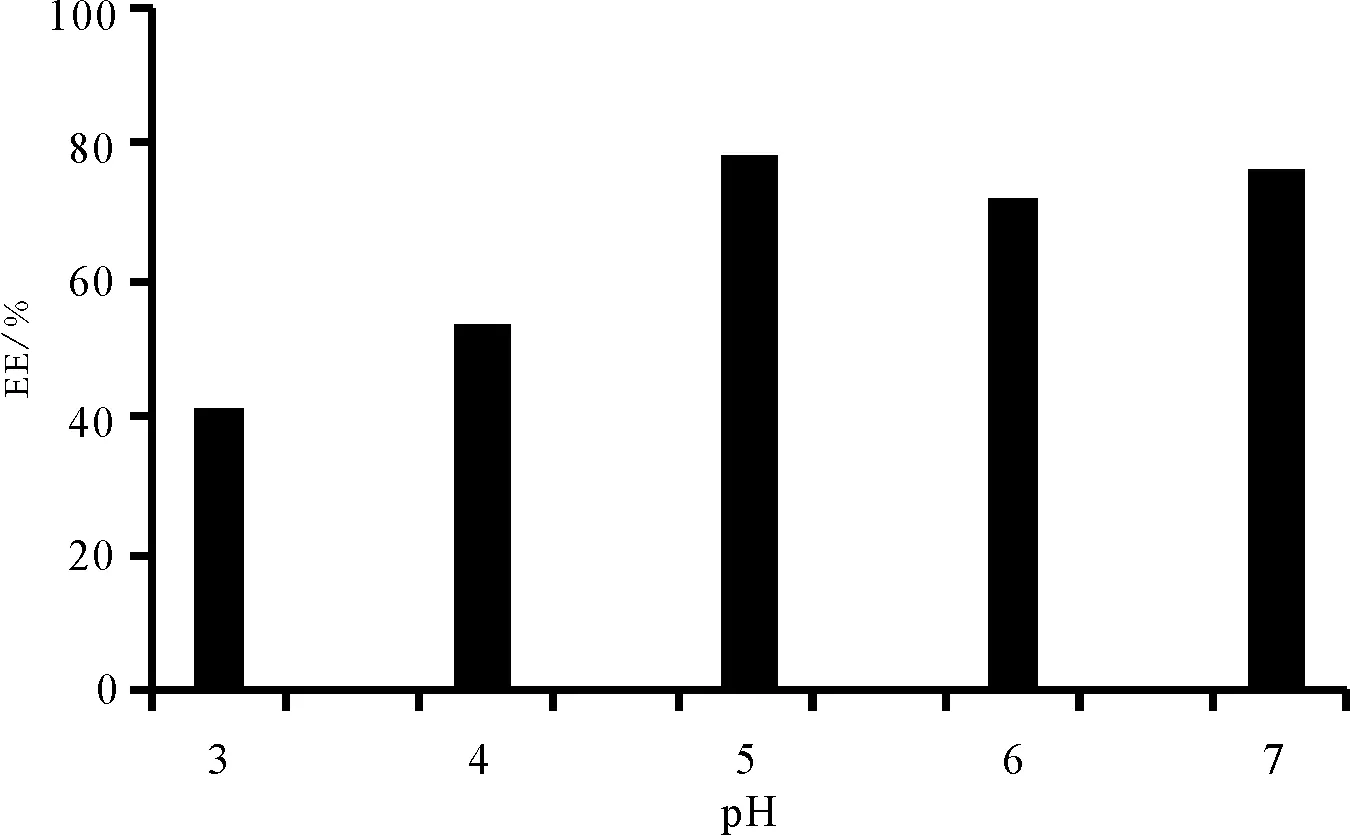
Fig.5 The influence of PH value on the EE(%)of CS-SM
2.4药物浓度对包封率的影响 由于亚微球的形成是利用壳寡糖的游离氨基与TPP阴离子发生分子间或分子内交联反应,所以当壳寡糖和TPP的用量一定时,包裹的药物量是有限的。药物的浓度考察结果见图6,当药物的投药量较小时,具有较好的包封率,随着投药量增加,包封率下降,最终选定药物浓度为2.5 mg·mL-1。
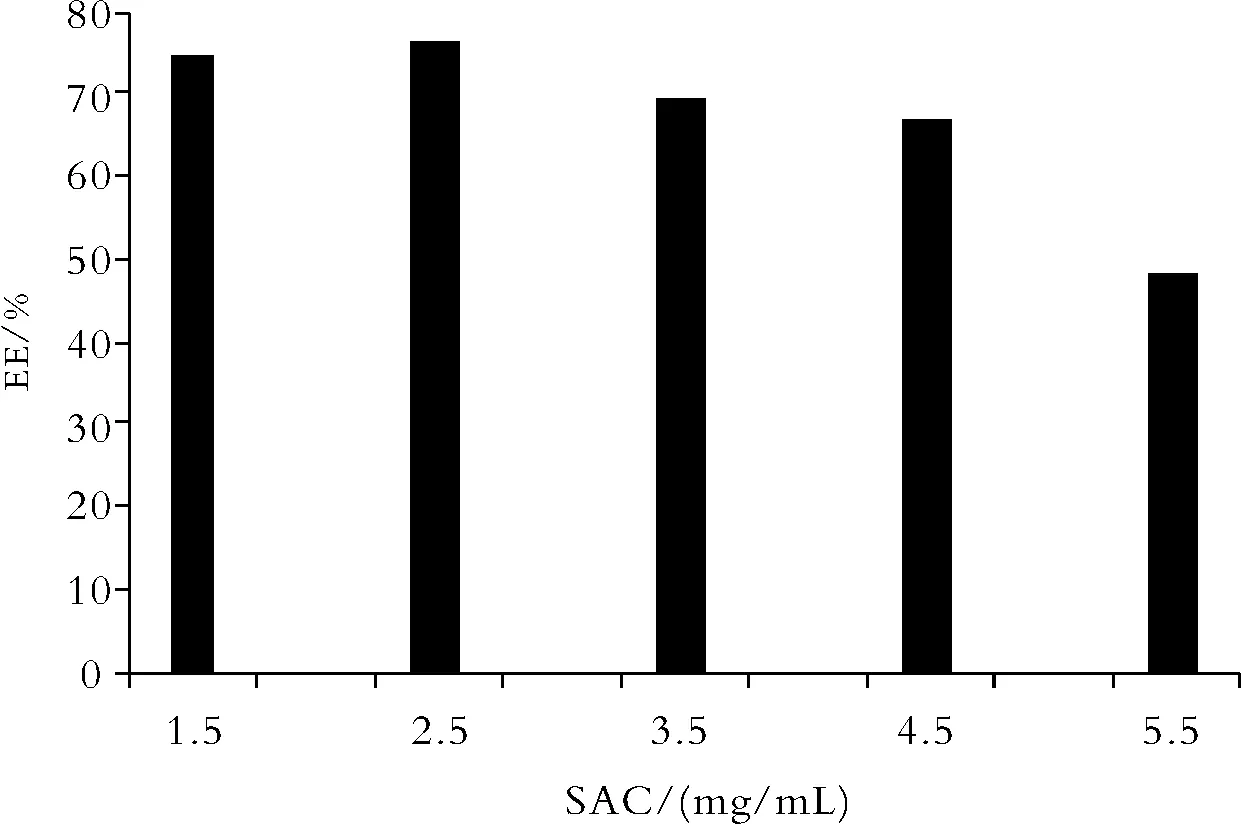
Fig.6 The effect of the concentration of SAC(mg?mL-1)on EE(%)of CS-SM
2.5搅拌速度的影响 TPP溶液在搅拌条件下缓慢滴加到壳寡糖溶液中,搅拌的目的是迅速分散滴加到壳寡糖溶液中的TPP,避免出现局部TPP浓度过高,与大量壳寡糖分子产生凝聚,导致亚微球粒径过大。搅拌速度过快,容易使液体飞溅,造成药液的损失,因此确定搅拌速度为500 r·min-1。
2.6温度的影响 在制备壳寡糖亚微球的过程中,当温度达到60 ℃以上时,溶液出现混浊现象,温度越高,越不利于壳寡糖亚微球的形成,因此实验应于室温下进行。
3 壳寡糖亚微球的表征
3.1粒径及粒度分布测定 根据优化得到的最优处方制备5份SAC亚微球样品,水化后,采用激光粒度测定仪分别测定粒径大小和分布情况,测得粒径(149.00±15.1)nm。图7表明水化后亚微球的粒径分布情况。
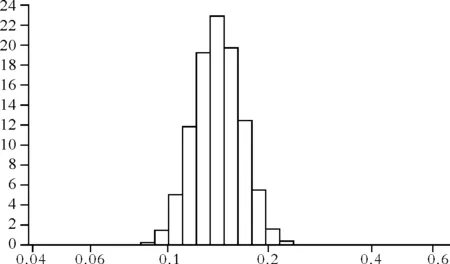
Fig.7 Particle size distribution of SAC chitosan sub microspheres
3.2SAC壳寡糖亚微球ξ-电位的测定 测定结果表明,本研究制得的亚微球带正电荷,测定值为31.5±0.23mV(mean±SD),体系相对稳定。
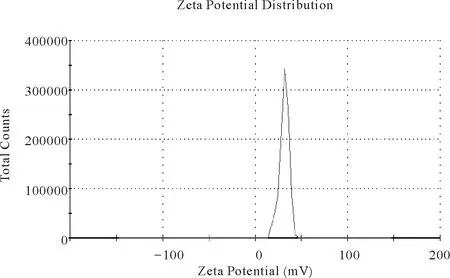
Fig.8 Zeta potential of SAC Chitosan sub microspheres
3.3SAC亚微球的在不同pH下的体外释放 分别考察pH1.2、pH5.5、pH7.4与蒸馏水中的释放曲线。结果表明在酸性条件下药物很快释放,在碱性条件下药物带负电,与带正电的壳寡糖产生较强烈的吸附作用,所以释放较慢,在pH接近pI时,释放较慢,24 h累积释放度为60%。蒸馏水中亚微球表现出一定的缓释效果,18 h的累积释放达85 %。
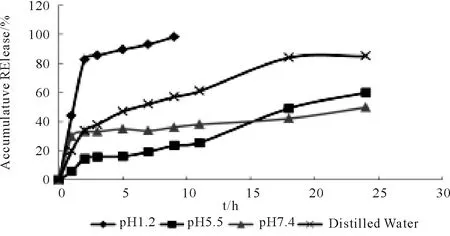
Fig.9 Release Profiles of SAC from SAC chitosan sub microspheres in PBS(pH7.4)at 37℃.
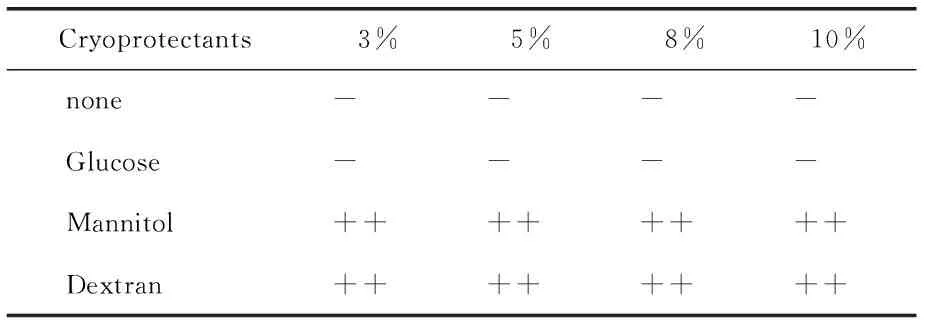
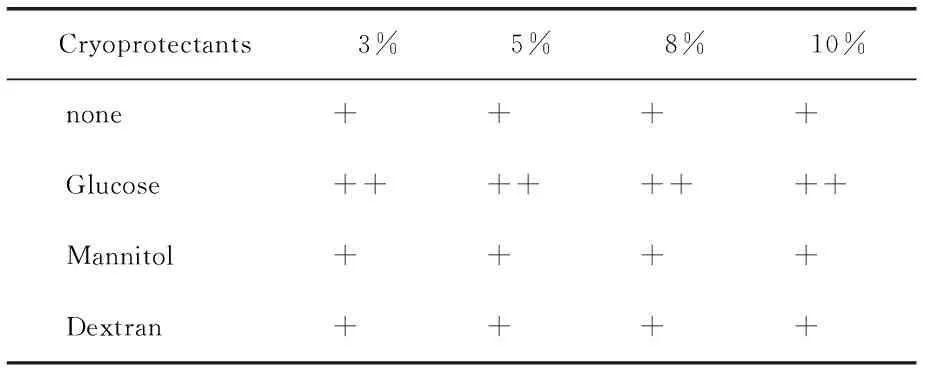
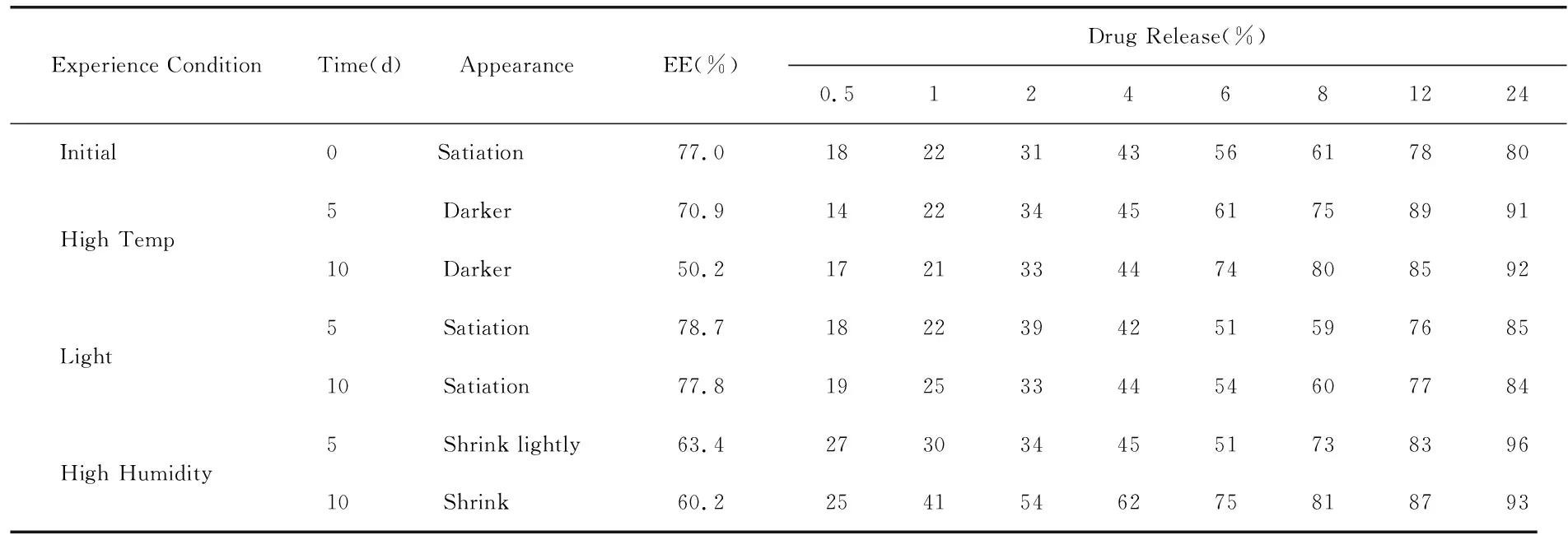
3.4释放曲线模型拟合 分别用零级、一级和Higuchi方程对释放曲线进行拟合,SAC亚微球体外释放模型拟合程度为Higuchi模型>First-order模型> Hixson-Crowell模型> Zero-order模型,所以壳寡糖亚微球释放符合扩散与溶蚀相结合的机制,以扩散为主。亚微球外释放近似于Higuchi模型,采用Ritger-peppas模型进一步分析。0.43 Tab.1 Models for drug release fitting and correlation coefficients of SAC liposomes 亚微球在储存过程中存在物理化学稳定性的问题,聚结而发生沉降[17]。为了提高亚微球物理及化学稳定性,可以采用冷冻干燥技术,将亚微球制成冻干粉末。 4.1预冻温度的考察 预冻温度采用-55~-70℃,采用超低温冰箱-70℃急冻。 4.2干燥时间的考察 对干燥时间进行考察,由结果可知,干燥时间16 h与24 h对试验结果影响不大,为缩短试验周期,最终确定以16 h作为总的干燥时间。 4.3冻干处方的筛选 4.3.1冻干保护剂的筛选 试验研究了葡萄糖、甘露醇、右旋糖苷的保护效果。冻干保护剂的浓度分别为3%、5%、8%、10%,同时以不加冻干支持剂的外观作为对照。以外观、再分散性为评价指标,考察各种支持剂的保护作用。 4.3.1.1外观 冻干品的外观是评价产品质量的一个重要指标,可影响再分散性、放置稳定性、包封率等,考察结果见Tab.2。由试验结果可知,在无冻干保护剂与葡糖糖作支持剂时外观不饱满,甘露醇、右旋糖酐均能形成较好外观。 Tab.2 The appearance of formulations containing different cryoprotectants 4.3.1.2再分散性 样品的再分散性是保证质量的重要考察项目,再分散性好的冻干产品具有好的流动性,试验结果见Tab.3。 Tab.3 Reconstitution of the various cryoprotectant on the character of the freeze-dried product. 与未加保护剂的亚微球相比,葡萄糖作保护剂可达到较好复溶效果。葡萄糖作为保护剂,随着浓度的增加再分散性提高。综上选择合用葡萄糖与甘露醇作为冻干保护剂。对用量进行考察,结果见表4,确定为3%的葡萄糖与3%的甘露醇。 Tab.4 Research on the dosage of conbined cryoprotectants 稳定性试验的目的是考察药物制剂在温度、湿度、光线、空气的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据。 实施影响因素试验内容与结果,将自制SAC壳寡糖冻干产品置于60℃恒温箱、光照强度4500±500Ix中,在相对湿度为75%,分别于第0、5、10天取样,检测外观、含量、释放度,结果见表5。 Tab.5 Stability of SAC chitosan sub microspheres exposed to high temperature 初步稳定性考察结果表明壳寡糖亚微球对高温敏感,颜色变深。光照条件下,各项检测指标均无明显变化。本品对湿度敏感,应低温干燥密闭保存。 壳寡糖(CS)是天然多糖,无毒无刺激,组织相容性好。壳寡糖亚微球的作用特点[18]:①药物缓释和控释作用;②增加药物的吸收作用;③增加药物靶向性和降低药物的副作用;④提高药物稳定性。壳寡糖亚微球已被证实能有效地增强药物通过鼻腔和肠道粘膜上皮的吸收。壳寡糖是一种安全有效的吸收促进剂,能够粘附于粘膜上皮,延长药物与上皮组织的接触时间,并且可以打开上皮细胞之间的紧密连接,促进药物通过上皮组织转运,从而提高药物的生物利用度,细胞毒性远低于分子量较大的壳聚糖[19]。 壳寡糖的粒径、包封率与壳寡糖浓度、壳寡糖与TPP的质量比有关。在一定范围内,随着壳寡糖浓度的增大、壳寡糖与TPP质量比的降低,包封率与粒径显著提高,达到一定值时,包封率下降。由于形成了更多的分子间氢键,更多的分子交联在一起,使颗粒粒径变大,当两者浓度增加到一定程度时,过大的胶粒变成了沉淀[20]。温度也对亚微球的形成有一定的影响,温度过高不利于亚微球的形成,在低温状态下较易形成亚微球。在较低pH下形成的亚微球粒径较小,包封率也较低,本文选择在中性pH下制备亚微球,可以以蒸馏水作为介质。壳寡糖在蒸馏水中荷正电,对于SAC有较高的包封率,所制得的亚微球在蒸馏水中可以缓慢释药18h,在碱性条件下可以缓释24h以上,在酸性条件下释放较快。 亚微球冻干品以葡萄糖和甘露醇作为冻干保护剂,可以得到较饱满的外观并且再分散性良好,冻干品复溶后,粒径变化较小。与脂质体相比较,壳寡糖亚微球具有较高的包封率和载药量,但其对释放介质的pH较敏感,在较低pH值下释放较快,如作为口服制剂,在胃内会产生一定的释放加快现象。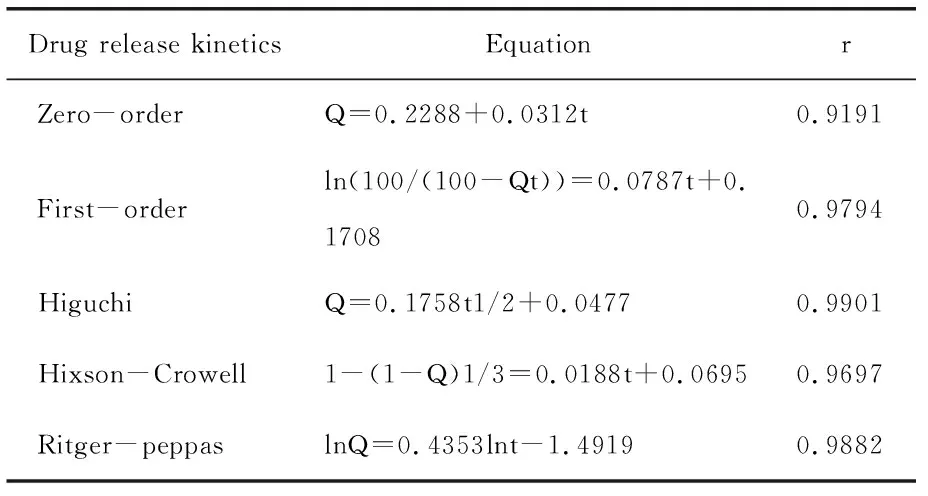
4 SAC壳寡糖亚微球的冻干

5 SAC壳寡糖亚微球初步稳定性考察
6 讨论

