褪黑素对脂多糖诱导的奶牛乳腺上皮细胞炎症反应的缓解作用
李洪洋 南雪梅 孙 鹏
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
奶牛乳房炎是一种高发性多因素疾病,生理状态、营养水平、环境条件、管理制度等方面的差异均有可能引起奶牛乳房炎的发生,导致产奶量和乳品质受到影响,致使牧场经济效益大幅降低[1]。病源微生物是引起奶牛患乳房炎的主要原因之一,常见的致病菌包括金黄色葡萄球菌、大肠杆菌和无乳链球菌,涵盖革兰氏阳性菌与革兰氏阴性菌两大类[2-3],它们分布于空气、水体以及奶牛可接触物体表面,极易导致奶牛罹患乳房炎。致病菌由乳头导管入侵并进入乳腺组织,随后引发感染和炎症反应[4]。由于前期治疗乳房炎的有效药物较少,使得抗生素凭借显著的抗菌效果受到广泛应用。但随着抗生素的大量使用,由其导致了耐药性、药物残留以及由此引发的食品安全等问题,因此,亟需寻求更为安全有效且成本低廉的天然活性物质以替代抗生素。
褪黑素(melatonin,MT)是一种主要由松果体合成分泌的吲哚类激素[5],其在皮肤[6]、骨髓[7]、视网膜[8]、线粒体[9]亦可少量合成,在体内分布广泛,成为重要的“同步信号”,可有效调控机体的生物节律[10]。随着相关研究的深入,发现MT可发挥抗氧化[11]和免疫[12]等生物学效应。研究证实,MT及其多级代谢产物具有强大的抗氧化功能,是一种有效的自由基捕获剂[13]。除自身强有力的抵抗自由基的活性外,MT还能够通过促进抗氧化物酶的生成和增效抗氧化物酶的活性,从而发挥抗氧化效应[14]。研究表明,MT对免疫细胞具有增殖及增效作用,MT在谷胱甘肽和谷胱甘肽还原酶缺乏的情况下,可参与维持中性粒细胞的活性和功能[15]。MT与T细胞的关系也十分密切,现已证实T细胞内含有合成MT所需的4种酶类,并可在特定情况下高水平分泌。同时,MT对T细胞的激活和分化也存在调控功能,尤其是辅助性T细胞17(Th17)、调节性T细胞(Treg)和记忆T细胞[16]。近年来,除MT清除体内自由基、促进免疫应答的功能外,其抗炎效应亦受到广泛关注[17]。因此,本试验旨在通过脂多糖(lipopolysaccharide,LPS)诱导奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)炎症反应模型,探究MT对LPS引起的BMECs炎症反应的缓解作用及潜在机制,为应用MT防治奶牛乳房炎提供科学依据。
1 材料与方法
1.1 试验材料
BMECs获赠于北京畜牧兽医研究所智慧畜牧业创新团队,液氮保存;LPS[大肠杆菌(E.coli)O55∶B5]购自美国Sigma公司;MT购自上海易恩化学技术有限公司;胎牛血清(fetal bovine serum,FBS)、DMEM+GlutaMAX培养基、F-12培养液、D-Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS,不含钙、镁)、0.05%胰蛋白酶(trypsin)-乙二胺四乙酸(EDTA)消化液和Pen Strep双抗混合液购自美国Thermo Fisher公司;肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素-6(interleukin 6,IL-6)和白细胞介素-1β(interleukin 1β,IL-1β)的酶联免疫吸附测定(ELISA)试剂盒购自上海瑞番生物科技有限公司;四甲基偶氮唑蓝[3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,MTT]细胞增殖及细胞毒性检测试剂盒购自北京酷来博科技有限公司,Western blot相关试验材料购自上海碧云天公司;一抗β-肌动蛋白(β-actin)和核因子-κB同源蛋白(P65)购自美国Immuno Way公司,Toll样受体4(TLR4)购自美国Santa Cruz公司,核因子-κB抑制蛋白(IκB-α)购自美国CST公司;二抗购自美国Jackson ImmunoResearch公司。
1.2 试验方法
1.2.1 BMECs的培养
BMECs复苏后,使用完全培养基(DMEM/F12,含10% FBS和1%双抗)于37 ℃、5%二氧化碳(CO2)培养,传3~8代后用于后续试验[18]。
1.2.2 LPS炎性模型构建
1.2.2.1 LPS处理液的配制
将10 mg LPS溶解于10 mL HBSS(含1%双抗)配制1 mg/mL的LPS储存液,分装后-20 ℃储存。使用时取1 mL储存液溶于9 mL的无血清DMEM/F12培养基(含1%双抗)配制100 μg/mL处理母液,再通过稀释添加不同体积无血清DMEM/F12培养基(含1%双抗)进一步配制浓度分别为0.1、0.5、1.0、5.0和10.0 μg/mL的LPS处理液,现用现配[10]。
1.2.2.2 LPS诱导BMECs炎症反应模型
将BMECs按1×104个/孔接种于96孔板,每孔加入基础培养基200 μL,边缘孔各加入200 μL HBSS,培养24 h后,更换无血清DMEM/F12培养基(含1%双抗)培养12 h。随后每列分别更换为不同浓度(0、0.1、0.5、1.0、5.0和10.0 μg/mL)的LPS处理液100 μL,继续分别培养6和12 h,每个浓度设6个重复。预试验中,与0 μg/mL组相比,细胞活性和炎性因子水平出现显著差异视为炎症诱导成立[19]。
1.2.2.3 MTT检测法
按照MTT细胞增殖及细胞毒性检测试剂盒说明书,避光条件下每孔加入20 μL MTT溶液,培养处理4 h;取出后每孔加入100 μL二甲基亚砜(DMSO)终止反应,摇床10 min后,用酶标仪(SpectraMax M5,美国Molecular Devices公司)在570 nm处测定吸光度。
1.2.2.4 炎性细胞因子含量检测
按ELISA测定试剂盒说明书进行TNF-α、IL-6、IL-1β含量检测,用酶标仪在450 nm处测定吸光度。
1.2.3 MT对BMECs活性的影响
1.2.3.1 MT处理液的配制
称取0.023 2 g MT溶解于1 mL乙醇中[10],再将溶解于乙醇的MT样品溶解于99 mL无血清DMEM/F12培养基(含1%双抗),配制浓度为1 mmol/L的MT储存液,以10 mL为单位分装后-20 ℃储存。使用时10 mL储存液1∶9稀释于无血清DMEM/F12培养基(含1%双抗)配制处理母液,再用无血清DMEM/F12培养基(含1%双抗)进一步配制浓度分别为1、5、10、50和100 μmol/L的MT处理液,现用现配。
1.2.3.2 MT对BMECs活性的影响
将BMECs按1×104个/孔接种于96孔板,每孔加入基础培养基200 μL,边缘孔各加入200 μL HBSS,培养24 h后,更换DMEM/F12培养基(不含FBS,含1%双抗)培养12 h。随后每列分别更换为不同浓度(0、1、5、10、50和100 μmol/L)的MT处理液100 μL,继续分别培养48 h。每个浓度设6个重复,利用MTT法测定细胞活性。
1.2.4 MT对LPS诱导的BMECs炎症反应的影响
试验共分为7组,对照组(C组)BMECs不进行LPS诱导和MT处理,LPS组BMECs进行LPS诱导12 h,LPS+MT组BMECs进行LPS诱导12 h后再经不同浓度(1、5、10、50和100 μmol/L)MT处理48 h。每组设4个重复。
1.2.5 炎性细胞因子含量检测
按ELISA测定试剂盒说明书对各组的细胞培养基进行炎性细胞因子(TNF-α、IL-6、IL-1β)含量检测,使用酶标仪于450 nm处测定其吸光度值。
1.2.6 Western blot检测炎症反应相关蛋白的表达
使用HBSS清洗各组BMECs样本。在细胞培养皿中添加细胞裂解液,用细胞刮刀刮取细胞后,将悬液移至新的做好标记的1.5 mL离心管中放在冰上进行充分裂解。4 ℃、12 000 r/min离心10 min后,将样品的上清液移入离心管中。测定蛋白浓度,并调整蛋白浓度一致为4.0 μg/μL。随后制备十二烷基硫酸钠-聚丙烯酰胺凝胶电泳凝胶,待胶体凝后将胶板组装于电泳槽中,倒满电泳缓冲液依次加样20 μg/孔。随后120 V、15 min和200 V、45 min进行电泳。电泳结束后采用三明治湿转法,用提前配制好的转膜液进行转膜。随后,对膜进行封闭和一抗、二抗孵育,置于全自动化学发光仪(Tanon,5200)中显色后,使用Image J分析软件V1.8.0分析条带的灰度值。
1.3 数据处理与分析
试验数据采用Excel 365进行整理,应用SPSS 19.0软件进行统计,MTT法和Western blot检测的试验结果进行独立t检验,ELISA法的试验结果进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较。P<0.05代表差异显著,P<0.01代表差异极显著。试验结果用平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 LPS诱导BMECs炎症细胞模型
预试验中,利用MTT法测定细胞活性和ELISA法测定TNF-α、IL-6和IL-1β含量,确定LPS诱导细胞炎症模型的处理浓度为10 μg/mL,处理时间为12 h。
2.2 MT对BMECs活性的影响
不同浓度(1、5、10、50和100 μmol/L)的MT作用于BMECs 48 h后,采用MTT法测定细胞活性,结果如图1所示,不同浓度的MT处理对BMECs活性无显著影响(P>0.05),其中1和5 μmol/L MT组BMECs活性较高。

数据柱标注不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。图2同。
2.3 MT对LPS诱导的BMECs炎性因子含量的影响
如图2所示,LPS诱导的BMECs中TNF-α、IL-6和IL-1β含量升高,其中,LPS组BMECs中IL-6和IL-1β含量显著高于对照组(P<0.05),LPS组BMECs中TNF-α含量与对照组差异不显著(P>0.05)。BMECs经MT处理48 h后,与LPS组相比,10和50 μmol/L MT组BMECs中TNF-α含量显著降低(P<0.05),1、5、10和100 μmol/L MT组BMECs中IL-6含量显著降低(P<0.05),10 μmol/L MT组BMECs中IL-1β含量显著降低(P<0.05)。综上所述,10 μLPS组的MT对LPS诱导的BMECs炎性因子含量升高的抑制效果最显著。
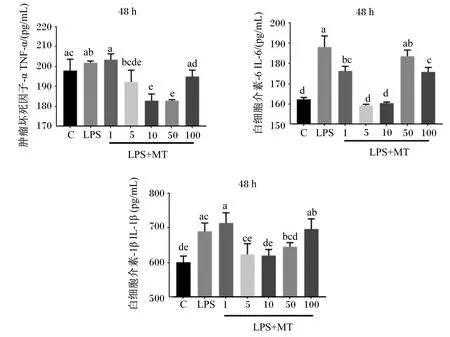
C代表对照组;LPS代表LPS组;LPS+MT代表LPS+MT组;1、5、10、50、100分别代表1、5、10、50、100 μmol/L的MT。下图同。
2.4 MT对LPS诱导的BMECs中TLR4、P65和IκB-α蛋白表达量的影响
如图3所示,与对照组相比,LPS组BMECs中TLR4蛋白表达量有所升高(P>0.05);与LPS组相比,不同剂量MT处理的BMECs中TLR4蛋白表达量均有所下降,其中50和100 μmol/L MT组差异显著(P<0.05)。与对照组相比,LPS组BMECs中P65蛋白表达量显著降低(P<0.05);与LPS组相比,不同剂量MT处理的BMECs中P65蛋白表达量均有所升高,其中1和50 μmol/L MT组差异显著(P<0.05),10 μmol/L MT组差异极显著(P<0.01)。与对照组相比,LPS组BMECs中P65蛋白表达量显著降低(P<0.05);与LPS组相比,不同剂量MT处理的BMECs中IκB-α蛋白表达量均有所升高,其中1、10和50 μmol/L MT组差异显著(P<0.05),5 μmol/L MT组差异极显著(P<0.01)。

数据柱标注*表示与LPS组相比差异显著(P<0.05),标注**表示与LPS组相比差异极显著(P<0.01)。
3 讨 论
3.1 MT对LPS诱导的BMECs炎症反应的影响
近年来,相继发现MT的抗氧化、免疫和抗炎等生物学效应[11-12,17],利用MT作为抗炎药物缓解奶牛乳房炎不失为一种可尝试的新思路。LPS作为大肠杆菌外膜的组成成分,利用其诱导BMECs建立体外炎症模型在奶牛乳房炎的防治研究中被广泛应用[18]。因此,本试验旨在探究MT对LPS诱导的BMECs炎症反应的影响。本试验结果显示,MT能够降低LPS诱导的BMECs中炎性细胞因子含量,抑制TLR4蛋白表达量,抑制P65蛋白表达量的降低,升高IκB-α蛋白表达量,表明本试验中MT对LPS诱导的BMECs的炎症反应具有缓解作用。
3.2 MT对LPS诱导的BMECs中炎性细胞因子含量的影响
研究表明,体内细胞因子含量的变化是诱发机体炎症反应的主要原因[20]。TNF-α、IL-1β和IL-6作为炎性细胞因子,在体内具有重要的信息传递作用[21]。它们与细胞中含有的特异性受体结合后,通过不同的信号传导通路激发机体的免疫应答反应。现有研究发现,MT进行预处理的Caco-2细胞再经IL-1β炎症诱导时,其炎性因子IL-6含量与对照组相比有所降低,表明MT对炎症反应具有预防作用[22]。由于乳房炎属于一种防治兼顾的炎症疾病,因此本试验重点研究其对BMECs炎症反应的治疗功效。本试验中测定了MT对LPS诱导12 h后BMECs培养上清液中TNF-α、IL-1β和IL-6含量的影响,发现经LPS诱导12 h后BMECs培养上清液中TNF-α、IL-1β和IL-6含量显著升高,加入MT后显著抑制了以上炎性细胞因子含量的升高,且基于这3种炎性细胞因子的综合抑制效果发现,10 μmol/L MT的作用效果最佳,表明MT对LPS诱导的BMECs炎症反应具有缓解作用。与本试验结果相似,Mishra等[23]利用高浓度乙醇诱导小鼠肝脏组织损伤后,发现肝细胞中TNF-α、IL-1β和IL-6含量显著升高,添加MT后得到有效抑制。Naveen等[24]研究发现,支气管炎、鼻炎、肺纤维化及哮喘等疾病发生时,炎性细胞因子含量大幅升高,MT通过细胞外信号调节激酶1/2(ERK1/2)和磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路抑制了肺部成纤维细胞中炎性细胞因子的过度表达,因此MT对BMECs中炎性细胞因子的抑制亦与信号通路密切相关。
3.3 MT对LPS诱导的BMECs中TLR4、P65和IκB-α蛋白表达的影响
研究发现,TLR4可识别LPS并通过信号传导激活核因子-κB(NF-κB)[25]。NF-κB是一种转录因子,广泛参与炎症反应和先天性免疫应答等细胞活动。正常生理状态下,NF-κB与NF-κB抑制蛋白(IκB)结合,以无活性的NF-κB/IκB复合物形式存在于细胞质中。LPS作为一种外源性激活剂,能够刺激IκB激酶活化,导致IκB发生磷酸化并被降解,引发NF-κB/IκB复合物解聚,从而使NF-κB活化并被释放进入细胞核内,与特定基因的启动位点结合并调控相关基因的转录和翻译。研究表明,MT可通过抗氧化级联反应清除过量的自由基,抑制细胞因子,从而调控NF-κB介导的炎症反应[26],MT也能够直接调控NF-κB激发的炎症信号通路[27]。因此,MT对于BMECs炎症反应的缓解作用与NF-κB信号通路密切相关。本试验中,MT能够影响LPS诱导的BMECs中TLR4、P65和IκB-α蛋白表达量。MT处理BMECs 48 h后,不同剂量MT均能够抑制TLR4蛋白表达量,且50和100 μmol/L MT组差异显著,表明MT可能通过TLR4调控NF-κB介导的炎症反应。不同剂量MT均抑制了LPS引起的P65蛋白表达量的降低,使其趋于对照组的正常水平,其中10 μmol/L MT组效果最显著。与LPS组相比,不同剂量MT对IκB-α蛋白表达量均呈现促进效果,其中5 μmol/L MT组差异极显著,表明MT通过促进IκB-α蛋白的表达,使NF-κB以无活性的复合物形式存在,从而抑制NF-κB引起的炎症反应。Shao等[28]研究发现,MT有效抑制LPS诱导的小鼠乳腺上皮细胞中TLR4蛋白表达量,P65和IκB蛋白的磷酸化水平被显著抑制,P65和IκB蛋白表达量有所升高,与本试验结果一致。综上所述,MT通过调控TLR4、P65和IκB-α的蛋白表达参与NF-κB炎症通路,缓解LPS诱导的BMECs炎症反应。
4 结 论
① MT能够降低LPS诱导的BMECs中TNF-α、IL-1β和IL-6含量,且10 μmol/L MT组作用效果最佳。
② MT能够抑制LPS诱导的BMECs中TLR4蛋白表达量的升高,并对P65和IκB-α蛋白表达量具有调控作用,MT可能通过参与NF-κB炎症通路缓解LPS诱导的BMECs炎症反应。

